江苏省扬州市高邮市2021年中考化学一模试卷
试卷更新日期:2021-05-21 类型:中考模拟
一、单选题
-
1. 空气质量决定生活质量。下列物质不属于空气污染物的是( )A、PM2.5 B、O2 C、SO2 D、NO22. Na2CO3俗称苏打、纯碱。Na2CO3属于( )A、氧化物 B、盐 C、有机物 D、混合物3. 科学家合成的环状碳分子 具有广泛的应用前景。1个环状碳分子 中共含有18个( )A、原子 B、质子 C、中子 D、电子4. 从海水中提取溴时发生反应: ,该反应的基本类型为( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应5. 氮元素形成的化合物种类较多,下列化合物中氮元素化合价为+2价的是( )A、NO B、N2O3 C、NH3 D、N2O56. 化学是人类进步的阶梯。下列说法错误的是( )A、新能源的推广利用,节约了化石燃料 B、新材料应用于航空制造,利用的都是其物理性质 C、煤炭的脱硫处理,能有效减少酸雨的形成 D、新药品的研发,可为生命健康提供保障7. 生活中常使用消毒剂来杀菌、消毒。下列几种消毒液的有效成分(括号内物质)中,氧元素的质量分数最大的是( )A、双氧水消毒液(H2O2) B、“84"消毒液(NaClO) C、酒精消毒液(C2H5OH) D、过氧乙酸消毒液(C2H4O3)8. 七氟丙烷(C3HF7)灭火剂容易汽化不留残渣,适用于电器、精密仪器、图书档案等灭火,根据上述信息可以推测七氟丙烷具有的性质是( )A、导电性 B、腐蚀性 C、不助燃 D、沸点高9. 分类和归纳是行之高效的学习方法。下列说法错误的是( )A、锂、汞都属于金属元素 B、锌、钙都属于人体必需微量元素 C、塑料、玻璃钢都属于合成材料 D、葡萄糖(C6H12O6)、甲烷都属于有机物10. 一定条件下在密闭容器里加热冰,温度和时间的关系如图所示,①②③表示水在不同时刻的存在状态。下列有关判断正确的是( )
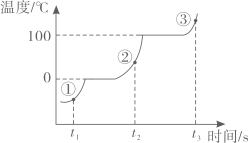 A、水分子间的间隔:②>③ B、水分子的运动速率:①>③ C、水分子的质量:①=②=③ D、②→③的过程中水发生了分解11. 下列变化过程中,不包含缓慢氧化的是( )A、动植物的呼吸 B、食盐的溶解 C、金属锈蚀 D、食物腐败12. 醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在有一定浓度的H+。下列关于醋酸的分析中正确的是( )A、醋酸属于氧化物 B、醋酸可用以除铁锈 C、醋酸能使无色酚酞试液变红 D、60g醋酸中碳元素的质量为48g13. 对比是学习化学的重要方法,下列关于二氧化碳和一氧化碳的比较,完全正确的是( )A、组成:CO2、CO均由碳元素和氧元素组成 B、性质:CO2、CO都有可燃性 C、用途:CO2可用于灭火;CO可用于人工降雨 D、危害:CO2会导致酸雨;CO会引起中毒14. 氨催化氧化是工业制硝酸的主要反应之一,图为该反应的微观模拟。下列说法正确的是( )
A、水分子间的间隔:②>③ B、水分子的运动速率:①>③ C、水分子的质量:①=②=③ D、②→③的过程中水发生了分解11. 下列变化过程中,不包含缓慢氧化的是( )A、动植物的呼吸 B、食盐的溶解 C、金属锈蚀 D、食物腐败12. 醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在有一定浓度的H+。下列关于醋酸的分析中正确的是( )A、醋酸属于氧化物 B、醋酸可用以除铁锈 C、醋酸能使无色酚酞试液变红 D、60g醋酸中碳元素的质量为48g13. 对比是学习化学的重要方法,下列关于二氧化碳和一氧化碳的比较,完全正确的是( )A、组成:CO2、CO均由碳元素和氧元素组成 B、性质:CO2、CO都有可燃性 C、用途:CO2可用于灭火;CO可用于人工降雨 D、危害:CO2会导致酸雨;CO会引起中毒14. 氨催化氧化是工业制硝酸的主要反应之一,图为该反应的微观模拟。下列说法正确的是( ) A、甲中氮、氢元素质量比为1∶3 B、该反应前后分子数目没有改变 C、两种生成物均为化合物 D、生成的丙、丁两物质的质量比为10∶1815. 草酸钙(CaC2O4)可用以陶瓷上釉、制草酸,受热比碳酸钙易分解,草酸钙受热分解的化学方程式为: 。现将12.8gCaC2O4固体加热一段时间后剩余7.8g固体。下列说法错误的是( )A、剩余固体为混合物 B、剩余固体中含钙元素的质量为4.0g C、将剩余固体溶于过量的稀盐酸,产生2.2gCO2 D、将加热产生的气体全部通入足量澄清石灰水中,理论可生成10.0gCaCO3固体16. 物质的性质决定物质的用途。下列相关物质的性质与其用途不匹配的是( )A、石墨质软—用作电池的电极材料 B、不锈钢耐腐蚀—制造医疗器械 C、熟石灰显碱性—用来改良酸性土壤 D、N2不可燃—用粮食瓜果的保护气17. 实验是研究化学的重要途径。下列实验方案设计错误的是( )A、观察颜色:区分铁片和铜片 B、闻气味:区分氧气和氮气 C、用水溶解:区分硝酸铵和氯化钠 D、尝味道:区分厨房中的蔗糖和食盐18. 下图中,图一为四种物质的溶解度曲线,在图二中分别向两支试管内滴加一定量的水后,X和Y的饱和溶液均变浑浊,则下列说法错误的是( )
A、甲中氮、氢元素质量比为1∶3 B、该反应前后分子数目没有改变 C、两种生成物均为化合物 D、生成的丙、丁两物质的质量比为10∶1815. 草酸钙(CaC2O4)可用以陶瓷上釉、制草酸,受热比碳酸钙易分解,草酸钙受热分解的化学方程式为: 。现将12.8gCaC2O4固体加热一段时间后剩余7.8g固体。下列说法错误的是( )A、剩余固体为混合物 B、剩余固体中含钙元素的质量为4.0g C、将剩余固体溶于过量的稀盐酸,产生2.2gCO2 D、将加热产生的气体全部通入足量澄清石灰水中,理论可生成10.0gCaCO3固体16. 物质的性质决定物质的用途。下列相关物质的性质与其用途不匹配的是( )A、石墨质软—用作电池的电极材料 B、不锈钢耐腐蚀—制造医疗器械 C、熟石灰显碱性—用来改良酸性土壤 D、N2不可燃—用粮食瓜果的保护气17. 实验是研究化学的重要途径。下列实验方案设计错误的是( )A、观察颜色:区分铁片和铜片 B、闻气味:区分氧气和氮气 C、用水溶解:区分硝酸铵和氯化钠 D、尝味道:区分厨房中的蔗糖和食盐18. 下图中,图一为四种物质的溶解度曲线,在图二中分别向两支试管内滴加一定量的水后,X和Y的饱和溶液均变浑浊,则下列说法错误的是( )
 A、10℃时,物质溶解度大小关系为:①>③>②>④ B、X为Ce2(SO4)3 , Y不一定是NH4H2PO4 C、若NHH2PO4中混有少量的NaCl杂质,可在较高温度配成饱和溶液,再降温结晶除去 D、20℃时,将40NaCl加入到100g水中,所得溶液中溶质和溶剂的质量比是2:519. CuCl2是一种重要的化工原料。图为工业上向Cu与稀盐酸的混合物中通空气制CuCl2的原理下列说法错误的是( )
A、10℃时,物质溶解度大小关系为:①>③>②>④ B、X为Ce2(SO4)3 , Y不一定是NH4H2PO4 C、若NHH2PO4中混有少量的NaCl杂质,可在较高温度配成饱和溶液,再降温结晶除去 D、20℃时,将40NaCl加入到100g水中,所得溶液中溶质和溶剂的质量比是2:519. CuCl2是一种重要的化工原料。图为工业上向Cu与稀盐酸的混合物中通空气制CuCl2的原理下列说法错误的是( ) A、反应过程中不需要持续添加FeCl3溶液 B、该实验说明Cu能与稀盐酸发生置换反应 C、缓缓通入足量的空气,能提高铜的利用率 D、理论上最终获得CuCl2与消耗氧气的质量比为135∶32
A、反应过程中不需要持续添加FeCl3溶液 B、该实验说明Cu能与稀盐酸发生置换反应 C、缓缓通入足量的空气,能提高铜的利用率 D、理论上最终获得CuCl2与消耗氧气的质量比为135∶32二、多选题
-
20. 化学是一门实用性学科。下列说法不符合化学常识的是( )A、可用肥皂水鉴别硬水和软水 B、灼烧,闻气味可鉴别羊毛与蚕丝 C、金属铝表面的氧化膜对铝起保护作用 D、金属铁锈蚀的过程是物理变化
三、填空题
-
21. “米袋子”、“菜篮子”的丰盈寓意着人们生活的富足。(1)、“米袋子”中的大米富含淀粉,可向待检验物中滴加试剂以检验其存在;富含淀粉的物质发酵能获得乙醇(C2H6O),乙醇可用作燃料,请写出其完全燃烧的化学方程式。(2)、“菜篮子”中包含多种蔬菜和水果,它们富含维生素C,人体如果缺乏维生素C可能会引起病。维生素C属于水溶性维生素,为减少其在蔬菜洗涤过程中的损耗,可采取的措施是(填“先洗后切”或“先切后洗”)。(3)、食盐几乎是不可或缺的调味品。碘元素是人体所需的(填“常量”或“微量”)元素,加碘食盐中“碘”元素的添加可以预防病。(4)、为提高粮食产量,农业生产中要合理使用化肥,请写出一种常见的复合肥。(5)、下列有关饮食安全的说法正确的是。
a 霉变粮食煮熟后即可食用 b 用成分为聚乙烯的塑料包装食品
c 甲醛有防腐作用,可以用来浸泡食材 d 脂肪、蛋白质都是人体必需的营养素,吃得越多越好
22. 化学兴趣小组开启“探镁之旅”,诚邀你的参与。(1)、如图为镁元素在周期表中的相关信息。镁元素的原子序数为 , 相对原子质量是。 (2)、镁是一种银白色的金属,长期暴露在空气中的镁条表面会变得灰暗,但若用手撕断镁条,断口处则呈现出银白色。可见,金属镁的硬度(填“较大”或“较小”),请写出一种使表面灰暗的镁条恢复光亮的物理方法。(3)、向盛有打磨过镁条的试管中倾入适量稀盐酸,镁条表面产生大量气泡,试管外壁发烫,可见镁与稀盐酸的反应(填“释放”或“吸收”)热量,请写出该反应的化学方程式;若立即用大拇指堵住试管口,片刻后用燃着的木条靠近试管口,可听到尖锐的爆鸣声。由此可知氢气具有的化学性质。(4)、镁条能与氧气反应,其在空气中燃烧,产生耀眼的白光,生成一种白色固体,放出热量。请写出该反应的化学方程式 , 结合镁燃烧的实验现象写出镁的一种用途。(5)、结合本题及你的已有认知,请为实验室保存镁条提一条可行性建议。
(2)、镁是一种银白色的金属,长期暴露在空气中的镁条表面会变得灰暗,但若用手撕断镁条,断口处则呈现出银白色。可见,金属镁的硬度(填“较大”或“较小”),请写出一种使表面灰暗的镁条恢复光亮的物理方法。(3)、向盛有打磨过镁条的试管中倾入适量稀盐酸,镁条表面产生大量气泡,试管外壁发烫,可见镁与稀盐酸的反应(填“释放”或“吸收”)热量,请写出该反应的化学方程式;若立即用大拇指堵住试管口,片刻后用燃着的木条靠近试管口,可听到尖锐的爆鸣声。由此可知氢气具有的化学性质。(4)、镁条能与氧气反应,其在空气中燃烧,产生耀眼的白光,生成一种白色固体,放出热量。请写出该反应的化学方程式 , 结合镁燃烧的实验现象写出镁的一种用途。(5)、结合本题及你的已有认知,请为实验室保存镁条提一条可行性建议。四、综合应用题
-
23. 某班级同学分组进行碳的性质实验并回收实验后的固体制取胆矾。(1)、按图进行碳和氧化铜反应的实验,观察到试管中出现红色固体、烧杯中澄清石灰水变浑浊。若生成的红色固体全是铜,请写出试管中反应的化学方程式。
 (2)、上述实验结束后,回收试管内的固体残渣用以制取胆矾(CuSO4•5H2O)。为将其中的铜元素全部转化到硫酸铜中,有关实验设计如图。
(2)、上述实验结束后,回收试管内的固体残渣用以制取胆矾(CuSO4•5H2O)。为将其中的铜元素全部转化到硫酸铜中,有关实验设计如图。
①请以化学用语表示CuSO4中铜元素的化合价。
②回收得到的固体残渣中可能含有铜、碳、氧化铜。请根据①中的实验,写出固体残渣中可能含有氧化铜的一个原因。
③图2溶液中溶质主要是CuSO4请将“固体残渣”转化为“溶液”所需的实验步骤补充完整(在各步骤中须写明所用试剂及进行的操作)。
④图2流程中由CuSO4溶液制得胆矾晶体的系列操作主要是蒸发浓缩和结晶(填“蒸发”或“降温”)
⑤实验开始时称得氧化铜粉末得质量为4g,求理论上可制得胆矾的质量。(请写出解题过程)
24. “粗盐的初步提纯”是九年级化学基础实验之一
 (1)、仪器②的名称是。(2)、在过滤粗盐水时,除用到④⑤⑧,还需用到图中的一种玻璃仪器是(填名称),过滤操作中该仪器的作用是。若过滤时发现滤液仍然浑浊,该如何操作?(3)、蒸发结晶食盐,除用到②⑥⑧⑨,还需用到图中的仪器是(填名称),进行蒸发操作时,待蒸发皿中出现较多量固体时即可停止加热,如此操作的主要原因是 。(4)、用提纯得到的“精盐”配制100g7.5%的氯化钠溶液(称取药品时1g以下用游码),应选用量筒的规格为mL。经检测,溶质质量分数偏小。其原因可能有(填字母)。
(1)、仪器②的名称是。(2)、在过滤粗盐水时,除用到④⑤⑧,还需用到图中的一种玻璃仪器是(填名称),过滤操作中该仪器的作用是。若过滤时发现滤液仍然浑浊,该如何操作?(3)、蒸发结晶食盐,除用到②⑥⑧⑨,还需用到图中的仪器是(填名称),进行蒸发操作时,待蒸发皿中出现较多量固体时即可停止加热,如此操作的主要原因是 。(4)、用提纯得到的“精盐”配制100g7.5%的氯化钠溶液(称取药品时1g以下用游码),应选用量筒的规格为mL。经检测,溶质质量分数偏小。其原因可能有(填字母)。a 氯化钠固体不纯 b 称量时精盐和砝码放反了
c 量取水时俯视读数 d 装瓶时有少量溶液洒出
(5)、反思:上述实验得到的精盐可能仍然为混合物,其中可能含有(填“可溶性”或“难溶性”)杂质。(6)、探究氨盐水与二氧化碳的反应。步骤1:取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2:向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
(提出问题)晶体的成分是什么?
(定性初探)①甲同学取少量已洗净的晶体于试管中,加入NaOH溶液,微热,在试管口放一张试纸,无明显现象产生,证明晶体中不含铵盐。
②乙同学另取已洗净晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加(填化学式)溶液,未见明显现象,说明晶体中不含Cl-。
(7)、(做出猜想)晶体的成分为Na2CO3或NaHCO3或两者的混合物。(查阅资料)NaHCO3受热易分解,Na2CO3则较稳定,酒精灯温度不足以使其分解。
(定量再探)称取m1g晶体,利用图装置(夹持仪器略)探究晶体的成分。

(实验现象)反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
(实验分析)依据实验现象初步判断晶体中一定含有(填化学式)。将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2g,若m1∶m2=84∶53,说明所得晶体的成分为。
(8)、(拓展延伸)丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。你(填“是”或“否”)赞成丙同学的观点,理由是。五、实验题
-
25. 实验是研究化学的重要方法。(1)、实验一、气体制取和性质实验
实验室常选用过氧化氢溶液制O2 , 则发生装置应选择图中的(填字母),请写出该反应的化学方程式。检验该装置气密性的方法是。

 (2)、制得的O2可选择E装置进行收集,可知O2具有性质。若选择F装置进行收集,则气体从(填“a”或“b”)端通入。(3)、实验室制CO2的原理是(用化学方程式表示)。用G装置制备CO2 , 锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭的原因是。(4)、实验二、探究H2O2质量分数、溶液pH、温度对H2O2分解速率的影响,设计下表实验方案:
(2)、制得的O2可选择E装置进行收集,可知O2具有性质。若选择F装置进行收集,则气体从(填“a”或“b”)端通入。(3)、实验室制CO2的原理是(用化学方程式表示)。用G装置制备CO2 , 锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭的原因是。(4)、实验二、探究H2O2质量分数、溶液pH、温度对H2O2分解速率的影响,设计下表实验方案:实验序号
H2O2质量分数/%
pH
温度/℃
每分钟内产生气体体积
1
30
5
20
2
30
6
20
3
30
11
20
4
15
11
30
5
a
11
30
实验1~3的实验目的是。
(5)、实验3、5可探究温度对过氧化氢分解速率的影响,则a=。(6)、实验三、探究制取氧气的适宜催化剂,实验方案如下:步骤Ⅰ.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小完全相同的海藻酸钠微球,备用。
步骤Ⅱ.取m粒含MnO2的海藻酸钠微球,采用如图所示装置进行实验。改用其他三种微球,分别重复上述实验,得到如图所示的锥形瓶内压强随时间变化的曲线图。


每次实验时,海藻酸钠微球数应相同的原因是。
(7)、用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其可能原因是。(8)、从实验曲线看,催化效果较好、反应温和的催化剂是。
-