江苏省南通市启东市2021年中考化学一模试卷
试卷更新日期:2021-05-21 类型:中考模拟
一、单选题
-
1. 南通市拥有众多非物质文化遗产项目。下列过程涉及化学变化的是( )A、启东芦编工艺 B、海安剪纸艺术 C、如皋红木雕刻 D、南通蓝印花布2. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。高铁酸钾属于( )A、氧化物 B、盐 C、酸 D、碱3. 下列有关物质的性质和用途对应关系错误的是( )A、醋酸显酸性,可用于除水垢 B、干冰易升华,可用于人工降雨 C、金刚石硬度大,可用作钻探机钻头 D、氢氧化钙微溶于水,可用于改良酸性土壤4. 规范实验操作是实验成功的基础和关键,下列实验基本操作正确的是( )A、检验装置气密性
 B、倾倒液体
B、倾倒液体  C、铁丝在氧气中燃烧
C、铁丝在氧气中燃烧  D、镁条和稀盐酸反应
D、镁条和稀盐酸反应  5. “人世间一切幸福都需要靠劳动来创造”。下列劳动与所涉及的化学知识不相符的是( )
5. “人世间一切幸福都需要靠劳动来创造”。下列劳动与所涉及的化学知识不相符的是( )选项
劳动项目
化学知识
A
使用草木灰对蔬菜施肥
草木灰属于钾肥
B
使用84消毒液(有效成分为NaClO)对公共
场所消毒
NaClO具有吸附性
C
实验后,清洗仪器、处理废液、打扫卫生
废液随意排放会造成污染
D
将浓硫酸放入分类储存、专人保管的安全柜中
浓硫酸具有强腐蚀性
A、A B、B C、C D、D6. 下列图示与所描述的含义相符的是( )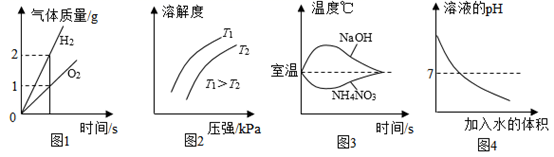 A、图1表示实验室电解水过程生成氢气与氧气的质量关系 B、图2表示CO2在水中的溶解度与温度、压强的关系 C、图3表示把NaOH固体、NH4NO3固体溶于水后的水的温度变化 D、图4表示对KOH溶液加水稀释过程中的pH变化7. 铝碳酸镁片[主要成分的化学式为Al2Mg6(OH)mCO3·4H2O]和碳酸氢钠片都可用于治疗胃酸过多症。下列有关说法错误的是( )A、m=16 B、碳酸氢钠俗称纯碱 C、金属活泼性:Na>Mg>Al D、铝碳酸镁片和碳酸氢钠片治疗胃酸过多时都会放出CO28. 甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是( )
A、图1表示实验室电解水过程生成氢气与氧气的质量关系 B、图2表示CO2在水中的溶解度与温度、压强的关系 C、图3表示把NaOH固体、NH4NO3固体溶于水后的水的温度变化 D、图4表示对KOH溶液加水稀释过程中的pH变化7. 铝碳酸镁片[主要成分的化学式为Al2Mg6(OH)mCO3·4H2O]和碳酸氢钠片都可用于治疗胃酸过多症。下列有关说法错误的是( )A、m=16 B、碳酸氢钠俗称纯碱 C、金属活泼性:Na>Mg>Al D、铝碳酸镁片和碳酸氢钠片治疗胃酸过多时都会放出CO28. 甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是( ) A、t1℃时,丙溶液中的质量分数一定比甲溶液大 B、将100g t3℃的乙饱和溶液降温至t2℃,析出5g晶体 C、甲饱和溶液中含少量乙,可通过降温结晶的方法提纯甲 D、将t3℃时甲、丙两种物质的饱和溶液降温至t2℃,溶液的质量分数:甲=丙9. 下列操作能达到实验目的的是( )
A、t1℃时,丙溶液中的质量分数一定比甲溶液大 B、将100g t3℃的乙饱和溶液降温至t2℃,析出5g晶体 C、甲饱和溶液中含少量乙,可通过降温结晶的方法提纯甲 D、将t3℃时甲、丙两种物质的饱和溶液降温至t2℃,溶液的质量分数:甲=丙9. 下列操作能达到实验目的的是( )选项
实验目的
实验方法
A
除去N2中的少量O2
将气体通过灼热的铜网
B
配制10%的NaCl溶液
向盛有10g NaCl固体的烧杯中,加入100 mL蒸馏水,搅拌
C
除去铁粉中混有的铜粉
加入过量稀硫酸,过滤
D
鉴别浓硫酸和蒸馏水
打开瓶塞,观察是否产生白雾
A、A B、B C、C D、D10. 硝酸铜[Cu(NO3)2]易潮解,易溶于水,所得溶液呈酸性,受热时能分解。取37.6g Cu(NO3)2固体加热,测得完全反应后生成CuO、某种氮的氧化物X和O2的质量分别为16g、ng、3.2g。下列说法错误的是( )A、n=18.4 B、X的化学式为NO2 C、向硝酸铜溶液中滴加石蕊试液,呈红色 D、硝酸铜受热分解时方程式中Cu(NO3)2和O2的化学计量数之比为1:1二、填空题
-
11. 宏观辨识与微观探析是重要的化学核心素养。(1)、图1是元素周期表中钙元素的部分信息,图2是钙原子的结构示意图。

①图1中“40.08”所表示的含义是 , 图2中n的值为。
②钙元素位于元素周期表中的第周期。
③钙在人体中属于(填“常量或微量”)元素。
(2)、图3是将铜丝插入硝酸银溶液中反应的微观示意图,从微观粒子变化的角度分析该反应的实质是 , 反应过程中溶液的质量变化是。(填“增大、减小或不变”)
 (3)、图4表示的是铁及其化合物的“化合价-物质类别”关系图。
(3)、图4表示的是铁及其化合物的“化合价-物质类别”关系图。①生铁和钢是常见的两种铁合金,其中含碳量相对较高的是。
②Fe(OH)2暴露在空气中的化学方程式为4Fe(OH)2+O2 + 2X=4Fe(OH)3 , X的化学式为。
③若a、b均代表硫酸盐,则铁和稀硫酸反应生成的含铁化合物属于图4中的(填“a或b”)。
12. 文房四宝“笔、墨、纸、砚”承载着优秀的中华传统文化。(1)、一般用羊毛来制作毛笔的笔头,某种羊毛经过化学处理后得到的最终物质的化学式为H2NCH2COOH,其中氮元素与碳元素的质量之比为。(2)、制作墨汁的主要原料是炭黑。①用炭黑墨汁绘的字画经久不变色的原因是。
②朱砂墨的制作工艺中需用到硫化汞(HgS),硫化汞与氧气在加热的条件下反应生成汞和二氧化硫,写出反应的化学方程式。
(3)、宣纸的制作工艺中,有道工序是从纸浆中用竹帘捞纸,该操作相当于______。A、蒸发 B、过滤 C、结晶(4)、砚台因产地不同,成分也有差别,但其中的主要成分都(填“易溶或难溶”)于水。歙砚(砚台的一种)是由大理石加工而成,试设计实验证明歙砚组成中存在碳酸盐。(包括操作、实验现象和对应的结论)三、流程题
-
13. 湿化学法(NPP-法)制备纳米级活性氧化锌,可用作橡胶硫化的活性剂、补强剂。以氧化锌粗品(含有FeO、Fe2O3、CuO等杂质)为原料制备活性氧化锌的生产工艺流程如下:
 (1)、“酸溶”时所用稀硫酸的质量分数为10%。则配制200g 10%的H2SO4溶液需要在80%的H2SO4溶液中加水g。(2)、写出“酸溶”时氧化锌和稀硫酸反应的化学方程式。(3)、“酸溶”后溶液含有Zn2+、 ,另含有Fe2+、Fe3+、Cu2+等杂质。
(1)、“酸溶”时所用稀硫酸的质量分数为10%。则配制200g 10%的H2SO4溶液需要在80%的H2SO4溶液中加水g。(2)、写出“酸溶”时氧化锌和稀硫酸反应的化学方程式。(3)、“酸溶”后溶液含有Zn2+、 ,另含有Fe2+、Fe3+、Cu2+等杂质。①除铁时需加入H2O2 , 将Fe2+转化Fe3+ , 最终生成Fe(OH)3沉淀,离子间的反应关系为:2Fe2++2H++H2O2=2Fe3++2H2O,该反应中化合价降低的是(填元素名称)元素。
②加入足量的锌粉,可以回收金属 , 所发生化学反应的类型为反应。
(4)、操作1、2中均需要用到玻璃仪器有烧杯、玻璃棒和。(5)、进入“煅烧”工艺的物质是ZnCO3·2Zn(OH)2·H2O,该物质经过煅烧后生成了三种氧化物,除了ZnO和H2O以外,还有一种是。四、科学探究题
-
14. 在对三星堆考古挖掘中出土了许多青铜面具,这些面具表面都有一层绿色的铜锈[化学式为Cu2(OH)2CO3(碱式碳酸铜)],某学习小组对性质进行实验探究。(1)、I、分析碱式碳酸铜的组成
根据化学式可知,碱式碳酸铜中的阴离子符号为。
(2)、Ⅱ、探究碱式碳酸铜与酸的作用(实验过程)取样品少量于试管中,加水,固体不溶解。继续加入足量稀盐酸,有气泡产生,得到蓝色溶液。
(实验结论)碱式碳酸铜能与稀盐酸发生反应,生成的盐为(填化学式)。
(3)、Ⅲ、探究碱式碳酸铜受热的变化小组设计了如图装置(夹持仪器已略去),并用于探究碱式碳酸铜的分解产物。
图示加入样品和试剂,加热一段时间后,试管中固体变黑,U形管中无水硫酸铜变蓝(无水硫酸铜为白色固体,遇水变蓝),澄清石灰水变浑浊。

①仪器a的名称为。
②已知黑色固体为CuO,写出碱式碳酸铜受热分解的化学方程式。
(4)、小明在对碱式碳酸铜粉末加热时发现,绿色固体先变成黑色,继续高温灼烧黑色固体变成红色,同时有气体产生,为弄清红色固体的成分,进行了如下探究:(查阅资料)Cu和Cu2O均为红色固体,且Cu2O + H2SO4=Cu + CuSO4 + H2O。
(提出猜想)红色固体是:I、Cu; Ⅱ、Cu2O; III、。
(5)、(进行实验)操作
现象
结论
①取灼烧后的红色固体2.72g于试管中,加入足量稀硫酸加热并充分振荡,静置
溶液由无色变蓝色,固体减少
2.72g红色固体一定有。
②过滤、洗涤、干燥
得红色固体
根据上述实验现象,小明认为猜想Ⅲ正确,但有同学认为小明的判断不严谨,因为猜想Ⅱ也有相同现象,所以如要确定2.72g红色固体成分,还需要补充的操作是 , 再通过计算得出论。
五、计算题
-
15. 草酸(H2C2O4)分解的化学方程式为H2C2O4 CO↑+CO2↑+H2O。某化学小组为测定生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。

主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重6.6 g。
(1)、装置A的作用是 , 装置B的作用是。(2)、通过计算求m(Fe)∶m(Fe2O3·xH2O)的比值。
-
-