福建省泉州市石狮市2021年中考化学一模试卷
试卷更新日期:2021-05-21 类型:中考模拟
一、单选题
-
1. 成语的背后有很多精彩的故事,有些也涉及物质的变化。下列变化属于化学变化的是( )A、绳锯木断 B、百炼成钢 C、凿壁偷光 D、滴水成冰2. 下列物质可用作复合肥料的是( )A、NH4NO3 B、NH4H2PO4 C、Ca3(PO4)2 D、K2SO43. 食品安全与人体健康密切相关。下列做法会损害人体健康的是( )A、多食用含汞、铅元素的食品可补充人体必须的微量元素 B、食用加碘食盐可预防甲状腺疾病 C、用甲醛的水溶液制作标本 D、食品包装袋里充入氮气防止食品变质4. 高氯酸钾(化学式为KClO4)是烟花中常用的氧化剂,可增加烟花的亮度。高氯酸钾中氯元素的化合价为( )A、-7 B、-1 C、+5 D、+75. 下列实验操作符合要求的是( )A、
 引燃酒精灯
B、
引燃酒精灯
B、 滴加试剂
C、
滴加试剂
C、 加热液体
D、
加热液体
D、 量取液体
6. 室温时将少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,其原因是( )
量取液体
6. 室温时将少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,其原因是( )
A、分子的体积变大 B、分子分解变成了原子 C、分子的间隔变大 D、分子由静止变为运动7. 下列化学用语错误的是( )A、硫化锌:ZnS B、钙离子:Ca2+ C、氯化亚铁:FeCl2 D、2个氢原子:H28. 从地沟油中提炼生物柴油是垃圾资源化的方法之一、生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是( )A、C,H,O三种元素的质量比为19∶38∶2 B、一个硬脂酸甲酯分子含一个氧分子 C、硬脂酸甲酯属于氧化物 D、硬脂酸甲酯由三种元素组成9. 下列实验操作不能达到实验目的是( )选项
实验目的
实验操作
A
鉴别硬水和软水
取样加入肥皂水振荡
B
鉴别NH4NO3和NaOH固体
加水溶解观察溶液温度变化
C
鉴别羊毛和涤纶
取样点燃,闻燃烧产物的气味
D
比较Fe、Cu、Ag的金属活动性
将Fe分别加入Cu (NO3)2和AgNO3溶液中
A、A B、B C、C D、D10. 如图所示,小试管中盛放着固体乙,滴管中有液体甲,广口瓶中有少量饱和的澄清石灰水(试管底部浸没在澄清石灰水中)。当把甲滴加到乙中,过一会儿可看到石灰水变浑浊,右侧气球胀大。根据以上现象请你分析下列说法正确的是( ) A、甲、乙一定分别是稀盐酸和碳酸钙 B、甲、乙有可能分别是水和氢氧化钠 C、石灰水变浑浊,一定是发生了化学变化 D、当把甲滴加到乙中广口瓶内的气压降低
A、甲、乙一定分别是稀盐酸和碳酸钙 B、甲、乙有可能分别是水和氢氧化钠 C、石灰水变浑浊,一定是发生了化学变化 D、当把甲滴加到乙中广口瓶内的气压降低二、填空题
-
11. 化学与生活息息相关。(1)、舌尖上的化学
①鸡蛋是生活中常见的食物,其富含的营养素是;
②青少年应均衡饮食,补充微量元素。若缺乏铁元素会引起。
(2)、环境中的化学城市居民小区内,应将生活垃圾按图示分三类科学处置。废旧干电池不能随意丢弃,应将其放入垃圾箱。
 (3)、医疗中的化学
(3)、医疗中的化学钙片的主要成分为碳酸钙,服用钙片后与胃酸反应的化学方程式为。
12. 社会发展离不开通讯技术的发展以及新能源的开发和利用(1)、我国商用5G已经开始启用。5G通信芯片用氮化镓材料制成,如图1是氮元素在元素周期表中的信息以及镓(Ga)原子的结构示意图。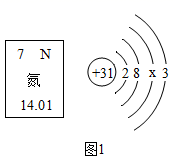
①氮元素是(填“金属元素”或“非金属元素”),氮原子的相对原子质量是;
②X= , 氮化镓的化学式是。
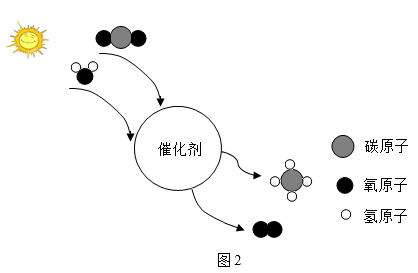
(2)、化学促进能源发展。中科院与福州大学合作发明了一种复合光催化剂,实现了太阳能人工光合成燃料过程,反应的微观示意图如图2所示:①该转化过程中,(填“原子”或“分子”)没有发生变化。
②该反应过程实现了将太阳能转化为。
③写出该过程的化学方程式:。
13. 被誉为“中国天眼”的 FAST,是目前世界上最大口径、最灵敏的射电望远镜。其主体部分由铝合金反射镜面与支撑它的角钢(含有锰(Mn))塔架组成。(1)、角钢是铁的一种合金,它属于(填“金属”或“合成”)材料。(2)、角钢塔架可能会生锈,铁生锈的条件是:同时与和接触。(3)、为探究 Fe、Cu、Mn三种金属的活动性,进行了如下图所示的实验:
写出②中的反应方程式。若实验③中观察到了明显的现象。通过以上实验,判断三种金属的活动性由强到弱的顺序为。实验①~④中,不需要做的实验是(填序号)。
14. KNO3 是一种重要的化工原料。(1)、宋代《开宝本草》中记载了KNO3的提纯方法 :“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,“霜”指KNO3 , 这里涉及到化学实验基本操作方法:“以水淋汁”是指溶解,“煎炼而成”是指。(2)、《天工开物》记载“凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测”。 是指硝酸钾的性质不稳定,受到撞击会发生分解反应生成一种可助燃的气体单质是。(3)、如图为KNO3的溶解度曲线,a、b在溶解度曲线上。
①a点对应的溶液是(填“饱和”或“不饱和”)溶液。
②a点对应的溶液的溶质质量分数是(只列计算式)。
③将a点对应的溶液升温到70 ℃,其溶质质量分数(填“变大”“变小”或“不变”)。
④欲使KNO3溶液的状态从b点转化为c点,可采取的措施是。
三、推断题
-
15. 游园活动中有一个“化学幸运大转盘”游戏。转盘外圈的五种物质分别是Fe、HCl、Ca(OH)2、Na2CO3和CuSO4中的一种,相邻的物质间能发生反应,其中C是单质,D和E溶液反应产生蓝色沉淀,G的物质类别不同于外圈的五种物质,当G的指针转到的物质能与其发生反应时即中幸运大奖。
 (1)、A是(填化学式),E的俗称是。(2)、C与D溶液反应可观察到的现象是。(3)、G物质可能是。某同学转动G中了幸运大奖,发生反应的化学方程式是。
(1)、A是(填化学式),E的俗称是。(2)、C与D溶液反应可观察到的现象是。(3)、G物质可能是。某同学转动G中了幸运大奖,发生反应的化学方程式是。四、实验题
-
16. 利用如图装置进行下表中两个实验,完成实验报告。

已知:白磷的着火点为40℃。
实验1
实验2
I.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞
II.打开K,从长颈漏斗向瓶内加入稀盐酸,至浸没锌粒
III.当瓶中产生大量气泡时,关闭K
I.将盛有白磷的燃烧匙伸入瓶内,塞紧瓶塞
II.打开K,从长颈漏斗向瓶内加入约80℃的热水,至浸没白磷
III.从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K
(1)、写出装置中一种玻璃仪器的名称。(2)、实验1和2均需检验装置的气密性,检验方法为。(3)、实验1中,瓶内发生化学反应的基本反应类型为;步骤Ⅲ中,关闭K后的现象是。(4)、实验2中,白磷燃烧的化学反应方程式为。仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是。五、科学探究题
-
17. 某研究性学习小组对中和反应进行探究。
(问题提出)怎样证明NaOH溶液与稀盐酸能发生化学反应?

(查阅资料)可从三个方面设计实验证明:
一是设计实验证明反应物的消失;
二是设计实验证明有新物质生成;
三是设计实验证明化学反应有能量变化。
(实验探究)
(1)、方案一:在NaOH溶液中滴入几滴酚酞后再滴加盐酸,当观察到时,即可确定二者发生了化学反应。其中和反应方程式为。但有同学认为颜色变化可能是盐酸与NaOH溶液反应,也可能是盐酸和酚酞反应了,请设计实验加以证明。(2)、方案二:往NaOH溶液滴加盐酸的过程中,用pH计不断测量溶液的酸碱度,当pH<7即可确定二者发生了化学反应。实验测得其图像如图1。


a点表示溶液中的溶质是(写名称),将该溶液蒸发结晶后得到固体是 (填“纯净物”或“混合物”)
(3)、滴加盐酸的过程中,强调“pH<7时”而不是“pH减小”作为判断二者发生化学反应的理由是。(4)、方案三:NaOH溶液与稀盐酸反应放热,若混合前后温度有变化,则证明发生了化学反应。某同学将不同溶质质量分数的盐酸和NaOH溶液各10mL混合(注:所用溶液溶质质量分数很小,密度均相等),用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如表)编号
盐酸
NaOH溶液
△t/℃
1
3.65%
2.00%
3.5
2
3.65%
4.00%
x
3
7.30%
8.00%
14
表中x约为。
(5)、某同学在没有使用温度计的情况下,通过图2所示装置完成了实验(烧瓶内装氢氧化钠溶液,分液漏斗装盐酸,U形管装红墨水)。则该同学根据U形管装红墨水液面左低右高的现象判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是。(6)、如图3对上述过程采用微观模型加以认识,NaOH溶液和盐酸反应的微观实质是。六、计算题
-
18. 今年《政府工作报告》中提出“推动充电、加氢等设施建设”。某品牌氢能源汽车加 5kg 氢气可行驶 650 km,工业上可用甲醇(CH3OH)和水在一定条件下反应制得氢气(化学方程式如下:CH3OH+ H2O CO2↑+3H2↑)。若要制取 3kg 氢气,需甲醇质量是多少?
-
-
-