冲刺2021高考化学押题训练(十)金属及其化合物
试卷更新日期:2021-05-21 类型:三轮冲刺
一、单选题
-
1. 下列说法错误的是( )A、工业上以氯气和石灰乳为原料制取漂白粉 B、75% (体积分数)酒精溶液能使蛋白质变性,其消毒效果比无水酒精好 C、钠是一种强还原剂,可用于制取钛、铌等金属 D、在工业炼铁中,焦炭的作用是直接还原铁矿石2. 在给定条件下,下列选项中所示的物质间转化均能实现的是( )A、SiO2 H2SiO3 Na2SiO3 B、S SO2 BaSO3 C、CuSO4 Cu(OH)2 Cu2O D、饱和NaCl溶液 NaHCO3 Na2CO33. 下列各组物质中,满足下图物质一步转化关系的选项是( )
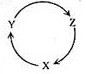
选项
X
Y
Z
A
Na
NaOH
NaHCO3
B
Cu
CuSO4
Cu(OH)2
C
C
CO
CO2
D
Si
SiO2
H2SiO3
A、A B、B C、C D、D4. 工业吸收H2S气体后的FeCl3溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法正确的是( ) A、溶液M中的溶质为FeCl2 B、电极a为阴极 C、电极b上的反应为: D、随电解的进行,阴极区溶液pH增大5. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、N2(g) NO(g) HNO3(aq) B、Al2O3(s) Al(s) NaAlO2(aq) C、BaCl2(aq) BaCO3(s) BaSO4(s) D、MgCl2·6H2O(s) MgCl2(s) Mg(s)6. 大国重器彰显中国实力,化学材料助力科技成果转化运用。下列说法正确的是( )A、“蛟龙号”载人潜水器使用的钛合金是金属材料 B、“C919”大飞机使用的氮化硅陶瓷是传统硅酸盐材料 C、“玉兔二号”月球车使用的太阳能电池板材料是二氧化硅 D、“山东舰”航母使用的碳纤维是一种新型有机高分子材料7. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。
A、溶液M中的溶质为FeCl2 B、电极a为阴极 C、电极b上的反应为: D、随电解的进行,阴极区溶液pH增大5. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、N2(g) NO(g) HNO3(aq) B、Al2O3(s) Al(s) NaAlO2(aq) C、BaCl2(aq) BaCO3(s) BaSO4(s) D、MgCl2·6H2O(s) MgCl2(s) Mg(s)6. 大国重器彰显中国实力,化学材料助力科技成果转化运用。下列说法正确的是( )A、“蛟龙号”载人潜水器使用的钛合金是金属材料 B、“C919”大飞机使用的氮化硅陶瓷是传统硅酸盐材料 C、“玉兔二号”月球车使用的太阳能电池板材料是二氧化硅 D、“山东舰”航母使用的碳纤维是一种新型有机高分子材料7. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。实验序号
实验操作
实验现象
1
将FeCl3溶液加热片刻
溶液颜色变深
2
向FeCl3 溶液中通入少量HCl气体
溶液颜色变浅
3
向FeCl3溶液中加入少量(NH4)2SO4固体
溶液颜色变浅
4
向FeCl3溶液中加入少量NaHCO3固体
产生红褐色沉淀,溶液中出现大量气泡
下列有关说法正确的是( )
A、实验1得到的溶液中有c(Cl-)>c(Fe3+)>c(OH-)>c(H+) B、实验2中FeCl3水解反应的化学平衡常数变小 C、实验3得到的溶液中有3c(Fe3+)+c(H+)=c(NH3·H2O)+c(Cl-)+c(OH-) D、实验4中反应的离子方程式为Fe3++ +H2O=Fe(OH)3↓+CO2↑8. 下列实验方案中,能达到实验目的的是( )选项
实验目的
实验方案
A
配制100mL1.0mol/LCuSO4溶液
将25g CuSO4·5H2O溶于100mL蒸馏水中
B
除去CuO中混有的Al2O3
加入过量NaOH溶液后,过滤、洗涤、干燥
C
证明氧化性:H2O2>Fe3+
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
D
证明非金属性:Cl>C
向NaHCO3溶液中加入过量盐酸振荡、静置、观察
A、A B、B C、C D、D9. 下列关于物质的性质和应用的说法正确的是( )A、绿矾的化学式为 FeSO4·7H2O,可用作补血剂 B、从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝 C、泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 D、用 Na2S 作还原剂,除去水中的 Cu2+和 Hg2+10. 2020 年,我国自主研制长征五号火箭“胖五”将嫦娥五号送入地月轨道并顺利从月球带回月壤。下列有关说法错误的是( )A、“胖五”用液氧、液氢作推进剂,在发射过程中发生氧化还原反应 B、“胖五”外壳为铝合金材料,其优点是熔点高、硬度大 C、月壤中可能含有未来能源材料3He,其中子数为 1 D、3He 与 4He 互为同位素11. 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )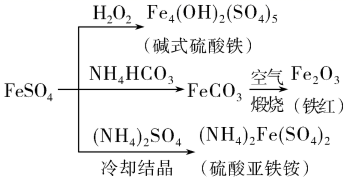 A、碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂 B、为防止 NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用铁氰化钾溶液检验 是否被氧化 D、 溶解度受温度的影响较大12. 高铁酸钾( )是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数 δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( )
A、碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂 B、为防止 NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用铁氰化钾溶液检验 是否被氧化 D、 溶解度受温度的影响较大12. 高铁酸钾( )是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数 δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( )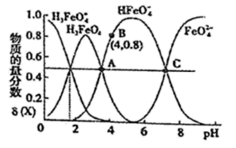 A、K2FeO4、H2FeO4都属于强电解质 B、25℃, 的平衡常数K>100 C、A、C 两点对应溶液中水的电离程度: C <A D、由 B 点数据可知,H2FeO4的第一步电离常数13. 下列有关 溶液的叙述中,正确的是( )A、蒸干该溶液可以得到无水 固体 B、往该溶液中加入少量锌粉,可置换出铁单质 C、该溶液中, 、 、 、 可以大量共存 D、向该溶液中加入 溶液,反应的离子方程式为14. 陶瓷、背铜器、书画作品等都是中华文化的瑰宝,其中蕴藏丰富的化学知识。下列说法错误的是( )A、王羲之的《兰亭集序》保存完好的原因是墨的主要成分是碳,在常温下化学性质稳定 B、宋,王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜 C、商代后期铸造出工艺精湛的青铜器司母戊鼎,其材质属于合金 D、“素纱单衣”所用的蚕丝的主要成分是纤维素,属于天然高分子化合物15. 某溶液中含有HCO3-、SO32-、CO32-、Cl-等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )A、CO32- B、SO32- C、Cl- D、HCO3-16. 铁与水蒸气反应实验改进前后的装置如图所示:
A、K2FeO4、H2FeO4都属于强电解质 B、25℃, 的平衡常数K>100 C、A、C 两点对应溶液中水的电离程度: C <A D、由 B 点数据可知,H2FeO4的第一步电离常数13. 下列有关 溶液的叙述中,正确的是( )A、蒸干该溶液可以得到无水 固体 B、往该溶液中加入少量锌粉,可置换出铁单质 C、该溶液中, 、 、 、 可以大量共存 D、向该溶液中加入 溶液,反应的离子方程式为14. 陶瓷、背铜器、书画作品等都是中华文化的瑰宝,其中蕴藏丰富的化学知识。下列说法错误的是( )A、王羲之的《兰亭集序》保存完好的原因是墨的主要成分是碳,在常温下化学性质稳定 B、宋,王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜 C、商代后期铸造出工艺精湛的青铜器司母戊鼎,其材质属于合金 D、“素纱单衣”所用的蚕丝的主要成分是纤维素,属于天然高分子化合物15. 某溶液中含有HCO3-、SO32-、CO32-、Cl-等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )A、CO32- B、SO32- C、Cl- D、HCO3-16. 铁与水蒸气反应实验改进前后的装置如图所示:
下列说法错误的是( )
A、将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气 B、用具支试管可将试管口附近冷凝的水导出,避免冷凝水与灼热铁粉接触 C、肥皂水改为吹泡泡水,收集H2效果更好,点燃效果更明显 D、悬挂的磁铁仅能吸引反应铁粉,不能吸引反应产物17. 高铁酸钾(K2FeO4) 是一种环保、高效、多功能饮用水处理剂,制备流程如图所示: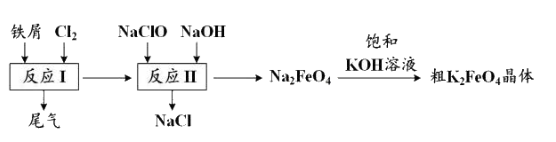
下列叙述错误的是( )
A、用K2FeO4作水处理剂时,既能杀菌消毒又能净化水 B、反应I中尾气可用FeCl2溶液吸收再利用 C、反应II中氧化剂与还原剂的物质的量之比为3:2 D、该条件下,物质的溶解性: Na2 FeO4< K2FeO418. X是中学化学常见的单质,Y、Z为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是( )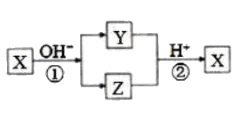 A、X可能是金属,也可能是非金属 B、X、Y、Z含有一种相同的元素 C、Y、Z的水溶液一定都呈碱性 D、反应①②不一定都是氧化还原反应19. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )
A、X可能是金属,也可能是非金属 B、X、Y、Z含有一种相同的元素 C、Y、Z的水溶液一定都呈碱性 D、反应①②不一定都是氧化还原反应19. 向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )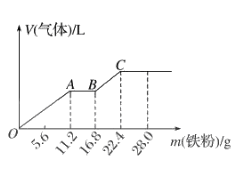 A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-120. 原子核的人工转变是利用α粒子(即氦核42He)撞击原子核,使原子核转变为另一种原子核的过程。1919年,卢瑟福利用α粒子轰击短周期非金属原子WZX,发现了质子,使人类对原子核的认识更进一步,其核反应原理如下:WZX+42He→17z+1Y+11H,其中元素X的最高价氧化物对应水化物与其气态氢化物反应生成盐,下列说法中正确的是( )A、X、Y可形成两种以上的化合物 B、WZX的质量数为13 C、原子半径:X<Y D、X仅有一种含氧酸21. 下列实验方案中,可以达到实验目的的是 ( )
A、OA段产生的是NO,AB段的反应为Fe+ 2Fe3+=3Fe2+ , BC 段产生H2 B、A点溶液中的溶质为Fe(NO3)3和H2SO4 C、原混合酸中NO3- 物质的量为0.2 mol D、原混合酸中H2SO4的物质的量浓度为2 mol·L-120. 原子核的人工转变是利用α粒子(即氦核42He)撞击原子核,使原子核转变为另一种原子核的过程。1919年,卢瑟福利用α粒子轰击短周期非金属原子WZX,发现了质子,使人类对原子核的认识更进一步,其核反应原理如下:WZX+42He→17z+1Y+11H,其中元素X的最高价氧化物对应水化物与其气态氢化物反应生成盐,下列说法中正确的是( )A、X、Y可形成两种以上的化合物 B、WZX的质量数为13 C、原子半径:X<Y D、X仅有一种含氧酸21. 下列实验方案中,可以达到实验目的的是 ( )选项
实验目的
实验方案
A
除去苯中混有的苯酚
加入适量的溴水充分反应后过滤
B
检验Fe2+溶液中是否含有Fe3+
向待测液中滴加几滴铁氰化钾溶液
C
除去粗盐中含有Mg2+、Ca2+、SO42-的试剂加入顺序
向该溶液中先加入NaOH溶液、再加BaCl2溶液,最后加碳酸钠溶液
D
检验SO2中是否含有HCl
将产生的气体通入HNO3酸化的AgNO3溶液中
A、A B、B C、C D、D二、实验探究题
-
22. FeCl2广泛应用于织物印染,医药,冶金和照相等行业。某实验小组设计如下装置利用H2和 FeCl3制备 FeCl2 , 从左侧缓缓通入H2。
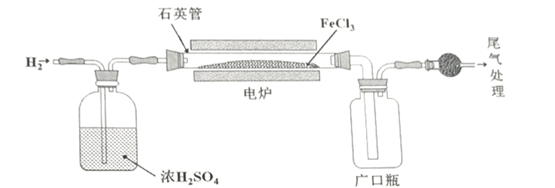
已知有关物质的性质如下:
FeCl3
FeCl2
Fe
熔点/℃
升华,易水解
672
1538
沸点/℃
1023
2750
(1)、浓硫酸在实验中有两个作用: ①除去水,使得通入的氢气干燥。②。(2)、球形干燥管中盛放的物质为:。(3)、实验过程中,探究电炉温度(T)对产物的影响。①当温度T为300℃时,加热一段时间后发现石英管内几乎没有固体剩余,请指出出现该现象可能的原因:。
②当温度T为 330℃时,加热后石英管内有固体剩余,取少量固体于试管中并加入稀盐酸,全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
猜测1:只有 FeCl2;猜测2: 含有FeCl2和 FeCl3;猜测3: 只有FeCl3
实验方案:
实验步骤
操作
现象
第一步
取溶液2mL于试管中,加入KSCN
现象一
第二步
另取溶液2mL于试管中,加入
现象二
第二步加入的物质为:。
实验结论:现象一为 , 现象二为。则猜测1 成立。
③当温度T为350℃时,加热后石英管内有固体剩余,取少量固体于试管中并加入稀盐酸,固体溶解的同时有少量气泡产生,写出加热过程中发生的副反应的化学方程式:。
(4)、三次实验中,广口瓶中都可以收集到大量固体,则其成分主要为。23. 草酸( )及其化合物广泛分布于动植物体中。Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的 形式存在)进行检测。实验如下:
a.水煮检验法:

b.灼烧检验法:
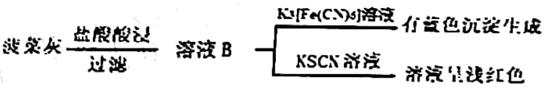 (1)、灼烧菠菜时应将其放在(填仪器名称)中加热。(2)、溶液A中未能检测出 的可能原因是;(3)、取溶液B,先滴加 溶液、再滴加 溶液。溶液呈红色;用离子方程式表示 的作用:。(4)、甲同学取少量溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是。(5)、Ⅱ.利用草酸制备草酸亚铁晶体( )的流程及组分测定方法如下:
(1)、灼烧菠菜时应将其放在(填仪器名称)中加热。(2)、溶液A中未能检测出 的可能原因是;(3)、取溶液B,先滴加 溶液、再滴加 溶液。溶液呈红色;用离子方程式表示 的作用:。(4)、甲同学取少量溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是。(5)、Ⅱ.利用草酸制备草酸亚铁晶体( )的流程及组分测定方法如下:
已知:几种物质的溶解度( )如下:
20℃
48
75
37
60℃
101
88
38
趁热过滤的原因是:。
(6)、氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M),称取ag草酸亚铁晶体置于锥形瓶中,用稀硫酸将其溶解,再用 的高锰酸钾标准液滴定,滴定时,眼睛应注视。到达滴定终点时,消耗高锰酸钾 ,则 。(已知: )三、综合题
-
24. 工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3)制备镍并回收副产物黄铵铁矾[(NH4)2Fe6(SO4)4(OH)12]的工艺流程如下。
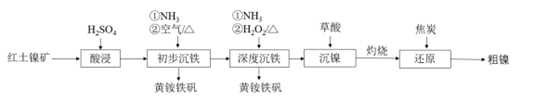 (1)、“初步沉铁”中,向酸浸后的溶液中通入NH3调节溶液的pH至1.5左右,溶液温度保持80℃左右,鼓入空气,一段时间后沉淀出黄铵铁矾。鼓入的“空气”的作用是。(2)、“深度沉铁”中,通入NH3调节溶液pH,溶液温度保持65℃左右,加入H2O2溶液,反应1h后黄铵铁矾沉淀趋于完全。
(1)、“初步沉铁”中,向酸浸后的溶液中通入NH3调节溶液的pH至1.5左右,溶液温度保持80℃左右,鼓入空气,一段时间后沉淀出黄铵铁矾。鼓入的“空气”的作用是。(2)、“深度沉铁”中,通入NH3调节溶液pH,溶液温度保持65℃左右,加入H2O2溶液,反应1h后黄铵铁矾沉淀趋于完全。①溶液中Fe3+转化为黄铵铁矾的离子方程式为。
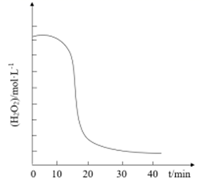
②溶液中c(H2O2)随时间t的变化关系如图所示,反应开始10~20 min内c(H2O2)迅速减小,其原因是。
 (3)、“深度沉铁”时溶液保持的温度比“初步沉铁”时溶液保持的温度低,其原因是。(4)、已知几种金属离子的氢氧化物开始沉淀和沉淀完全时的pH如下表所示(金属离子的起始浓度0.1mol·L-1)。
(3)、“深度沉铁”时溶液保持的温度比“初步沉铁”时溶液保持的温度低,其原因是。(4)、已知几种金属离子的氢氧化物开始沉淀和沉淀完全时的pH如下表所示(金属离子的起始浓度0.1mol·L-1)。金属离子的氢氧化物
Ni(OH)2
Fe(OH)3
黄铵铁矾
开始沉淀pH
7.1
2.7
1.3
沉淀完全pH
9.2
3.7
2.3
“深度沉铁”中通入NH3调节溶液pH的范围是。
25. 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)、工业上,将 和 以 的物质的量之比配成溶液。再通入 可制取 ,同时放出 ,写出该反应的化学方程。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为。(2)、 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因。(3)、下列关于苏打和小苏打的说法正确的是___________(选填字母序号)。A、纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 B、苏打和小苏打的相互转化属于可逆反应 C、苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确 D、牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢(4)、向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。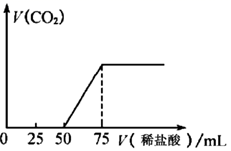
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是(填写化学式)
②滴入 稀盐酸过程中,溶液导电性(填“增强”或“减弱”),试解释其原因。
③原 氢氧化钠溶液的浓度为。
26. 将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况溶液中存在的金属离子和金属单质。(1)、若铁粉有剩余,则容器不可能有。(2)、若CuCl2有剩余,则容器中一定有可能有。(3)、若FeCl3和CuCl2都有剩余,则容器中不可能有 , 一定有。(4)、FeCl3和Fe粉反应时,氧化产物与还原产物的物质的量之比为。27. 从宏观现象探究微观本质是重要的化学学科素养。(1)、I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下: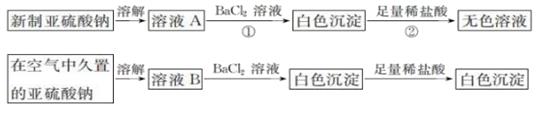
写出上述实验中②的离子方程式:。
(2)、通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有__(填化学式)。(3)、亚硫酸钠晶体样品若变质,下列说法错误的是 。A、晶体表面变黄 B、其水溶液pH将减小 C、其样品质量将增加(4)、II.以FeCl3 溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下: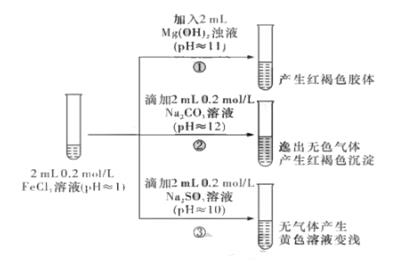
①中反应的离子方程式是._。
(5)、②中逸出的无色气体是_(写化学式)。(6)、对于③中的实验现象,同学们有诸多猜测,继续进行实验:甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液, 产生白色沉淀。得出结论:
FeCl3与Na2SO3 发生了氧化还原反应,离子方程式是_。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_。
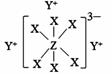
28. 物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为地壳含量最高的金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:回答下列问题:
 (1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是 , 写出YX的电子式。(2)、比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。29. 某工厂的废金属屑中主要成分为Fe和Cu,此外还含有少量Fe2O3 , 该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠) 等产品。
(1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是 , 写出YX的电子式。(2)、比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。29. 某工厂的废金属屑中主要成分为Fe和Cu,此外还含有少量Fe2O3 , 该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠) 等产品。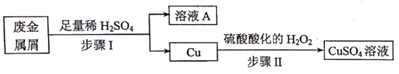 (1)、Fe2O3与稀H2SO4反应的离子方程式为 , 步骤Ⅰ中涉及到的分离操作是。(2)、请设计实验检验溶液A中的金属阳离子,写出实验操作、现象和结论:;(3)、步骤Ⅱ中,参加反应的Cu与H2O2的物质的量之比为;(4)、步骤Ⅰ所得溶液A经进一步处理可制得Na2FeO4 , 流程如下:
(1)、Fe2O3与稀H2SO4反应的离子方程式为 , 步骤Ⅰ中涉及到的分离操作是。(2)、请设计实验检验溶液A中的金属阳离子,写出实验操作、现象和结论:;(3)、步骤Ⅱ中,参加反应的Cu与H2O2的物质的量之比为;(4)、步骤Ⅰ所得溶液A经进一步处理可制得Na2FeO4 , 流程如下: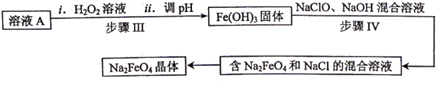
写出步骤Ⅳ中反应的离子方程式。
四、推断题
-
30. A、B、C、D、E是中学常见的几种化合物,相关物质间的关系如下图所示:

已知:X、Y是生活中常见的金属单质,A、B都是氧化物且A是红棕色粉末。
回答下列问题:
(1)、单质X与A反应的化学方程式是;(2)、若试剂1和试剂2均是强电解质。①若试剂1和试剂2的酸碱性相同,则C溶液显(填“酸性”、“碱性”或“中性”);
②若试剂1和试剂2的酸碱性不同,试剂1和B的离子方程式是。
(3)、若试剂2是稀硝酸。①Y单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式。如果稀硝酸过量,则会有Fe3+生成,可以选择试剂 进行验证。
②D的阳离子检验可以用试剂 检验。