冲刺2021高考化学押题训练(九)水溶液中的离子平衡
试卷更新日期:2021-05-21 类型:三轮冲刺
一、单选题
-
1. 常温下,次氯酸电离平衡体系中各成分的组成分数 为 或 ]与 的关系如图所示。下列有关说法正确的是( )
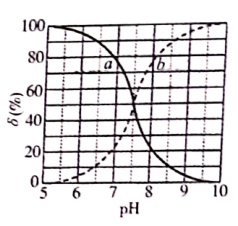 A、次氯酸的电离方程式为 B、曲线 依次表示 、 的变化 C、次氯酸电离常数 的数量级为 D、向次氯酸溶液中加 溶液, 将减小2. 常温下,以酚酞作指示剂,用0.1mol/L的NaOH溶液滴定20.00mL0.1mol/L的二元酸H2A溶液。溶液中pH、分布系数δ 随滴加NaOH溶液体积V(NaOH)的变化关系如图所示,有关说法正确的是 ( )
A、次氯酸的电离方程式为 B、曲线 依次表示 、 的变化 C、次氯酸电离常数 的数量级为 D、向次氯酸溶液中加 溶液, 将减小2. 常温下,以酚酞作指示剂,用0.1mol/L的NaOH溶液滴定20.00mL0.1mol/L的二元酸H2A溶液。溶液中pH、分布系数δ 随滴加NaOH溶液体积V(NaOH)的变化关系如图所示,有关说法正确的是 ( )已知:A2−的分布系数为
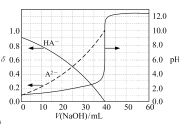 A、当V(NaOH)=0mL时,c(H2A)>c(HA- )>c(A2- )>c(H+)>c(OH- ) B、当V(NaOH)=20.00mL时,c(Na+)<c(HA- )+2c(A2- ) C、室温下,HA-的电离常数值为1.0×10-5 D、当V(NaOH)=40.00mL时, c(HA -)+c(H+)=c(A2- )+c(OH- )3. 常温下,向0.01 mol∙L-1的一元酸HX溶液中通入氨气,此过程混合溶液中 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )
A、当V(NaOH)=0mL时,c(H2A)>c(HA- )>c(A2- )>c(H+)>c(OH- ) B、当V(NaOH)=20.00mL时,c(Na+)<c(HA- )+2c(A2- ) C、室温下,HA-的电离常数值为1.0×10-5 D、当V(NaOH)=40.00mL时, c(HA -)+c(H+)=c(A2- )+c(OH- )3. 常温下,向0.01 mol∙L-1的一元酸HX溶液中通入氨气,此过程混合溶液中 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )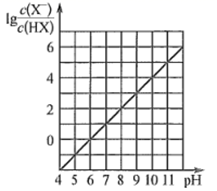 A、pH=7时,溶液中c( )= mol∙L-1 B、常温下,K(HX)≈1×10- 5 C、当溶液为碱性时,c(X- )<c(HX) D、混合溶液中不可能在:c(X-)>c( )>c(H+)>c(OH-)4. 25℃时,HF和HCN的电离平衡常数Ka分别为6.8×10-4、6.2×10-10 , 稀释HF、HCN的稀溶液时,溶液pH随加水量的变化如图所示,下列说法中正确的是( )
A、pH=7时,溶液中c( )= mol∙L-1 B、常温下,K(HX)≈1×10- 5 C、当溶液为碱性时,c(X- )<c(HX) D、混合溶液中不可能在:c(X-)>c( )>c(H+)>c(OH-)4. 25℃时,HF和HCN的电离平衡常数Ka分别为6.8×10-4、6.2×10-10 , 稀释HF、HCN的稀溶液时,溶液pH随加水量的变化如图所示,下列说法中正确的是( )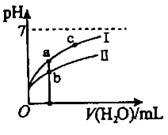 A、a点所示溶液中c(H+)=c(CN-)+c(OH-) B、a、b、c三点所示溶液中水的电离程度c>a>b C、向NaCN溶液中滴加HF溶液的离子方程式:CN-+H+=HCN D、同浓度NaF和NaCN的混合溶液中: c(Na+)>c(CN-)>c(F-)> c(OH -)> c(H+)5. 下列实验方案中,能达到实验目的是( )
A、a点所示溶液中c(H+)=c(CN-)+c(OH-) B、a、b、c三点所示溶液中水的电离程度c>a>b C、向NaCN溶液中滴加HF溶液的离子方程式:CN-+H+=HCN D、同浓度NaF和NaCN的混合溶液中: c(Na+)>c(CN-)>c(F-)> c(OH -)> c(H+)5. 下列实验方案中,能达到实验目的是( )实验目的
实验方案
A
验证H2O2具有氧化性
向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色
B
证明铜与浓硫酸反应有SO2生成
将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口
C
比较Ksp(AgI)与Ksp(AgCl) 的大小关系
向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色
D
确定NaCl溶液中是否混有Na2CO3
取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊
A、A B、B C、C D、D6. 常温下,对于pH=9的CH3COONa溶液,下列说法错误的是( )A、该溶液中: c(OH-)>c(CH3COOH)+c(H+) B、往该溶液中滴加醋酸,可能出现c(Na+) <c(CH3COO- ) C、往该溶液中通入HCl气体, 保持不变 D、相同温度下,该CH3COONa溶液的浓度大于pH=9的NaOH溶液的浓度7. 关于常温下pH均为3的盐酸和醋酸两种溶液,下列说法正确的是( )A、醋酸溶液的物质的量浓度小于盐酸 B、将醋酸溶液稀释至原体积的10倍,所得溶液pH<4 C、c(Cl-)=c(CH3COOH)+c(CH3COO-) D、相同体积的两种酸,分别与足量镁条反应,盐酸产生的气体多8. NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3 , Ka2=3.9×10-6) 溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )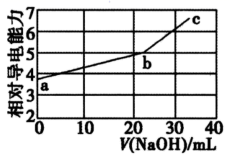 A、混合溶液的导电能力与离子浓度和种类有关 B、Na+与A-的导电能力之和大于HA-的导电能力 C、b点的混合溶液pH=7 D、c点的混合溶液中,c(Na+)>c(K+)>c(A2-)>c(OH-)9. 常温下,下列溶液的离子浓度关系式正确的是( )A、pH=4的醋酸溶液稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小 B、等物质的量浓度的①H2CO3②NaHCO3③(NH4)2CO3三种溶液的c(CO )的大小关系为③>①>② C、CH3COONa溶液的pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol·L-1 D、0.1mol·L-1的氨水pH=a,0.01mol·L-1的氨水pH=b,则a-l=b10. 下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )A、将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4 B、将TiCl4加入水中并加热使其转化为TiO2•xH2O C、将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3 D、将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀11. 向NaOH溶液中缓慢通入CO2气体,溶液中CO 的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )
A、混合溶液的导电能力与离子浓度和种类有关 B、Na+与A-的导电能力之和大于HA-的导电能力 C、b点的混合溶液pH=7 D、c点的混合溶液中,c(Na+)>c(K+)>c(A2-)>c(OH-)9. 常温下,下列溶液的离子浓度关系式正确的是( )A、pH=4的醋酸溶液稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小 B、等物质的量浓度的①H2CO3②NaHCO3③(NH4)2CO3三种溶液的c(CO )的大小关系为③>①>② C、CH3COONa溶液的pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol·L-1 D、0.1mol·L-1的氨水pH=a,0.01mol·L-1的氨水pH=b,则a-l=b10. 下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )A、将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4 B、将TiCl4加入水中并加热使其转化为TiO2•xH2O C、将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3 D、将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀11. 向NaOH溶液中缓慢通入CO2气体,溶液中CO 的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )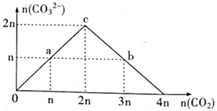 A、a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO )+2c(CO )+c(OH-) B、a、b、c三点溶液中水的电离程度:a=b<c C、a、b两点溶液的pH满足:pH(a)>pH(b) D、b点溶液满足:c(Na+)>c(HCO )>c(CO )>c(OH-)>c(H+)12. 常温下,向含少量盐酸的0.1mol/L的CrCl3溶液中逐滴滴加NaOH溶液,所加NaOH溶液的体积与溶液pH变化如图所示。
A、a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO )+2c(CO )+c(OH-) B、a、b、c三点溶液中水的电离程度:a=b<c C、a、b两点溶液的pH满足:pH(a)>pH(b) D、b点溶液满足:c(Na+)>c(HCO )>c(CO )>c(OH-)>c(H+)12. 常温下,向含少量盐酸的0.1mol/L的CrCl3溶液中逐滴滴加NaOH溶液,所加NaOH溶液的体积与溶液pH变化如图所示。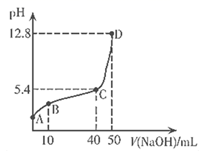
已知:Cr(OH)3为灰绿色的沉淀,当Cr3+浓度为10-5mol/L时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。下列说法正确的是( )
A、AB段发生反应的离子方程式为: B、A到D过程中,溶液中水的电离程度先减小后增大 C、当溶液pH=5时, D、D点溶液中13. 室温下,进行下列实验,根据实验操作和现象所得的结论正确的是( )选项
实验操作和现象
结论
A
向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温
盐酸与氢氧化钠的反应为放热反应
B
向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解
原Na2SO3溶液已变质
C
向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大
醋酸铵溶液呈碱性
D
向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
A、A B、B C、C D、D14. 反应CO2 + 2NaOH = Na2CO3 + H2O可用于捕捉废气中的CO2 , 下列表示或说法正确的是( )A、NaOH的电子式: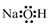 B、中子数为8的碳原子:
C、CO 的空间构型:平面三角形
D、CO 的水解方程式:CO +2H2O H2CO3+2OH−
15. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。
B、中子数为8的碳原子:
C、CO 的空间构型:平面三角形
D、CO 的水解方程式:CO +2H2O H2CO3+2OH−
15. 室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。实验序号
实验操作
实验现象
1
将FeCl3溶液加热片刻
溶液颜色变深
2
向FeCl3 溶液中通入少量HCl气体
溶液颜色变浅
3
向FeCl3溶液中加入少量(NH4)2SO4固体
溶液颜色变浅
4
向FeCl3溶液中加入少量NaHCO3固体
产生红褐色沉淀,溶液中出现大量气泡
下列有关说法正确的是( )
A、实验1得到的溶液中有c(Cl-)>c(Fe3+)>c(OH-)>c(H+) B、实验2中FeCl3水解反应的化学平衡常数变小 C、实验3得到的溶液中有3c(Fe3+)+c(H+)=c(NH3·H2O)+c(Cl-)+c(OH-) D、实验4中反应的离子方程式为Fe3++ +H2O=Fe(OH)3↓+CO2↑16. 根据下列图示所得出的结论错误的是( )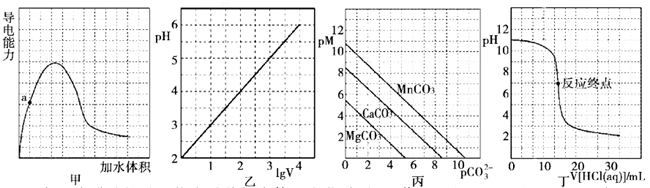 A、图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的 试纸测量a点的 ,则测量结果可能偏小 B、图乙表示 的盐酸溶液加水稀释至 随 的变化关系图 C、图丙表示一定温度下三种碳酸盐 的沉淀溶解平衡曲线图 ,则有 、 、 的 依次减小 D、图丁表示 盐酸滴定 溶液的滴定曲线17. 下列有关说法正确的是( )A、氧化钾溶于水能导电,所以氧化钾是电解质 B、强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 C、酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物 D、纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的 、 、 、 等重金属离子
A、图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的 试纸测量a点的 ,则测量结果可能偏小 B、图乙表示 的盐酸溶液加水稀释至 随 的变化关系图 C、图丙表示一定温度下三种碳酸盐 的沉淀溶解平衡曲线图 ,则有 、 、 的 依次减小 D、图丁表示 盐酸滴定 溶液的滴定曲线17. 下列有关说法正确的是( )A、氧化钾溶于水能导电,所以氧化钾是电解质 B、强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 C、酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物 D、纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的 、 、 、 等重金属离子二、多选题
-
18. 下列实验对应的现象及结论均正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
向FeCl3溶液中通入足量的H2S
生成两种沉淀
Fe3+的氧化性强于S
B
向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液
先出现浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
C
向FeCl3溶液中滴入几滴30%的H2O2溶液
有气体产生,一段时间后,FeCl3溶液颜色加深
Fe3+能催化H2O2 分解,且该分解反应为放热反应
D
铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体
加热时无明显现象,加入硝酸钾后溶液变蓝
硝酸钾起催化作用
A、A B、B C、C D、D19. 常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( ) A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-20. 金属M的盐 ,溶液中存在平衡: 。分别在 恒温条件下,向 的 ,溶液中加入等量 固体,持续搅拌下用 传感器连续测量溶液的 ,得到实验图像,下列说法错误的是( )
A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-20. 金属M的盐 ,溶液中存在平衡: 。分别在 恒温条件下,向 的 ,溶液中加入等量 固体,持续搅拌下用 传感器连续测量溶液的 ,得到实验图像,下列说法错误的是( )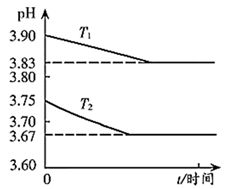 A、 B、 时平衡常数的数量级是 C、溶液中存在 D、 温度下,加入 ,固体再次达到平衡后, 减小21. 常温下,以酚酞作指示剂,用0.1 mol/L的NaOH溶液滴定20.00 mL 0.1 mol/L的二元酸H2A溶液。溶液中pH、分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。[A2−的分布系数为 ]( )
A、 B、 时平衡常数的数量级是 C、溶液中存在 D、 温度下,加入 ,固体再次达到平衡后, 减小21. 常温下,以酚酞作指示剂,用0.1 mol/L的NaOH溶液滴定20.00 mL 0.1 mol/L的二元酸H2A溶液。溶液中pH、分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。[A2−的分布系数为 ]( )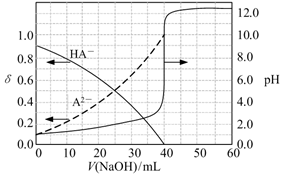 A、当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol/L B、当V(NaOH)=20.00 mL时,c(Na+)>c(HA-)+2c(A2-) C、常温下,A2-的水解常数值为1.0×10-12 D、当V(NaOH)=30.00 mL时,c(HA-)+c(H+)=c(A2-)+c(OH-)22. 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示:
A、当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol/L B、当V(NaOH)=20.00 mL时,c(Na+)>c(HA-)+2c(A2-) C、常温下,A2-的水解常数值为1.0×10-12 D、当V(NaOH)=30.00 mL时,c(HA-)+c(H+)=c(A2-)+c(OH-)22. 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示: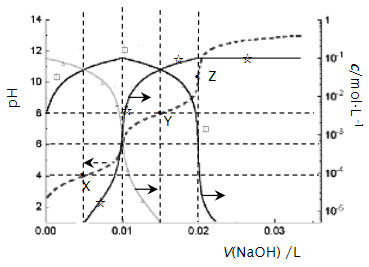
下列说法错误的是( )
A、H2A的Ka1=1×10-4 B、溶液在X点和Z点时水的电离程度相同 C、在Y点时,c(Na+)>3c(A2-) D、0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)三、实验探究题
-
23. 高铁酸钾( )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
查阅资料:
① 为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
② 与 溶液在20℃以下反应生成 ,在较高温度下则生成 。
(1)、实验室常利用氯气制备 后与 、 反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是。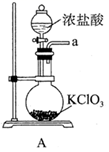
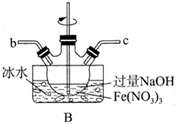
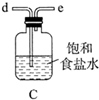
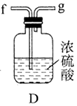
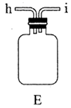
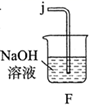 (2)、写出装置A中发生反应的离子方程式。(3)、三颈烧瓶用冰水浴的原因是 , A处盛放 的仪器名称是。(4)、将实验得到的 再加入饱和 溶液中,可析出紫黑色的 粗晶体,其原因是。(5)、用滴定法测定所制粗 的纯度(杂质与 不反应):取 粗 样品,加入足量硫酸酸化的 溶液,充分反应后,用 标准溶液滴定生成的I2 , 滴定消耗标准溶液的体积为 。涉及的反应有: , 。
(2)、写出装置A中发生反应的离子方程式。(3)、三颈烧瓶用冰水浴的原因是 , A处盛放 的仪器名称是。(4)、将实验得到的 再加入饱和 溶液中,可析出紫黑色的 粗晶体,其原因是。(5)、用滴定法测定所制粗 的纯度(杂质与 不反应):取 粗 样品,加入足量硫酸酸化的 溶液,充分反应后,用 标准溶液滴定生成的I2 , 滴定消耗标准溶液的体积为 。涉及的反应有: , 。①滴定时选用的指示剂是 , 滴定终点的现象是。
②制得粗 的纯度是。
四、综合题
-
24. 钼酸钠晶体(Na2MoO4·2H2O) 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是MoS2 , 含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:
 (1)、为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。(2)、“浸取"时产生的气体A是。(3)、若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。(4)、“结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。(5)、重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。(6)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。
(1)、为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。(2)、“浸取"时产生的气体A是。(3)、若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。(4)、“结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。(5)、重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。(6)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。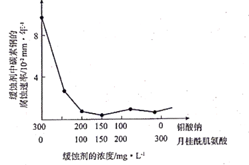 25. 铝灰主要含有 、 ,以及少量 和 的氧化物,下边是利用铝灰制备净水剂 的工艺流程,回答相关问题:
25. 铝灰主要含有 、 ,以及少量 和 的氧化物,下边是利用铝灰制备净水剂 的工艺流程,回答相关问题: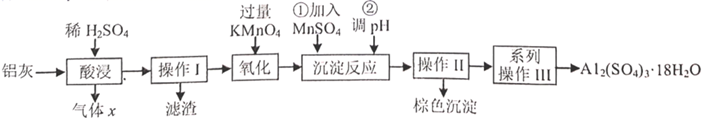
已知:金属离子浓度为 时生成氢氧化物沉淀的
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
(1)、气体x的分子式是 , 酸浸充分后溶液中的金属阳离子是。(2)、操作Ⅰ和Ⅱ用到的玻璃仪器有烧杯、玻璃棒、。(3)、加过量 溶液的目的是。(4)、棕色沉淀含 。操作①加入 反应的离子方程式是 , 判断该反应完成的现象是。(5)、操作②调 的范围是。(6)、 可制作聚合硫酸铝 ,它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则 。引起聚合硫酸铝形态多变的基本成分是 离子,可用实验测定其含量。称取 试样,将其移入锥形瓶中,用移液管加入 盐酸,充分溶解聚合物后,加 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中 的质量分数为。26. 硒(Se)元素位于元素周期表第四周期第VIA族。请回答下列问题:I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)、写出“混合气体用水吸收”时发生反应的化学方程式。(2)、下列说法正确的是_______(填字母)。A、SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性 B、热稳定性:H2Se>H2S C、“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O(3)、II.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=kJ•mol−1(用含m、n、p的代数式表示)。
(4)、已知常温H2Se的电离平衡常数K1=1.3×10−4 , K2=5.0×10−11 , 则NaHSe溶液的离子浓度由大到小的顺序为。Ag2SO4在一定条件下可以制备Ag2SeO4已知该条件下Ag2SeO4的Ksp=5.7×10−8 , Ag2SO4的的Ksp=1.4×10−5 , 则反应Ag2SO4(s)+SeO (aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=(保留两位有效数字)。(5)、用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4 , 电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体L。(6)、木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和。木炭包覆纳米零价铁在碱性含硒废水中形成许多微电池,加速SeO 的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式。27. 研究SO2尾气的处理及回收利用具有重要意义。(1)、I.SO2尾气的处理一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g) CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(2)、反应①②的平衡常数的对数lgK随温度的变化曲线如图,其中曲线I代表反应 (填“①”或“②”),从减少SO2排放的角度来考虑,本体系适宜的反应条件是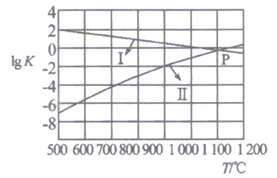
A.低温低压 B.低温高压 C.高温高压 D.高温低压
(3)、另一种方法是用氨水将SO2转化为(NH4)2SO3 , 再氧化为 (NH4)2SO4. , 用空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是。(NH4)2SO4溶液中离子浓度的大小关系为。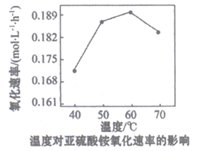 (4)、II.SO2的回收利用
(4)、II.SO2的回收利用SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
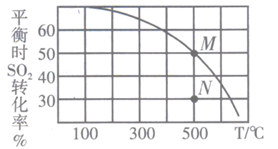
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
28.(1)、已知酸性H2CO3>HClO> ,用一个离子方程式表示ClO-和 结合H+的相对强弱。(2)、NaNH2是离子化合物,各原子均满足稳定结构。写出NaNH2的电子式。(3)、在常压下,金刚石的硬度比足球烯(C60) 高。主要原因是。29. 是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。(1)、途径Ⅰ 以工业级 溶液(含 和 等杂质)为原料制备 ,过程如下:工业级 溶液




除杂。①向硫酸镁溶液中加入 ,加热、保持溶液温度在 ,将 转化为 沉淀,反应后滤液的 (填“增大”、“不变”或“减小”);
②调节滤液的 ,使溶液呈弱碱性,向其中加入 ,将 转化为 沉淀,写出该反应的离子方程式。
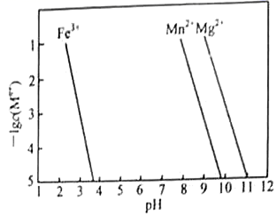
③ ( 、 、 )转变为氢氧化物沉淀的 如图。除杂时未采取将 直接转化为 的原因是。
 (2)、沉镁。向“除杂”后滤液中加入 ,同时产生气体,写出生成 的化学方程式。(3)、酸溶。将所得 置于(填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的 ,搅拌溶解。
(2)、沉镁。向“除杂”后滤液中加入 ,同时产生气体,写出生成 的化学方程式。(3)、酸溶。将所得 置于(填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的 ,搅拌溶解。途径Ⅱ 以磷肥副产物 溶解 ,充分反应后过滤、得 溶液,浓缩得 , 条件下煅烧得 。
(4)、溶解时, 质量分数控制在 的原因:( 时, 的溶解度 )。30. 草酸亚铁晶体(FeC2O4·2H2O)是一种重要的化工原料,广泛应用于涂料、染料、玻璃器皿等的着色剂,也可用于新型电池材料,感光材料的生成。实验室制备草酸亚铁晶体的一种流程如下: (1)、溶解时加入稀硫酸的作用是。(2)、用无水乙醇洗涤的目的是。(3)、某FeC2O4·2H2O样品中含有少量Fe2(C2O4)3杂质,采用KMnO4滴定法测定样品的组成,实验步骤如下:称取1.996 g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75℃;用0.200 mol/L的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色;消耗KMnO4溶液33.00 mL。
(1)、溶解时加入稀硫酸的作用是。(2)、用无水乙醇洗涤的目的是。(3)、某FeC2O4·2H2O样品中含有少量Fe2(C2O4)3杂质,采用KMnO4滴定法测定样品的组成,实验步骤如下:称取1.996 g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75℃;用0.200 mol/L的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色;消耗KMnO4溶液33.00 mL。已知:酸性环境下,KMnO4既能氧化Fe2+ , 又能氧化C2O ,自身被还原为Mn2+。
①计算样品中FeC2O4·2H2O的质量分数。 (写出计算过程)
②若滴定过程中,酸度控制不当,MnO 部分会被还原为MnO2 , 则达到滴定终点时,消耗KMnO4溶液的体积(填“偏大”、“偏小”或“不影响”)。
-