冲刺2021高考化学押题训练(八)化学反应速率与化学平衡
试卷更新日期:2021-05-21 类型:三轮冲刺
一、单选题
-
1. 目前认为乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
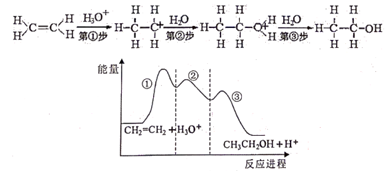 A、第①步反应的中间体比第②步反应的中间体稳定 B、总反应速率由第①步反应决定 C、第③步反应原子利用率为100% D、总反应为吸热反应2. 在温度T1和T2时,分别将0.50 mol A和1.2 mol B充入体积为3 L的恒容密闭容器中,发生如下反应:A(g)+2B(g) 2C(g)+D(g),测得n(A)随时间变化数据如下表,下列说法正确的是( )
A、第①步反应的中间体比第②步反应的中间体稳定 B、总反应速率由第①步反应决定 C、第③步反应原子利用率为100% D、总反应为吸热反应2. 在温度T1和T2时,分别将0.50 mol A和1.2 mol B充入体积为3 L的恒容密闭容器中,发生如下反应:A(g)+2B(g) 2C(g)+D(g),测得n(A)随时间变化数据如下表,下列说法正确的是( )温度
时间/min
0
10
20
40
50
T1
n(A)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(A)/mol
0.50
0.30
0.18
……
0.15
A、温度:T1>T2 B、反应达到平衡状态时,容器内压强不再发生变化 C、在温度T1时,0~10 min用B表示的平均反应速率为0.005mol/(L·min) D、保持其他条件不变,缩小反应容器体积,逆反应速率增大,正反应速率减小3. 蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为( )SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1 , 标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法错误的是A、该反应的ΔS>0 B、ΔH2<-41.8kJ·mol-1 C、SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态 D、标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×1023二、多选题
-
4. 丙酮是重要的有机合成原料,可以由过氧化氢异丙苯合成。其反应为:
 ,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为x mol·L-1 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( )
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为x mol·L-1 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( ) 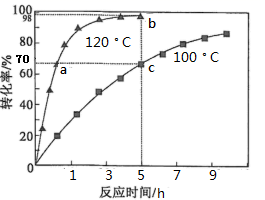 A、a、c 两点丙酮的物质的量浓度相等 B、b、c两点的逆反应速率:v(b)<v(c) C、100 ℃时,0~5 h 之间丙酮的平均反应速率为 0.14x mol·L-1·h-1 D、若b点处于化学平衡,则120℃时反应的平衡常数5. 在恒容密闭容器中发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下列有关说法正确的是( )
A、a、c 两点丙酮的物质的量浓度相等 B、b、c两点的逆反应速率:v(b)<v(c) C、100 ℃时,0~5 h 之间丙酮的平均反应速率为 0.14x mol·L-1·h-1 D、若b点处于化学平衡,则120℃时反应的平衡常数5. 在恒容密闭容器中发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下列有关说法正确的是( )体积
投料
200℃时
HCl平衡转化率
400℃时
HCl平衡转化率
容器I
1L
4mol HCl(g)、1mol O2(g)
90%
75%
容器II
2L
Xmol HCl(g)、2mol O2(g)
α1
α2
A、该反应的ΔH>0 B、400℃时,该反应的平衡常数的值为 C、400℃时,若X >8,则α2 >75% D、400℃时,向容器I平衡体系中再加入1molO2(g)和1molCl2(g),此时v (正)> v (逆)三、综合题
-
6. 氮及其化合物在工农业生产和生命活动中起着重要的作用,但同时,又是环境污染的主要物质,研究其转化规律一直是科学家们的热点问题。回答下列问题:
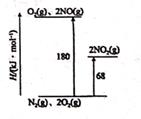 (1)、已知氮氧化物转化过程中的能量变化如图(图中表示生成2 molNO2的能量变化)。1molNO氧化为NO2的焓变△H= kJ/mol。(2)、一定温度下,向2L恒容密闭容器中充入0.40molN2O4 , 发生反应N2O4(g) 2NO2(g) △H=+QkJ·mol-1 , 一段时间后达到平衡,测得数据如下:
(1)、已知氮氧化物转化过程中的能量变化如图(图中表示生成2 molNO2的能量变化)。1molNO氧化为NO2的焓变△H= kJ/mol。(2)、一定温度下,向2L恒容密闭容器中充入0.40molN2O4 , 发生反应N2O4(g) 2NO2(g) △H=+QkJ·mol-1 , 一段时间后达到平衡,测得数据如下:时间/s
20
40
60
80
100
c(NO2)/(mol·L-1)
0.12
0.20
0.26
0.30
0.30
①0~40s内,v(NO2)=。
②达平衡时,反应体系吸收的热量为_ kJ(用Q表示)。
③该温度下反应2NO2(g)=N2O4(g)的化学平衡常数K=。
(3)、近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3 ),其工作原理如图: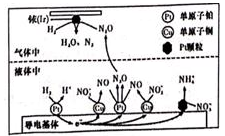
①Ir表面发生反应的方程式为。
②若导电基体上的Pt颗粒增多,造成的结果是。
7. 研究 、 等大气污染气体的处理及利用具有重要意义。回答相关问题:已知:①
②
保持温度 不变,在 的刚性容器中充入适量 与 发生反应 达到平衡。从 时的平衡状态升高温度,上述平衡体系中各物质的物质的量随温度的变化如下图所示。
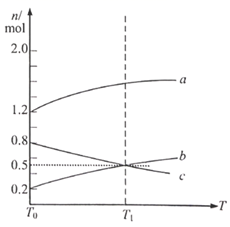 (1)、 ,图中表示 的曲线为 , 0(填“大于”或“小于”)。(2)、从反应开始到平衡这 内用 表示的平均反应速率为;下列能说明反应达到平衡状态的是。
(1)、 ,图中表示 的曲线为 , 0(填“大于”或“小于”)。(2)、从反应开始到平衡这 内用 表示的平均反应速率为;下列能说明反应达到平衡状态的是。A. 与 质量比不再变化 B. 与 的分子总数保持不变
C.混合气体的密度保持不变 D. 的体积分数不再变化
(3)、若温度 时,体系总压强为 ,则此时 气体的分压为(分压=总压×物质的量分数),压强平衡常数为。(4)、为提升 的转化率,除控制温度外,还可采取的措施是(写2条)。8. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知6.4g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量122.5kJ,则该反应的热化学方程式为。(2)、尾气中的NO2与足量的空气充分混合入,通入烧碱溶液中。该反应的离子方程式为。(3)、在773K时,分别将2.00molN2和6.00molH2充入一个固定容积为1L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。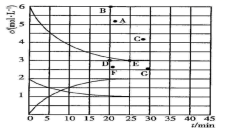
①该温度下,若向同容积的另一容器中投入N2、H2、NH3 , 其浓度均为2mol/L,则此时v正v逆(填“大于”或“小于”或“等于”)。
②在此温度下,若起始向一个固定容积为1L的密闭容器中充入4molN2和12molH2 , 则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为。
(4)、在373K时,向体积为2L的恒容真空容器中充入1.00molNO2 , 发生如下反应: 2NO2(g) N2O4(g)△H=﹣56.9kJ•mol﹣1测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如表:t/min
0
20
40
60
80
φ(NO2)
1.0
0.75
0.58
0.50
0.50
已知该反应V正(NO2)=K1·c2(NO2),V逆(N2O4)= K2·c(N2O4)其中k1、k2为速率常数,则373K时, =。
(5)、如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时, O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。N2H4的电子式为 , 该燃料电池的负极反应式为。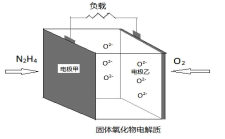 9. 硒(Se)元素位于元素周期表第四周期第VIA族。请回答下列问题:
9. 硒(Se)元素位于元素周期表第四周期第VIA族。请回答下列问题:I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
(1)、写出“混合气体用水吸收”时发生反应的化学方程式。(2)、下列说法正确的是_______(填字母)。A、SeO2可以氧化H2S,但遇到强氧化剂时可能表现还原性 B、热稳定性:H2Se>H2S C、“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O(3)、II.硒及其氢化物H2Se在新型光伏太阳能电池和金属硒化物方面有重要应用。已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=kJ•mol−1(用含m、n、p的代数式表示)。
(4)、已知常温H2Se的电离平衡常数K1=1.3×10−4 , K2=5.0×10−11 , 则NaHSe溶液的离子浓度由大到小的顺序为。Ag2SO4在一定条件下可以制备Ag2SeO4已知该条件下Ag2SeO4的Ksp=5.7×10−8 , Ag2SO4的的Ksp=1.4×10−5 , 则反应Ag2SO4(s)+SeO (aq)⇌Ag2SeO4(s)+SO (aq)的化学平衡常数K=(保留两位有效数字)。(5)、用惰性电极电解弱电解质亚硒酸(H2SeO3)溶液可制得强酸H2SeO4 , 电解过程中阳极生成2mol产物时,阴极析出标准状态下的气体L。(6)、木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。制备纳米零价铁时,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600℃,保持2小时,该过程中木炭的作用有吸附和。木炭包覆纳米零价铁在碱性含硒废水中形成许多微电池,加速SeO 的还原过程。已知SeO 转化为单质Se,写出其对应的电极反应式。10. CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
CO2(mol)
H2(mol)
CH3OH(mol)
H2O(mol)
反应a(恒温恒容)
1
3
0
0
反应b(绝热恒容)
0
0
1
1
(1)、达到平衡时,反应a,b对比:CO2的体积分数φ(a)φ(b)(填“>”、“<”或“=”))。(2)、下列能说明反应a达到平衡状态的是_______(填字母)。A、v正(CO2)=3v逆(H2) B、混合气体的平均摩尔质量不再改变 C、c(CH3OH)=c(H2O) D、容器内压强不再改变(3)、II.我国科学家研究了不同反应温度对含碳产物组成的影响。已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2 , 分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
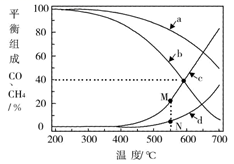
1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是和。M点平衡组成含量高于N点的原因是。
(4)、图中当CH4和和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为。(5)、III.在在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和和H2 , 发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。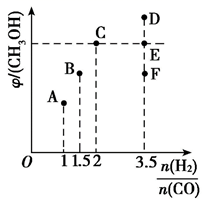
当 时,达到平衡后,CH3OH的体积分数可能是图像中的(填“D”、“E”或“F”)点。
(6)、 =时,CH3OH的体积分数最大。11. 在煤化工领域主要涉及碳一化学,即研究以含有一个碳原子的物质(CO、CO2、CH4、CH3OH等)为原料合成化工产品或液体燃料。回答下列问题:(1)、已知物质之间转化能量关系如图所示: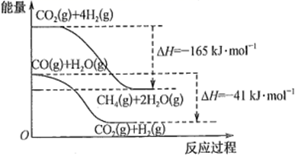
写出CO(g)和H2(g)生成CH4(g)和H2O(g)的热化学方程式。
(2)、煤化工业上主要利用CO和H2反应制备甲醇(CH3OH),反应热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H。已知CO的平衡转化率与温度的关系如图所示: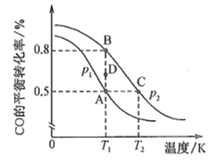
①该反应的∆H(填“>”“<”或“=”)0。
②A、B、C三点平衡常数KA . KB、KC的大小关系为。压强p1 (填“>”“<”或“=”,下同)p2 , 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正v逆。
③若容器容积不变,则下列措施可提高CO平衡转化率的是(填字母)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充人2molCO和4molH2 , 在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=mol∙L-1∙min-1;平衡常数K =(填数值)。
(3)、用H2还原CO2可以合成CH3OH: CO2(g) + 3H2(g)⇌CH3OH(g) +H2O(g) ∆H. 恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为。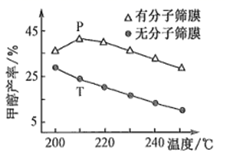 (4)、CO2的再利用技术是促进可持续发展的措施之一,CO2电化法制甲酸的工艺原理如图所示。阴极电极反应式为。
(4)、CO2的再利用技术是促进可持续发展的措施之一,CO2电化法制甲酸的工艺原理如图所示。阴极电极反应式为。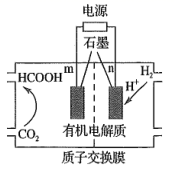 12. 研究CO2的回收利用既可变废为宝,又可減少碳的排放。回答下列问题;
12. 研究CO2的回收利用既可变废为宝,又可減少碳的排放。回答下列问题;二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
反应II:CH3OCH3(g)+H2O(g) 2CH3OH(g) ∆H2= +23.4 kJ•mol-1
反应III:2CO2(g)+ 6H2(g) CH3OCH3(g)+3H2O(g) ∆H3
(1)、△H3=kJ•mol-1 , 据此判断该反应在(填“低温”、或“任意温度”)条件下能自发进行。(2)、恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I能说明反应I达到平衡状态的是(填字母序号)。a.容器内混合气体的密度保持不变 b.消耗3molH2的同时生成1 mol H2O
c.反应体系总压强保持不变 d. CH3OH和CO2的物质的量之比保持不变
(3)、T1K时,将1 mol二甲醚充入某恒容容器中,发生如下分解反应:CH3OCH3(g) CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
反应时间t/min
0
5
10
15
20
∞
气体总压p总/kPa
10.0
13.6
15.8
17.7
18.9
20.0
由表中数据计算:反应达平衡时,二甲醚的分解率为 , 该温度下的平衡常数Kp= (kPa)2. (Kp为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)
(4)、恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。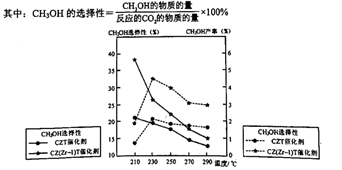
①温度高于230℃,CH3OH产率随温度升高而下降的原因是。
②在上述条件下合成甲醇的工业条件是。
a.230℃催化剂CZT b.210℃催化剂CZT
c.230℃催化剂 CZ(Zr-1)T d. 210℃催化剂CZ(Zr-1)T
13. 苯乙烯是一种重要的化工原判,可采用乙苯催化脱氢法制备,反应如下: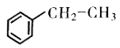 (g)
(g) 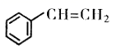 (g)+H2(g) △H(1)、已知
(g)+H2(g) △H(1)、已知化学键
C—H
C—C
C=C
H—H
键能/kJ•mol-1
412
348
612
436
计算上述反应的△H=。
(2)、实际生产中往刚性容器中同时通入乙苯和大量水蒸气,控制反应温度为600℃、体系起始总压强为100kPa的条件下进行反应。测得体系总压和乙苯转化率随时间变化结果如图所示。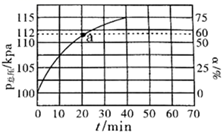
①请用化学平衡理论解释通入大量水蒸气的原因。
②平衡时,p(H2O)= kPa,平衡常数Kp=kPa(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)
③反应速率v=v正-v逆=k正·p(乙苯)-k逆·p(苯乙烯)·p(氢气) , k正、k逆分别为正、逆反应速率常数。计算a处的 =。
(3)、苯乙烯与溴化氢发生的加成反应产物有两种,其反应的化学方程式如下:i.C6H5-CH=CH2(g)+HBr(g) C6H5-CH2CH2Br(g)
ii.C6H5-CH=CH2(g)+HBr(g) C6H5-CHBrCH3(g)
600℃时,向3L恒容密闭容器中充入1.2molC6H5-CH=CH2(g)和1.2molHBr(g)发生反应,达到平衡时C6H5-CH2CH2Br(g)和C6H5-CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
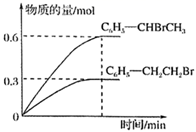
①600℃时,反应ii的化学平衡常数Kii=。
②反应平衡后,若保持其他条件不变,向该容器中再充入1molC6H5-CH2CH2Br(g),则反应ii将 (填“正向”“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,可以判断反应已达到平衡状态的是 (填编号)。
A.容器内混合气体的密度不再改变
B.C6H5-CH2CH2Br(g)的生成速率与C6H5-CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
14. 一种从阳极泥(主要成分为 Cu、Ag、Pt、Au、Ag2Se和Cu2S等)中回收 Se和贵重金属的工艺流程如下图所示。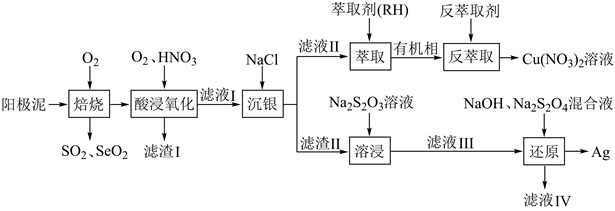
已知:①该工艺中萃取与反萃取原理为: ;
② 易与 Ag+形成配离子: ,常温下该反应的平衡常数 。
回答下列问题:
(1)、“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为。(2)、“滤渣Ⅰ”的主要成分是;“酸浸氧化”中通入氧气的目的是。(3)、“反萃取剂”最好选用(填化学式)溶液。(4)、“溶浸”中发生的反应为 ,该反应的平衡常数K'=。[已知 ](5)、“滤液IV”中含有 Na2SO3 , 则“还原”中发生反应的离子方程式为;“滤液 IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是(试用平衡原理解释)。15. 二甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以 CO2、H2为原料制备二甲醚涉及的主要反应如下:I.
Ⅱ.
回答下列问题:
(1)、反应 的△H=。(2)、在压强、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得 CO2平衡转化率和平衡时 CH3OCH3的选择性随温度的变化如图所示。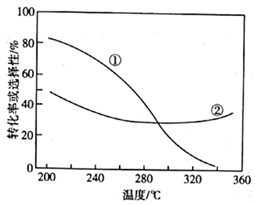
已知: 的选择性= ×100%。其中表示平衡时 的选择性的是曲线(填"①"或"②");温度高于 300℃时,曲线②随温度升高而升高的原因是;为同时提高 CO2的平衡转化率和平衡时 的选择性,应选择的反应条件为(填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
(3)、也可以利用甲醇脱水制备二甲醚: 。已知: ,其中 Kp为以分压表示的平衡常数,T 为热力学温度。①为提高 CH3OCH3的平衡产率,可以采取的措施有(任写一条)。
②473 K时,在密闭容器中加入一定量 CH3OH(g),采用合适的催化剂进行反应,达到平衡时体系中 CH3OCH3(g)的物质的量分数为(填标号)。
a.< b. c. ~ d. >
(4)、对于反应 ,反应速率v=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。①降低温度,k正-k逆(填"增大"、"减小"或"不变");
②在TK、101kPa下,按照 投料,CO2转化率为50%时, ,用气体分压表示的平衡常数 Kp=。
16. 实验室以天青石精矿(主要含SrSO4 , 还含有少量SiO2、CaSO4、BaSO4)为原料制取SrSO4 , 其实验流程如下: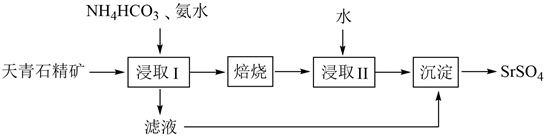 (1)、室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则反应的平衡常数为[Ksp(SrSO4)=3.2×10−7 , Ksp(SrCO3)=5.6×10−10]。(2)、浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是。“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,其原因是。(3)、“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:。(4)、“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为。(5)、将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(SrS)。
(1)、室温下,反应SrSO4(s)+CO (aq) SrCO3(s)+SO (aq)达到平衡,则反应的平衡常数为[Ksp(SrSO4)=3.2×10−7 , Ksp(SrCO3)=5.6×10−10]。(2)、浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是。“浸取Ⅰ”的条件是温度在60~70℃、搅拌、反应3小时,温度过高将会导致SrSO4的转化率下降,其原因是。(3)、“焙烧”所得SrO粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:。(4)、“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为。(5)、将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(SrS)。①写出生成SrS的化学反应方程式:。
②设计以黑灰为原料,制取SrSO4的实验方案:。
(已知:SrS易溶于水,易水解。水浸时的浸取率随温度变化如下图。实验中锶元素需充分转化SrSO4 , 必须使用的试剂:蒸馏水、3mol·L-1H2SO4和NaOH溶液)。
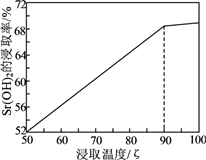 17. 汽车尾气中NOx(NO、NO2等)是形成雾霾及硝酸型酸雨的大气污染物之一、(1)、①尿素[CO(NH2)2]在一定条件下可以直接还原NO生成N2 , 发生反应的化学方程式为。
17. 汽车尾气中NOx(NO、NO2等)是形成雾霾及硝酸型酸雨的大气污染物之一、(1)、①尿素[CO(NH2)2]在一定条件下可以直接还原NO生成N2 , 发生反应的化学方程式为。②尿素水溶液高于160℃时水解生成NH3和CO2 , 可作为处理NO反应的氨源。通过调整尿素喷入量与汽车尾气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度变化的a、b的两条曲线如图1所示。
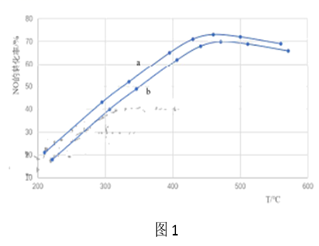
i.曲线a和曲线b,投料比较大的曲线是。(选填“a”或“b”)
ii.当200℃<T<450℃时,NO的转化率随温度升高而增大,原因时温度升高, , 反应速率加快。
(2)、在催化剂Rh表面CO还原NO基元反应机理路径如图2表示,两个N(s)结合生成的N2称为β-N2 , N2O(s)解离生成的N2称为δ-N2 , 基元反应速率随温度的变化关系如图3所示。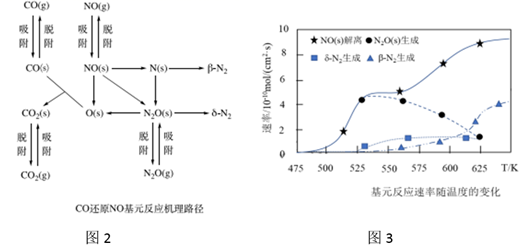
下列说法正确的是_______(填写字母序号)
A、在催化剂表面NO的吸附并解离是反应发生的先决条件 B、在催化剂表面CO2的及时脱附有利于反应的进行 C、当温度超过625K时,生成的N2主要是由CO还原N2O生成的 D、当温度低于530K时,发生的主要反应为2NO+CO=N2O+CO2 E、寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向(3)、利用汽车燃油不完全燃烧产物中的CO、HC(还原性的碳氢化合物)作还原剂,在三元催化器作用下可高效去除汽车尾气中的NOx。已知:可燃混合气中空气质量与燃油质量之比为空燃比。CO、HC及NOx转化效率随空燃比的变化关系如图4表示。当空燃比>15时,NOx转化率降低,其可能原因是。 18. 明代《天工开物》记载了“火法”炼锌方法:“炉甘石(碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,…,发火煅红,…,毁罐取出,即倭铅也”。现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
18. 明代《天工开物》记载了“火法”炼锌方法:“炉甘石(碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,…,发火煅红,…,毁罐取出,即倭铅也”。现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。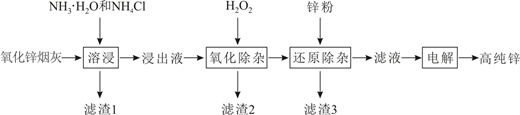
已知浸出液含[Zn(NH3)4]2+、[Cu(NH3)4]2+、AsCl 。
(1)、《天工开物》记载的炼锌方法要求罐体用泥封严,目的是。(2)、滤渣1的主要成分是(填化学式)。一段时间内锌浸出率与温度的关系如图所示,分析出现该现象的原因。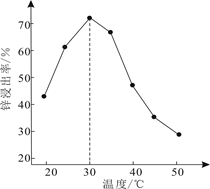 (3)、“氧化除杂”的目的是将AsCl 转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是。(4)、“电解”含[Zn(NH3)4]2+的溶液,阴极电极反应式是。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是(填化学式)。(5)、ZnCl2溶液在T1℃水解可得某碱式盐,取11.38g该碱式盐,T2℃完全水解后并煅烧,可得纯氧化锌8.1g。则该碱式盐的化学式为。19. 据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。(1)、I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。
(3)、“氧化除杂”的目的是将AsCl 转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是。(4)、“电解”含[Zn(NH3)4]2+的溶液,阴极电极反应式是。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是(填化学式)。(5)、ZnCl2溶液在T1℃水解可得某碱式盐,取11.38g该碱式盐,T2℃完全水解后并煅烧,可得纯氧化锌8.1g。则该碱式盐的化学式为。19. 据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。(1)、I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。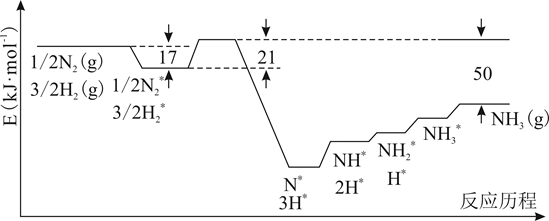
氨气的脱附是(填“吸热”或“放热”)过程,合成氨的热化学方程式为。
(2)、当使用铁催化剂时,合成氨的速率方程式为w = k1•p(N2) -k2 ,其中w为反应的瞬时总速率,等于正反应速率和逆反应速率之差,k1、k2是正、逆反应速率常数,则合成氨反应N2+3H2 2NH3的平衡常数Kp=(用k1、k2表示)。(3)、在使用同一催化剂时,将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化,曲线B表示T1时n(NH3)的变化,T2时反应到a点恰好达到平衡。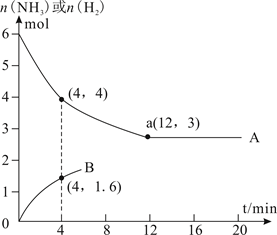
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2 , 试说明理由。
(4)、Ⅱ.用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的过程中,还会生成CH4、C3H6、C4H8等副产物,若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性(选择性指的是转化的CO2中生成C2H4的百分比)。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:助剂
CO2转化率(%)
各产物在所有产物中的占比(%)
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是。
20. 碳及其化合物在有机合成、溶液分析、电化学等方面,都有着重要应用。结合下列提供素材回答相关问题:(1)、Ⅰ.天然气催化制备二甲醚( ,熔点: ,沸点: )的反应如下:①
由合成气——水煤气也可以分两步制备二甲醚
②
③
已知:
物质
燃烧热
890.3
1453
并且 液态水变成气态水吸收 的热量。则 。
(2)、若在恒温恒容的密闭容器中,按 的起始量进行反应①,下列能说明反应①达到化学平衡状态的是(填字母序号)。a.反应容器中二甲醚的百分含量不变 b.混合气体的密度不变
c. 不变 d.分压平衡常数 不变
e. f.混合气体的压强不变
(3)、采用一种新型的催化剂(主要成分是 的合金),利用 和 制备二甲醚。观察图1回答问题。催化剂中 约为时最有利于二甲醚的合成。(4)、图2为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为。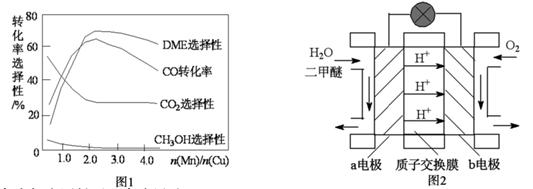 (5)、Ⅱ.以合成气为原料可以合成甲醇。
(5)、Ⅱ.以合成气为原料可以合成甲醇。在体积可变的密闭容器中投入 和 ,在不同条件下发生反应: 。实验测得 的物质的量随温度、压强的变化如图3所示。
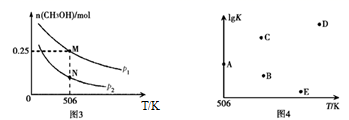
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)。
② 时,压强为 反应平衡时 的转化率为;压强: (填“>”、“<”或“=”)。
③反应速率:N点 M点 (填“>”、“<”或“=”)。
④若压强为 、在 恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数 如图4所示。则温度为 时,平衡常数 (保留三位小数),B、C、D、E四点中能正确表示该反应的 与T的关系的点为。