冲刺2021高考化学押题训练(七)电化学及其应用
试卷更新日期:2021-05-21 类型:三轮冲刺
一、单选题
-
1. 世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是( )
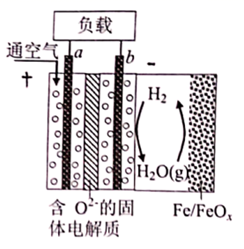 A、a极为原电池的负极 B、正极的电极反应式为 C、放电时电子从b极经固体电解质流向a极 D、消耗掉 铁时,理论上要消耗 标准状况的2. 用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示,质子膜允许H+和H2O通过。有关说法正确的是( )
A、a极为原电池的负极 B、正极的电极反应式为 C、放电时电子从b极经固体电解质流向a极 D、消耗掉 铁时,理论上要消耗 标准状况的2. 用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示,质子膜允许H+和H2O通过。有关说法正确的是( )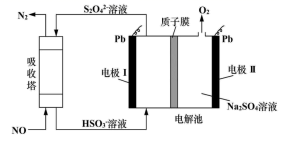 A、电极Ⅰ为电解池的负极,吸收塔反应为2NO+2S2O +2H2O=N2 +4HSO B、电解池中的质子运动方向是:左室→质子膜→右室 C、电极Ⅱ发生的反应为:4OH--4e-=O2↑+2H2O- D、吸收塔中每处理1molNO则右室会生成11.2L的O23. 海水中锂资源非常丰富,但是海水中的锂浓度低,很难被提取出来。我国科学家设计了一种太阳能驱动下,利用选择性固体陶瓷膜电解海水提取金属锂的装置(示意图如下),该装置工作时,下列说法错误的是( )
A、电极Ⅰ为电解池的负极,吸收塔反应为2NO+2S2O +2H2O=N2 +4HSO B、电解池中的质子运动方向是:左室→质子膜→右室 C、电极Ⅱ发生的反应为:4OH--4e-=O2↑+2H2O- D、吸收塔中每处理1molNO则右室会生成11.2L的O23. 海水中锂资源非常丰富,但是海水中的锂浓度低,很难被提取出来。我国科学家设计了一种太阳能驱动下,利用选择性固体陶瓷膜电解海水提取金属锂的装置(示意图如下),该装置工作时,下列说法错误的是( )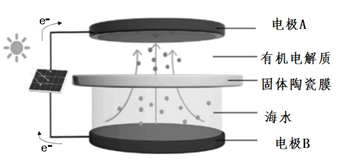 A、该装置主要涉及的能量变化:太阳能→电能→化学能 B、电极B上的电极反应式:4OH−-4e−=O2↑+2H2O C、选择性固体陶瓷膜不允许H2O通过 D、工作时,电极A为阴极4. 锌-空气燃料电池(ZAFC)具有携带方便、成本低及安全无污染等优点,在离网电源及汽车电源的应用上具有广阔的前景。我国研制的新型锌-空气燃料电池工作原理如图所示,下列说法错误的是( )
A、该装置主要涉及的能量变化:太阳能→电能→化学能 B、电极B上的电极反应式:4OH−-4e−=O2↑+2H2O C、选择性固体陶瓷膜不允许H2O通过 D、工作时,电极A为阴极4. 锌-空气燃料电池(ZAFC)具有携带方便、成本低及安全无污染等优点,在离网电源及汽车电源的应用上具有广阔的前景。我国研制的新型锌-空气燃料电池工作原理如图所示,下列说法错误的是( )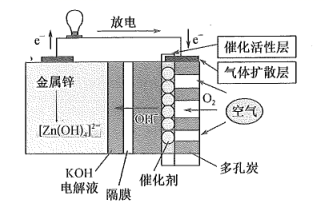 A、放电时,负极反应为Zn+4OH- -2e-=[Zn(OH)4]2- B、充电时,电解质溶液中c(OH)-逐渐增大 C、放电时,当负极减少6. 5 g,通过隔膜的电子个数约为1.204×1023 D、多孔炭可增大电极与电解质溶液的接触面积,也有利于O2扩散至电极表面5. 某锂铜二次电池工作质理如图所示。在该电池中,水系电解液和非水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列有关说法错误的是( )
A、放电时,负极反应为Zn+4OH- -2e-=[Zn(OH)4]2- B、充电时,电解质溶液中c(OH)-逐渐增大 C、放电时,当负极减少6. 5 g,通过隔膜的电子个数约为1.204×1023 D、多孔炭可增大电极与电解质溶液的接触面积,也有利于O2扩散至电极表面5. 某锂铜二次电池工作质理如图所示。在该电池中,水系电解液和非水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列有关说法错误的是( )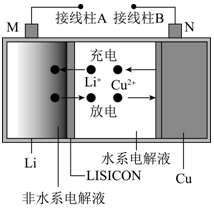 A、放电时,N极电极反应式为Cu2++2e -=Cu B、Li+可以通过陶瓷片,水分子不能 C、充电时,接线柱B应与电源的负极相连 D、充电时,M电极发生还原反应6. 焦亚硫酸钠(Na2S2O5)可用作食品加工的防腐剂,制备示意图如下。已知:2NaHSO3=Na2S2O5+H2O。下列说法错误的是( )
A、放电时,N极电极反应式为Cu2++2e -=Cu B、Li+可以通过陶瓷片,水分子不能 C、充电时,接线柱B应与电源的负极相连 D、充电时,M电极发生还原反应6. 焦亚硫酸钠(Na2S2O5)可用作食品加工的防腐剂,制备示意图如下。已知:2NaHSO3=Na2S2O5+H2O。下列说法错误的是( )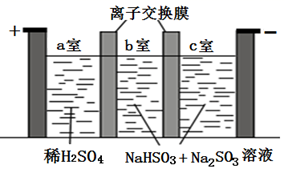 A、采用的是阳离子交换膜 B、阳极的电极反应式为2H2O-4e-= 4H+ + O2↑ C、当阴极生成0.2 g气体时,a室溶液质量减少1.6 g D、电解后将b室溶液进行结晶、脱水,可得到Na2S2O57. 一种新型的锂-空气电池的工作原理如图所示。关于该电池的说法中正确的是( )
A、采用的是阳离子交换膜 B、阳极的电极反应式为2H2O-4e-= 4H+ + O2↑ C、当阴极生成0.2 g气体时,a室溶液质量减少1.6 g D、电解后将b室溶液进行结晶、脱水,可得到Na2S2O57. 一种新型的锂-空气电池的工作原理如图所示。关于该电池的说法中正确的是( )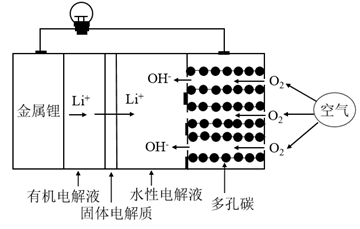 A、电池总反应为4Li+O2+2H2O=4LiOH B、可将有机电解液改为水溶液 C、金属锂作正极,发生氧化反应 D、当有22.4LO2被还原时,溶液中有4mol Li+向多孔碳电极移动8. 钠离子电池是非常有发展潜力的电池体系,其工作原理如图所示。放电时电池反应为:Na1-xMO2+NaxC=C+NaMO2 (M代表过渡金属)。下列说法错误的是( )
A、电池总反应为4Li+O2+2H2O=4LiOH B、可将有机电解液改为水溶液 C、金属锂作正极,发生氧化反应 D、当有22.4LO2被还原时,溶液中有4mol Li+向多孔碳电极移动8. 钠离子电池是非常有发展潜力的电池体系,其工作原理如图所示。放电时电池反应为:Na1-xMO2+NaxC=C+NaMO2 (M代表过渡金属)。下列说法错误的是( )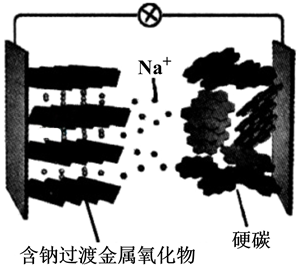 A、放电时,含硬碳材料电极为负极 B、充电时,电解质溶液中Na+向硬碳材料区迁移 C、放电时,正极的电极反应式为Na1-xMO2+xNa++xe-=NaMO2 D、充电时,若转移1mol e- , 硬碳材料电极将增重23x g9. 某柔性屏手机的柔性电池以碳纳米管做电极材料,以ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+ Zn+(1+ )H2O+ ZnSO4 MnOOH+ ZnSO4·3Zn(OH)2·xH2O,其电池结构如图所示,下列说法正确的是( )
A、放电时,含硬碳材料电极为负极 B、充电时,电解质溶液中Na+向硬碳材料区迁移 C、放电时,正极的电极反应式为Na1-xMO2+xNa++xe-=NaMO2 D、充电时,若转移1mol e- , 硬碳材料电极将增重23x g9. 某柔性屏手机的柔性电池以碳纳米管做电极材料,以ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+ Zn+(1+ )H2O+ ZnSO4 MnOOH+ ZnSO4·3Zn(OH)2·xH2O,其电池结构如图所示,下列说法正确的是( )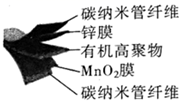 A、放电时,锌膜发生还原反应 B、放电时,电池的正极反应为:MnO2+e-+H+=MnOOH C、充电时,Zn2+移向MnO2膜 D、充电时,含有锌膜的碳纳米管纤维一端连接电源负极10. 工业吸收H2S气体后的FeCl3溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法正确的是( )
A、放电时,锌膜发生还原反应 B、放电时,电池的正极反应为:MnO2+e-+H+=MnOOH C、充电时,Zn2+移向MnO2膜 D、充电时,含有锌膜的碳纳米管纤维一端连接电源负极10. 工业吸收H2S气体后的FeCl3溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法正确的是( ) A、溶液M中的溶质为FeCl2 B、电极a为阴极 C、电极b上的反应为: D、随电解的进行,阴极区溶液pH增大11. 最近我国科学家以 CO2与辛胺为原料实现了甲酸盐和辛腈的高选择性合成,该装置的工作原理如图所示。下列说法正确的是( )
A、溶液M中的溶质为FeCl2 B、电极a为阴极 C、电极b上的反应为: D、随电解的进行,阴极区溶液pH增大11. 最近我国科学家以 CO2与辛胺为原料实现了甲酸盐和辛腈的高选择性合成,该装置的工作原理如图所示。下列说法正确的是( )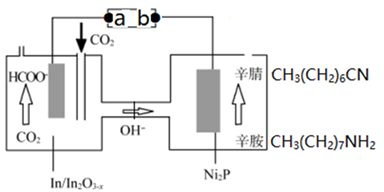 A、b为电源的负极 B、In/ 电极上可能有副产物 O2生成 C、每生成1mol辛腈,同时生成1mol HCOO- D、在 Ni2P 电极上发生的反应为:
A、b为电源的负极 B、In/ 电极上可能有副产物 O2生成 C、每生成1mol辛腈,同时生成1mol HCOO- D、在 Ni2P 电极上发生的反应为:二、多选题
-
12. 2019年诺贝尔化学奖颁给了为锂离子电池发展作出突出贡献的三位科学家,他们创造了一个可充电的世界。Garmet型固态电解质被认为是锂电池最佳性能固态电解质。某Garmet型可充电锂电池放电时工作原理如图所示,下列说法正确的是( )
(电池总反应为: LixC6+LisxLaZrTaO LiLaZrTaO+6C)
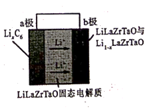 A、放电时,b极为负极 B、充电时,固态电解质中Li+移向a极 C、放电时,a极反应LiLaZrTaO-xe-=xLi++LinxLaZrTaO D、充电时,若转移0.01mol电子,b极质量减少0.07 g13. 一种可充放电的铝离子电池工作原理如图所示,电解质为 离子液体, 在电池反应后转化为 和 。下列说法正确的是( )
A、放电时,b极为负极 B、充电时,固态电解质中Li+移向a极 C、放电时,a极反应LiLaZrTaO-xe-=xLi++LinxLaZrTaO D、充电时,若转移0.01mol电子,b极质量减少0.07 g13. 一种可充放电的铝离子电池工作原理如图所示,电解质为 离子液体, 在电池反应后转化为 和 。下列说法正确的是( ) A、若 从电极表面脱落,则电池单位质量释放电量减少 B、该电池放电时,正极反应为 C、为提高电池效率,可以向 电极附近加入适量 水溶液 D、充电时电池负极的反应为14. 我国科学家最近发明了一种 Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,通过 a和 b两种离子交换膜将电解质溶液隔开,形成 M、R、N三个电解质溶液区域,结构示意图如下。下列说法正确的是( )
A、若 从电极表面脱落,则电池单位质量释放电量减少 B、该电池放电时,正极反应为 C、为提高电池效率,可以向 电极附近加入适量 水溶液 D、充电时电池负极的反应为14. 我国科学家最近发明了一种 Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,通过 a和 b两种离子交换膜将电解质溶液隔开,形成 M、R、N三个电解质溶液区域,结构示意图如下。下列说法正确的是( )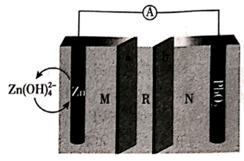 A、b为阳离子交换膜 B、R 区域的电解质为H2SO4 C、放电时,Zn 电极反应为: D、消耗 6.5 g Zn,N 区域电解质溶液减少 16.0 g
A、b为阳离子交换膜 B、R 区域的电解质为H2SO4 C、放电时,Zn 电极反应为: D、消耗 6.5 g Zn,N 区域电解质溶液减少 16.0 g三、综合题
-
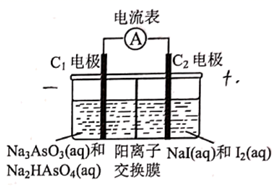
15. 砷 与其化合物被运用在农药、除草剂等。砒霜是传统文化中常提及的剧毒药物,其成分为砷的 价氧化物,但微量的砷对身体有益。回答下列关于砷及其化合物的问题:(1)、砒霜的化学式为。马氏试砷法是鉴定砒霜中毒的常用方法,反应原理为:① 砒霜 ;② ,形成具有金属光泽的黑色砷镜。①反应中 与 的系数比为;②反应中 分解放出 的热量,反应的热化学方程式为。(2)、 是两性氢氧化物,它与盐酸反应的化学方程式为。(3)、成语“信口雌黄”中的雌黄为 ,曾用作绘画颜料。 可与 溶液反应生成 和 ,该反应(填“是”或“不是”)氧化还原反应, 溶液显性。(4)、将 设计成原电池如图所示。反应达到平衡状态时,电流表指针是否偏转?(填“是”或“否”)。此时向左室中加入适量的烧碱溶液,外电路的电流方向是 , 负极的电极反应式为。
 16. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知6.4g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量122.5kJ,则该反应的热化学方程式为。(2)、尾气中的NO2与足量的空气充分混合入,通入烧碱溶液中。该反应的离子方程式为。(3)、在773K时,分别将2.00molN2和6.00molH2充入一个固定容积为1L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
16. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知6.4g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量122.5kJ,则该反应的热化学方程式为。(2)、尾气中的NO2与足量的空气充分混合入,通入烧碱溶液中。该反应的离子方程式为。(3)、在773K时,分别将2.00molN2和6.00molH2充入一个固定容积为1L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。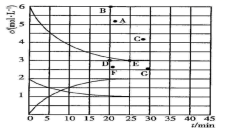
①该温度下,若向同容积的另一容器中投入N2、H2、NH3 , 其浓度均为2mol/L,则此时v正v逆(填“大于”或“小于”或“等于”)。
②在此温度下,若起始向一个固定容积为1L的密闭容器中充入4molN2和12molH2 , 则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为。
(4)、在373K时,向体积为2L的恒容真空容器中充入1.00molNO2 , 发生如下反应: 2NO2(g) N2O4(g)△H=﹣56.9kJ•mol﹣1测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如表:t/min
0
20
40
60
80
φ(NO2)
1.0
0.75
0.58
0.50
0.50
已知该反应V正(NO2)=K1·c2(NO2),V逆(N2O4)= K2·c(N2O4)其中k1、k2为速率常数,则373K时, =。
(5)、如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时, O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。N2H4的电子式为 , 该燃料电池的负极反应式为。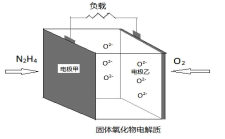 17. 在煤化工领域主要涉及碳一化学,即研究以含有一个碳原子的物质(CO、CO2、CH4、CH3OH等)为原料合成化工产品或液体燃料。回答下列问题:(1)、已知物质之间转化能量关系如图所示:
17. 在煤化工领域主要涉及碳一化学,即研究以含有一个碳原子的物质(CO、CO2、CH4、CH3OH等)为原料合成化工产品或液体燃料。回答下列问题:(1)、已知物质之间转化能量关系如图所示: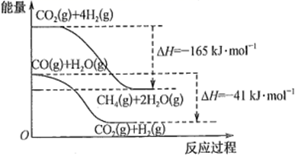
写出CO(g)和H2(g)生成CH4(g)和H2O(g)的热化学方程式。
(2)、煤化工业上主要利用CO和H2反应制备甲醇(CH3OH),反应热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H。已知CO的平衡转化率与温度的关系如图所示: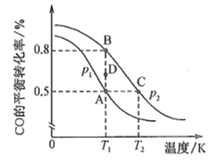
①该反应的∆H(填“>”“<”或“=”)0。
②A、B、C三点平衡常数KA . KB、KC的大小关系为。压强p1 (填“>”“<”或“=”,下同)p2 , 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正v逆。
③若容器容积不变,则下列措施可提高CO平衡转化率的是(填字母)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充人2molCO和4molH2 , 在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=mol∙L-1∙min-1;平衡常数K =(填数值)。
(3)、用H2还原CO2可以合成CH3OH: CO2(g) + 3H2(g)⇌CH3OH(g) +H2O(g) ∆H. 恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为。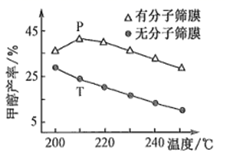 (4)、CO2的再利用技术是促进可持续发展的措施之一,CO2电化法制甲酸的工艺原理如图所示。阴极电极反应式为。
(4)、CO2的再利用技术是促进可持续发展的措施之一,CO2电化法制甲酸的工艺原理如图所示。阴极电极反应式为。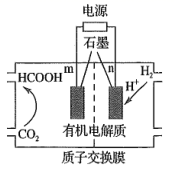 18. 汽车尾气和燃煤尾气是造成雾霾的主要原因之一、(1)、工业上利用甲烷催化还原 ,可减少氮氧化物的排放。
18. 汽车尾气和燃煤尾气是造成雾霾的主要原因之一、(1)、工业上利用甲烷催化还原 ,可减少氮氧化物的排放。已知:
甲烷直接将 还原为 的热化学方程式为。
(2)、减少汽车尾气污染的原理为 。向恒温恒容密闭容器中充入 和 ,用传感器测得的数据如下表所示:时间/s
0
1
2
3
4
9.00
4.00
2.00
1.00
1.00
9.00
4.00
2.00
1.00
1.00
①为了提高尾气处理的效果,可采取的措施有(写出一种即可)。
②此条件下达到平衡时,计算该反应的平衡常数 。
(3)、工业上用氢氧化钠溶液来同时吸收 和氮的氧化物气体( ),可得到 、 、 、 等溶液。(已知:常温下, 的电离常数为 , 的电离常数为 、 , 的水解常数为 )。①常温下,相同浓度的 、 溶液中pH较大的是溶液。
②常温下, 显性(填“酸”“碱”或“中”),判断的理由是: (通过计算说明)。
(4)、铈元素( )常见有 、 两种价态。 可以被含 的溶液吸收,生成 , (二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的 转化为无毒物质,同时再生 ,其原理如图所示。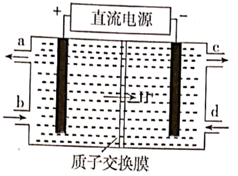
① 从电解槽的(填字母代号)口流出。
②写出阴极的电极反应式:。
19. 以菱锰矿(主耍成分MnCO3 , 还含有FeCO3、CaCO3、SiO2、Al2O3 , Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图: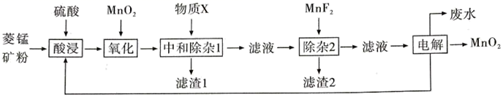
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)、写出“氧化”时发生反应的离子方程式。(2)、“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用 (填编号)。A、Cu B、CuCO3 C、NaOH D、MnCO3(3)、“除杂2”除去的主要离子是 (填离子符号)。(4)、除MnO2外该流程中可以循环使用的物质是。(5)、工业上采用如图所示的方法获得MnO2 , Mn2+将在极(填“C”或“D”)发生反应生成MnO2 , 电极反应式为。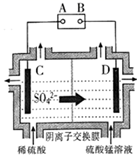 (6)、电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。[已知:H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15;Ksp(MnS)=1.4×10-15]20.(1)、科学家经过研究发现中国霾接近中性,其主要原因如图所示:
(6)、电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。[已知:H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15;Ksp(MnS)=1.4×10-15]20.(1)、科学家经过研究发现中国霾接近中性,其主要原因如图所示: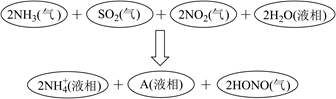
请判断A是 (填化学符号)。
(2)、为探究本地区雾霾中的可溶性颗粒的成分,某化学研究性小组进行了实验探究。[查阅资料]雾霾颗粒样品中可能含有SO 、CO 、SO 、HCO 、NO 、Cl-、Br-及一种常见阳离子,现进行如图实验:
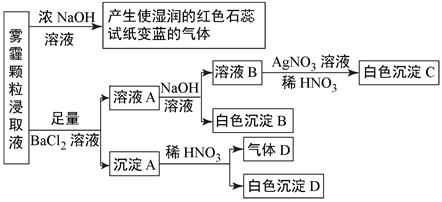
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是 , 肯定没有的离子是。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有 (填化学式)。
(3)、当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系。通过NOx传感器可监测NOx的含量,其工作原理示意图如图: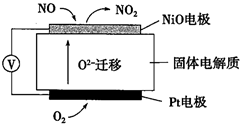
①Pt电极上发生的是反应(填“氧化”或“还原”)。
②写出Pt电极的电极反应式。
③写出NiO电极的电极反应式。