浙教版科学八下第二章 第5节 表示元素的符号(中等难度)
试卷更新日期:2021-05-19 类型:同步测试
一、单选题
-
1. 元素周期表是学习和研究化学的重要工具,可以从表中获得许多信息,下表是元素周期表的一部分,有关推断不正确的是( )
 A、①代表的是碳元素 B、②元素的原子容易失去两个电子 C、③元素与氮元素的化学性质相似 D、元素②和④组成物质的化学式为MgCl2. 如图是元素周期表中的一格,从该图中获取的相关信息中错误的是( )
A、①代表的是碳元素 B、②元素的原子容易失去两个电子 C、③元素与氮元素的化学性质相似 D、元素②和④组成物质的化学式为MgCl2. 如图是元素周期表中的一格,从该图中获取的相关信息中错误的是( ) A、该元素的名称是镁 B、该元素的原子核外电子数是12 C、该元素的原子序数是12 D、该元素的一个原子的实际质量是24.31g3. 如图是元素周期表的一部分。下列说法正确的是( )
A、该元素的名称是镁 B、该元素的原子核外电子数是12 C、该元素的原子序数是12 D、该元素的一个原子的实际质量是24.31g3. 如图是元素周期表的一部分。下列说法正确的是( ) A、硼为金属元素 B、碳的原子序数是12.01 C、铝是地壳中含量最高的元素 D、三种原子中质量最大的是铝4. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法不正确的是( )
A、硼为金属元素 B、碳的原子序数是12.01 C、铝是地壳中含量最高的元素 D、三种原子中质量最大的是铝4. 如图为元素周期表的一部分,A~E代表五种不同元素。下列说法不正确的是( ) A、原子序数:C>B B、核内质子数:A=E C、B,C同周期 D、A,D同族5. 如图摘自元素周期表,部分信息略去。据此判断下列叙述正确的是( )
A、原子序数:C>B B、核内质子数:A=E C、B,C同周期 D、A,D同族5. 如图摘自元素周期表,部分信息略去。据此判断下列叙述正确的是( ) A、Cl表示一个铝原子 B、S的原子质量为32.06 C、三种都是金属元素 D、三种元素属于同一周期6. 下列各组元素中,元素符号中的小写字母相同的是( )A、钠、氯、铝 B、铁、氖、汞 C、镁、银、汞 D、锰、铜、钙7. 2019年是化学元素周期表诞生150周年。联合国宣布今年为“国际化学元素周期表年”。根据化学元素周期表我们无法得知的是某元素( )A、 一个原子核内的质子数 B、一个原子的质量 C、一个原子的核外电子数 D、是金属还是非金属元素8. 某品牌的纯牛奶的包装盒上标有:每100毫升中含钠58毫克、钙120毫克,这里的钠、钙是指( )A、元素 B、单质 C、原子 D、离子9. 为庆祝元素周期表诞生150周年,联合国将2019年定为国际化学元素周期表年。如图是元素周期表的一部分.对相关信息叙述正确的是( )
A、Cl表示一个铝原子 B、S的原子质量为32.06 C、三种都是金属元素 D、三种元素属于同一周期6. 下列各组元素中,元素符号中的小写字母相同的是( )A、钠、氯、铝 B、铁、氖、汞 C、镁、银、汞 D、锰、铜、钙7. 2019年是化学元素周期表诞生150周年。联合国宣布今年为“国际化学元素周期表年”。根据化学元素周期表我们无法得知的是某元素( )A、 一个原子核内的质子数 B、一个原子的质量 C、一个原子的核外电子数 D、是金属还是非金属元素8. 某品牌的纯牛奶的包装盒上标有:每100毫升中含钠58毫克、钙120毫克,这里的钠、钙是指( )A、元素 B、单质 C、原子 D、离子9. 为庆祝元素周期表诞生150周年,联合国将2019年定为国际化学元素周期表年。如图是元素周期表的一部分.对相关信息叙述正确的是( ) A、碳原了的相对原于质量足12.01g B、铝原于的核内中子数一定为13 C、碳、铝、硅三种元素都属于非金属元素 D、铝元素和硅元素位于元素周期表的同一周期10. “2N”的意义是(( )A、表示两个氮元素 B、表示两种氮元素 C、表示两个氮原子 D、既表示两个氮元素,又表示两个氮原子11. 下列各组元素中,元素符号的小写字母相同的一组是( )A、钠、镁、铝 B、氮、氖、汞 C、镁、银、汞 D、锰、铜、钠12. 下列符号通常用来表示微观意义而不表示宏观意义的是( )A、2H B、H2 C、H D、H2O13. 下列各组中,元素化学性质相似的一组是( )A、Li,Ne和K B、C,P和Ge C、O,S和P D、F,Cl和Br14. 元素周期表是学习和研究化学的重要工具。如图是元素周期表的一部分,对相关信息表述正确的是( )
A、碳原了的相对原于质量足12.01g B、铝原于的核内中子数一定为13 C、碳、铝、硅三种元素都属于非金属元素 D、铝元素和硅元素位于元素周期表的同一周期10. “2N”的意义是(( )A、表示两个氮元素 B、表示两种氮元素 C、表示两个氮原子 D、既表示两个氮元素,又表示两个氮原子11. 下列各组元素中,元素符号的小写字母相同的一组是( )A、钠、镁、铝 B、氮、氖、汞 C、镁、银、汞 D、锰、铜、钠12. 下列符号通常用来表示微观意义而不表示宏观意义的是( )A、2H B、H2 C、H D、H2O13. 下列各组中,元素化学性质相似的一组是( )A、Li,Ne和K B、C,P和Ge C、O,S和P D、F,Cl和Br14. 元素周期表是学习和研究化学的重要工具。如图是元素周期表的一部分,对相关信息表述正确的是( ) A、氟原子的核内中子数为9 B、氯原子的相对原子质量是35.45g C、氟、硫、氯三种元素的根本区别是质子数不同 D、氟元素和氯元素位于元素周期表的同一周期15. 图中“
A、氟原子的核内中子数为9 B、氯原子的相对原子质量是35.45g C、氟、硫、氯三种元素的根本区别是质子数不同 D、氟元素和氯元素位于元素周期表的同一周期15. 图中“ ”和“
”和“  ”分别表示氢原子和氧原子,其中的粒子可用4H表示的是( )
”分别表示氢原子和氧原子,其中的粒子可用4H表示的是( )
A、 B、
B、 C、
C、 D、
D、 16. 一枚用于探伤的放射源铱192(其原子中含有77个质子和115个中子)在南京丢失,引起了社会的广泛关注。下列有关说法正确的是( )A、该原子的核外有115个电子 B、该元素的原子序数是192 C、该元素属于金属元素 D、该原子的相对原子质量为192g17. 科学家将原子核外电子数为117,中子数为174,相对原子质量为291的元素命名为
16. 一枚用于探伤的放射源铱192(其原子中含有77个质子和115个中子)在南京丢失,引起了社会的广泛关注。下列有关说法正确的是( )A、该原子的核外有115个电子 B、该元素的原子序数是192 C、该元素属于金属元素 D、该原子的相对原子质量为192g17. 科学家将原子核外电子数为117,中子数为174,相对原子质量为291的元素命名为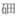 ,符号Ts,请模仿图甲,将该元素对应信息编写到图乙中相应位置,“①”处应填( )
,符号Ts,请模仿图甲,将该元素对应信息编写到图乙中相应位置,“①”处应填( )  A、291 B、174 C、117 D、5718. 核外电子数相同,核内质子数不同的两种粒子,它们不可能是( )
A、291 B、174 C、117 D、5718. 核外电子数相同,核内质子数不同的两种粒子,它们不可能是( )
A、一种元素的原子和另一种元素的离子 B、同种元素的原子和离子 C、一个物质分子和离子 D、两种不同元素的离子19. 金属钛(Titanium)是航空、宇航、军工、电力等方面的必需材料,因为具有奇特的性能,被誉为“未来金属”.金属钛的元素符号是( )A、TI B、tI C、Ti D、ti20.在元素周期表中,硫元素的信息如图所示,下列从图中获得的信息不正确的是( )
 A、在硫原子的核外电子排布中 a=2 和 b=8 B、硫原子在化学反应中易获得 2 个电子生成 S2﹣ C、硫原子里,质子数=中子数=电子数=16 D、一个硫原子的相对原子质量是 32.06 克21. 元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出).下列有关说法不正确的是( )
A、在硫原子的核外电子排布中 a=2 和 b=8 B、硫原子在化学反应中易获得 2 个电子生成 S2﹣ C、硫原子里,质子数=中子数=电子数=16 D、一个硫原子的相对原子质量是 32.06 克21. 元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出).下列有关说法不正确的是( )元素
Na
Mg
①
Si
P
②
Cl
原子的最外层电子数
1
2
3
4
5
6
7
原子半径(10﹣10m)
1.86
1.60
1.43
③
1.10
1.02
0.994
最高正价
最低负价
+1
+2
④
+4
﹣4
+5
﹣3
⑤
+7
﹣1
A、⑤处的最高正价是+6,最低负价是﹣2 B、③处的数值介于1.10﹣1.43之间 C、第三周期元素(Na﹣Cl)的最高正价数等于其原子的最外层电子数 D、元素①的原子序数是13,①和②形成的化合物的化学式为AlS22.据媒体报道,锶晶体格钟是一种新型原子钟,其准确度高得惊人,它能在50亿年间不慢一秒也不快一秒.如图为锶元素的相关信息,下列说法正确的是( )
 A、原子核内中子数为87 B、该元素的原子序数为38 C、锶离子Sr2+中有38个电子 D、锶属于非金属元素,位于第五周期
A、原子核内中子数为87 B、该元素的原子序数为38 C、锶离子Sr2+中有38个电子 D、锶属于非金属元素,位于第五周期二、填空题
-
23. 为了便于研究元素的性质,科学家把所有的已知元素科学有序地排列起来,得到元素周期表。请阅读下列元素周期表(部分),并按要求作答。
 (1)、图中位于第2周期、ⅦA族的元素,该原子的原子核内中子数为;(2)、第13号元素与地壳中含量最多的元素可组成的物质是(填化学式);(3)、第11号元素与第17号元素组成的化合物是生活中常用的调味品,构成该物质的微粒是 , (填具体微粒的符号);(4)、下列各组元素具有相似化学性质的是__________(填字母)。A、C 和Ne B、Be和Mg C、Al和Si D、F和Cl24. 元素周期律是学习和研究化学的重要工具。
(1)、图中位于第2周期、ⅦA族的元素,该原子的原子核内中子数为;(2)、第13号元素与地壳中含量最多的元素可组成的物质是(填化学式);(3)、第11号元素与第17号元素组成的化合物是生活中常用的调味品,构成该物质的微粒是 , (填具体微粒的符号);(4)、下列各组元素具有相似化学性质的是__________(填字母)。A、C 和Ne B、Be和Mg C、Al和Si D、F和Cl24. 元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
1H
氢2He
氦3Li
锂4Be
铍5B
硼6C
碳7N
氮8O
氧9F
氟10Ne
氖11Na
钠12Mg
镁13A1
铝14Si
硅15P
磷16S
硫X 18Ar
氩19K
钾20Ca
钙认真分析信息,回答:
(1)、地壳中含量最多的元素是(填符号)。(2)、分析上表规律,可推知,表中X =(填序号);元素名称是 。(3)、写出与金属钠化学性质相似物质有:。(4)、写出一个由1、8号两种元素组成的化合物的名称。25. 成语中被填的字与元素名称谐音,根据下面的示范,用相应元素符号填写成语。高山(S)水,功高(Ca)世,
十全十 , 拾不昧,
雪中送 , 叶落根,
石心肠,火树花。
26. 元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
认真分析信息,回答:
(1)、很多科学家对元素周期表的发现和完善做出了贡献,请写出其中一位科学家的名字:。(2)、查出碳的相对原子质量是 , 写出16号元素的元素符号。(3)、上表中每一周期元素原子序数的变化规律是。27. IUPAC元素系统命名法是一种序数命名法,它采用新元素的原子序数(即核电荷数)的拉丁文缩写来命名,即nil-0,un-l,bi-2,tri-3,quad-4,pent-5,hex-6,sept-7,oct-8,enn-9。照此规定,第104号元素的拉丁文名称按“un+nil+quad+ium(词缀)”应为“Unnilquadium”,其元素符号定为“Unq”,第105号元素的拉丁文名称为“Unnilpentium”,元素符号为“Unp”,依此类推。请分别给下列元素命名:(1)、第109号元素的拉丁文名称为 , 元素符号为。(2)、第116号元素的拉丁文名称为 , 元素符号为。28. 元素周期表将已知元素科学有序地排列起来,便于研究他们的性质和用途。据表回答问题:
 (1)、“方格”给出的硅元素应该在元素周期表的位置(选填数字),它属于元素(选填“金属”或“非金属”)(2)、你还可以知道硅元素原子的(选填“相对原子质量”“质子数”“核外电子数”)为14。29. 元素周期表是学习科学的重要工具。下表是元素周期表的一部分,请回答下列问题。
(1)、“方格”给出的硅元素应该在元素周期表的位置(选填数字),它属于元素(选填“金属”或“非金属”)(2)、你还可以知道硅元素原子的(选填“相对原子质量”“质子数”“核外电子数”)为14。29. 元素周期表是学习科学的重要工具。下表是元素周期表的一部分,请回答下列问题。 (1)、不同种元素之间最本质的区别是 不同。A、相对原子质量 B、质子数 C、中子数(2)、第3号元素属于(填“金属”或“非金属”)元素。(3)、第12号元素和第17号元素组成化合物的化学式是。30. 元素周期表是我们学习和研究科学的重要工具,请根据如图所示部分周期表回答问题。
(1)、不同种元素之间最本质的区别是 不同。A、相对原子质量 B、质子数 C、中子数(2)、第3号元素属于(填“金属”或“非金属”)元素。(3)、第12号元素和第17号元素组成化合物的化学式是。30. 元素周期表是我们学习和研究科学的重要工具,请根据如图所示部分周期表回答问题。 (1)、每一周期结尾的是稀有气体元素,它们的化学性质(填“活泼”或“稳定”);(2)、根据周期表的元素排列规律,锂与钠、碳与硅的化学性质相似,则氟与化学性质相似。31. 如图是元素周期表的一部分,请回答相关问题:
(1)、每一周期结尾的是稀有气体元素,它们的化学性质(填“活泼”或“稳定”);(2)、根据周期表的元素排列规律,锂与钠、碳与硅的化学性质相似,则氟与化学性质相似。31. 如图是元素周期表的一部分,请回答相关问题:第一周期
1H
2He
第二周期
3Li
4Be
5B
9F
10Ne
第三周期
11Na
12Mg
13Al
17Cl
18Ar
(1)、氟元素与氯元素位于同一纵行的原因是相同,它们在化学反应中都是容易(填“得到”或“失去”)电子。(2)、M2-与Ne核外电子数相同,则M元素名称为元素。三、解答题
-
32. 下图为元素周期表的一部分,请按要求填空:
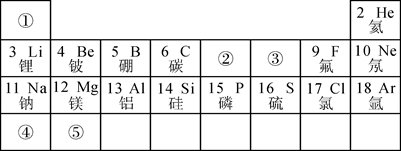 (1)、表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同。(2)、表中9号和17号元素最外层电子数相同,都易(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为。(3)、请在表中①~⑤五种元素里选出三种元素组成一种常见的化合物,其化学式为。33. 元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
(1)、表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同。(2)、表中9号和17号元素最外层电子数相同,都易(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为。(3)、请在表中①~⑤五种元素里选出三种元素组成一种常见的化合物,其化学式为。33. 元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:1 H
氢

2 He
氦
3 Li
锂
4 Be
铍
……
5 B
硼
6 C
碳
7 N
氮
8 O
氧
10 Ne
氖
11 Na
钠
12 Mg
镁
13 Al
铝
X Si
硅
15 P
磷
16 S
硫
17 Cl
氯
18 Ar
氩
19 K
钾
20 Ca
……
认真分析信息,回答:
(1)、原子序数为6的碳元素的核外电子数为 ;(2)、分析上表规律,可推知,表中X =。(3)、同一族元素特征是相似。34. 1932年,美国化学大师Linus Pauling提出电负性(用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,井通过热化学方法建立了其它元素的电负性。LhlusPauhg建立的有关元素的电负性如下:H:2.1
Li:1.0
Be:1.5
B:2.0
C:2.5
N:3.0
O:3.5
F:4.0
Na:0.9
Mg:1.2
A1:1.5
Si:1.8
P:2.1
S:2.5
Cl:3.0
K:0.8
Ca:1. 0
Ga:1.6
Ge:1.8
As:2.0
Se:2.4
Br:2.8
Rb:0.8
Sr:1.0
In:1.7
Sn:1.8
Sb:1.9
Te:x
I:2.5
Cs:0.7
Ba:0.9
Tl:1.8
Pb:1.9
Bi:1.9
Po:2.0
At:2.2
Fr:0.7
Ra:0.9
回答下列问题:
(1)、写出元素电负性在上表中同一横行和同一纵行中的递变规律:.(2)、预测Te元素x的取值范围.(3)、观察上表可得出如下结论:一般情况下,金属元素的电负性越小,它的金属活动性就越(选填“强”或“弱”),该元素的原子 (选填“失电子”或“得电 子”)的能力越大。(4)、大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物。根据此经验规律,AlCl3物质(选填“是”或“不是”)离子化合物。35. 元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。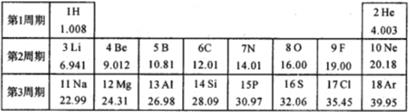 (1)、第三周期中的稀有气体元素的质子数是。(2)、元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、ⅡA族、ⅢA族、ⅣA族、VA族、ⅥA族、VⅡA族表示。同主族元素化学性质相似。X²+的核外电子数目为18,则X在第四周期第族。(3)、下列各组中的两种元素具有相似化学性质的是 。A、N C B、F Cl C、Mg Al D、Ne Na(4)、核电荷数1-18的非金属元素A和B,可形成原子个数比1:1和2∶1的两种常温下的化合物,写出这两种化合物的化学式。
(1)、第三周期中的稀有气体元素的质子数是。(2)、元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、ⅡA族、ⅢA族、ⅣA族、VA族、ⅥA族、VⅡA族表示。同主族元素化学性质相似。X²+的核外电子数目为18,则X在第四周期第族。(3)、下列各组中的两种元素具有相似化学性质的是 。A、N C B、F Cl C、Mg Al D、Ne Na(4)、核电荷数1-18的非金属元素A和B,可形成原子个数比1:1和2∶1的两种常温下的化合物,写出这两种化合物的化学式。四、实验探究题
-
36. 元素周期表是化学学习和研究的重要工具。如图所示为元素周期表的一部分:
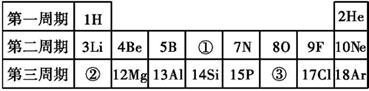 (1)、②所示元素与③所示元素的元素符号分别是和。它们在元素周期表里属于同一(选填“周期”或“族”),写出②所示元素与氧元素组成的化合物的化学式。(2)、③所示元素原子的核外电子数是 , 它在发生化学反应时容易(选填“得到”或“失去”)电子,形成的离子符号是。37. 为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究:
(1)、②所示元素与③所示元素的元素符号分别是和。它们在元素周期表里属于同一(选填“周期”或“族”),写出②所示元素与氧元素组成的化合物的化学式。(2)、③所示元素原子的核外电子数是 , 它在发生化学反应时容易(选填“得到”或“失去”)电子,形成的离子符号是。37. 为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究: (1)、第17号元素属于元素(填“金属”或“非金属”),它在化学反应中容易电子(填“得”或“失”);(2)、元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。A、同一周期,各元素原子的电子层数相同 B、同一周期,各元素原子的最外层电子数相同 C、同一族,各元素原子的电子层数相同 D、同一族,各元素原子的最外层电子数相同
(1)、第17号元素属于元素(填“金属”或“非金属”),它在化学反应中容易电子(填“得”或“失”);(2)、元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。A、同一周期,各元素原子的电子层数相同 B、同一周期,各元素原子的最外层电子数相同 C、同一族,各元素原子的电子层数相同 D、同一族,各元素原子的最外层电子数相同