浙教版科学八下第二章 第3节 原子结构的模型(中等难度)
试卷更新日期:2021-05-19 类型:同步测试
一、单选题
-
1. 卢瑟福的a粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础。如图线条中,可能是a粒子(带正电)在该实验中的运动轨迹的是( )
 A、abc B、bcd C、ad D、abcd2. 根据三种不同的原子(如下表所示),则下列说法正确的是( )
A、abc B、bcd C、ad D、abcd2. 根据三种不同的原子(如下表所示),则下列说法正确的是( )A原子
B 原子
C原子
质子数
8个
8个
7个
中子数
8个
9个
7个
A、和C是同一种元素 B、A和B的核电荷数不同 C、B和C核外电子数相等 D、A和B互为同位素原子3. 关于原子及原子结构发现史的说法不正确的是( )A、汤姆生、卢瑟橘两位科学家都是在实验的基础上,通过推理和想象建构原子模型 B、汤姆生发现了电子,证实原子是可分的 C、原子的最外层电子数发生变化时,元素的种类也发生了变化 D、原子在化学变化中的表现主要取决于原子的最外层电子4. 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( ) A、决定该原子种类的粒子是b B、原子的质量集中在a和c上 C、原子中b与c的数目一定相同 D、原子中a与c的数目一定相同5. 曾经充满活力的碧波,滋养着740平方公里土地的母亲河“温瑞塘河”,而现今由于生活污水的肆意排放造成了重度污染,水质监测结果表明,氮、磷含量严重超标,这里提到的“氮”、“磷”指的是( )A、分子 B、原子 C、离子 D、元素6. 知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( )
A、决定该原子种类的粒子是b B、原子的质量集中在a和c上 C、原子中b与c的数目一定相同 D、原子中a与c的数目一定相同5. 曾经充满活力的碧波,滋养着740平方公里土地的母亲河“温瑞塘河”,而现今由于生活污水的肆意排放造成了重度污染,水质监测结果表明,氮、磷含量严重超标,这里提到的“氮”、“磷”指的是( )A、分子 B、原子 C、离子 D、元素6. 知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( ) A、原子、原子核、核外电子 B、原子核、原子、核外电子 C、原子、核外电子、原子核 D、核外电子、原子核、原子7. 下列关于原子核构成的说法正确的是( )A、一般由质子和电子构成 B、一般由质子和中子构成 C、一般由电子和中子构成 D、一般由质子、中子和电子构成8. 下列关于元素的理解,正确的是( )A、元素的种类取决于该元素原子的核外电子数 B、中子数相等的原子的统称叫元素 C、元素既论种数,也可计个数 D、自然界中所有的物质都是由元素组成的9. 科学家用质子数为20的钙离子,轰击核电荷数为98的锎元素靶,使两种元素的原子核合并在一起,合成核电荷数为118的新元素。对此理解正确的是( )A、新元素的原子核外电子数为116 B、新元素的原子序数为118 C、新元素的原子中子数为118 D、变化过程中元素种类没有发生变化10. 具有相同质子数和不同中子数的同一元素的不同原子互称同位素。氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )A、氘和氘与氢的原子序数不同 B、氘原子和氚原子是氢的不同元素 C、氘原子和氚原子是氢的两种同位素 D、氘原子和氚原子的相对原子质量相同11. 某学习小组的同学在关于原子和原子核的讨论中,有以下四种说法:①原子由位于中心的原子核和核外电子构成;②带负电荷的电子在原子核外空间里绕核运动;③原子的全部正电荷和全部质量都集中在原子核里;④原子核是由质子和中子构成的,质子的个数一定不等于中子的个数。下列组合中,都正确的是( )A、①② B、②④ C、①③ D、③④12. 下列说法错误的是( )A、原子不显电性 B、在化学变化中能否再分是原子和分子的本质区别 C、原子的质量主要集中在原子核上 D、所有原子的原子核都含有中子和质子13. 人们为了解释原子结构的奥秘,经历了漫长的探究过程。下列有关说法错误的是( )A、发现电子的科学家是汤姆生,他认为原子是一个球体,正电荷均匀分布在整个球体内 B、卢瑟福提出的核式结构模型认为,原子的全部正电荷和几乎全部的质量都集中在原子核里,核外电子分布在不同的层次绕核做高速运动 C、通过实验,科学家们发现原子核一般是由质子和中子构成的 D、质子和中子都是由更小的基本粒子一一夸克构成14. 俄国科学家门捷列夫对元素周期表的编制作出巨大献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )A、101 B、157 C、258 D、35915. 1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象。由实验得出的结论合理的是( )
A、原子、原子核、核外电子 B、原子核、原子、核外电子 C、原子、核外电子、原子核 D、核外电子、原子核、原子7. 下列关于原子核构成的说法正确的是( )A、一般由质子和电子构成 B、一般由质子和中子构成 C、一般由电子和中子构成 D、一般由质子、中子和电子构成8. 下列关于元素的理解,正确的是( )A、元素的种类取决于该元素原子的核外电子数 B、中子数相等的原子的统称叫元素 C、元素既论种数,也可计个数 D、自然界中所有的物质都是由元素组成的9. 科学家用质子数为20的钙离子,轰击核电荷数为98的锎元素靶,使两种元素的原子核合并在一起,合成核电荷数为118的新元素。对此理解正确的是( )A、新元素的原子核外电子数为116 B、新元素的原子序数为118 C、新元素的原子中子数为118 D、变化过程中元素种类没有发生变化10. 具有相同质子数和不同中子数的同一元素的不同原子互称同位素。氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )A、氘和氘与氢的原子序数不同 B、氘原子和氚原子是氢的不同元素 C、氘原子和氚原子是氢的两种同位素 D、氘原子和氚原子的相对原子质量相同11. 某学习小组的同学在关于原子和原子核的讨论中,有以下四种说法:①原子由位于中心的原子核和核外电子构成;②带负电荷的电子在原子核外空间里绕核运动;③原子的全部正电荷和全部质量都集中在原子核里;④原子核是由质子和中子构成的,质子的个数一定不等于中子的个数。下列组合中,都正确的是( )A、①② B、②④ C、①③ D、③④12. 下列说法错误的是( )A、原子不显电性 B、在化学变化中能否再分是原子和分子的本质区别 C、原子的质量主要集中在原子核上 D、所有原子的原子核都含有中子和质子13. 人们为了解释原子结构的奥秘,经历了漫长的探究过程。下列有关说法错误的是( )A、发现电子的科学家是汤姆生,他认为原子是一个球体,正电荷均匀分布在整个球体内 B、卢瑟福提出的核式结构模型认为,原子的全部正电荷和几乎全部的质量都集中在原子核里,核外电子分布在不同的层次绕核做高速运动 C、通过实验,科学家们发现原子核一般是由质子和中子构成的 D、质子和中子都是由更小的基本粒子一一夸克构成14. 俄国科学家门捷列夫对元素周期表的编制作出巨大献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )A、101 B、157 C、258 D、35915. 1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象。由实验得出的结论合理的是( ) A、 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子 B、少数α粒子发生偏移,说明原子核外电子质量较大且带负电 C、极少数α粒子被反弹,说明原子核体积很小、质量较大 D、该实验说明α粒子无法穿透原子与原子间的空隙16. 某元素的阳离子A3+的核外有10个电子,核内有14个中子,则该元素原子的核电荷数和相对原子质量分别为( )A、10 24 B、13 24 C、10 27 D、13 2717. 2019年7月6日,浙江余杭良渚古城遗址获准列入世界遗产名录。考古学家通过对有关遗址出土文物中的碳-14含量测定,推测其年代距今4700-5300年。碳-14原子与碳-12原子不同的是( )A、 质子数 B、核电荷数 C、电子数 D、中子数18. 下图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A、 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子 B、少数α粒子发生偏移,说明原子核外电子质量较大且带负电 C、极少数α粒子被反弹,说明原子核体积很小、质量较大 D、该实验说明α粒子无法穿透原子与原子间的空隙16. 某元素的阳离子A3+的核外有10个电子,核内有14个中子,则该元素原子的核电荷数和相对原子质量分别为( )A、10 24 B、13 24 C、10 27 D、13 2717. 2019年7月6日,浙江余杭良渚古城遗址获准列入世界遗产名录。考古学家通过对有关遗址出土文物中的碳-14含量测定,推测其年代距今4700-5300年。碳-14原子与碳-12原子不同的是( )A、 质子数 B、核电荷数 C、电子数 D、中子数18. 下图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( ) A、决定该原子种类的粒子是b B、该原子的化学性质跟硫原子相似 C、该原子的质量集中在a和c上 D、原子核中含有6个c19. 科学家们成功合成了116号元素——鉝。鉝原子的相对原子质量为292,则这种鉝原子的核外电子数为( )A、116 B、292 C、176 D、40820. 卢瑟福在分析α粒子轰击原子实验结果的基础上,提出如图所示的原子核式结构这一研究过程是一个( )
A、决定该原子种类的粒子是b B、该原子的化学性质跟硫原子相似 C、该原子的质量集中在a和c上 D、原子核中含有6个c19. 科学家们成功合成了116号元素——鉝。鉝原子的相对原子质量为292,则这种鉝原子的核外电子数为( )A、116 B、292 C、176 D、40820. 卢瑟福在分析α粒子轰击原子实验结果的基础上,提出如图所示的原子核式结构这一研究过程是一个( ) A、验证证据的过程 B、得出结论的过程 C、提出问题的过程 D、建立模型的过程
A、验证证据的过程 B、得出结论的过程 C、提出问题的过程 D、建立模型的过程二、填空题
-
21. 已知原子中:质子数(Z)+中子数(N)=质量数(A),表示X元素原子的质子数和质量数可用ZAX符号表示。据报道钬元素的原子 可有效治疗肝癌,该原子的中子数是 ,核电荷数是。现有 和 两种原子,则X和Y是否是同种元素? 。22. 月球上的23He蕴藏量巨大,地球上的氦元素主要以24He形式存在。从原子的构成来看,23He、24He两种原子的数不同,化学性质基本相同,互称为原子。23. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α粒子(带2个单位正电荷),射向一片极薄的金箔。他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无阻地通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:(1)、。(2)、。(3)、。24. 如图所示代表三种原子的原子核,请回答下列问题:
这三种原子的原子核内均含有个质子,所以它们属于同种 , 但中子数不同,它们是氢的。
 25. 人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,绝少数α粒子发生了较大角度的偏转。(1)、卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 ;(2)、当α粒子轰击金属箔时,图中四条运动轨迹不可能出现的是(填字母)。
25. 人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,绝少数α粒子发生了较大角度的偏转。(1)、卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 ;(2)、当α粒子轰击金属箔时,图中四条运动轨迹不可能出现的是(填字母)。 26. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。(1)、卢瑟福核式结构模型是在利用α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (选填甲乙丙)。
26. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。(1)、卢瑟福核式结构模型是在利用α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (选填甲乙丙)。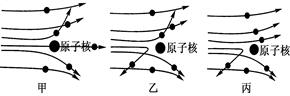 (2)、通过α粒子散射实验,你认为原子结构为以下的。
(2)、通过α粒子散射实验,你认为原子结构为以下的。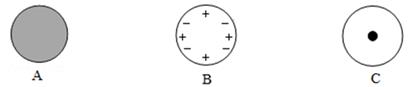 27. 下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
27. 下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
(1)、B微粒所带的电性为。(填“不带电”、“带正电”或“带负电”)(2)、与A互为同位素原子的是。28. 人类在探索物质是由什么构成的历史长河中,充满了智慧。阅读下面材料,回答相关问题。 (1)、汤姆森主要是纠正了“道尔顿原子论”中的观点;(2)、卢瑟福α粒子散射实验,推测原子是由和核外电子构成;(3)、原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。29. 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图:
(1)、汤姆森主要是纠正了“道尔顿原子论”中的观点;(2)、卢瑟福α粒子散射实验,推测原子是由和核外电子构成;(3)、原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。29. 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图:
绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
(1)、若原子质量、正电荷在原子内均匀分布,则 (填“会”或“不会”)是极少数α粒子发生大角度散射。卢瑟福提出“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。(2)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构最合理的为 。A、 B、
B、 C、
C、 30. 如图,其中①②③表示三种原子,“
30. 如图,其中①②③表示三种原子,“ ”“O,.“o”表示原子中的不同微粒。
”“O,.“o”表示原子中的不同微粒。 ②原子中质子数为;①②③中属于同种元素的原子是。

三、解答题
-
31. 探究原子结构的奥秘,19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。

⑴放射源-放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
⑵金箔-作为靶子,厚度1um,重叠了3000层左右的原子;
⑶荧光屏-α粒子打在上面发出闪光;
⑷通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。(2)、1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明________;A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的。 32. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。
32. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。 (1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。33. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是:一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
(1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。33. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是:一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了电子,进一步发展了原子、分子论。汤姆森主要是纠正了“道尔顿原子论”中的观点。
1911年,卢瑟福又通过实验,推测原子是由和核外电子构成,并提出了沿用至今的现代原子结构理论。
(2)、道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样,对实验现象进行解释的过程叫做。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。
34. 下表是某位同学收集的一些微粒的资料,请根据表格数据回答下列问题。粒子名称
质子数
中子数
电子数
带电性
A
14
14
14
不带电
B
26
30
24
带 2 个单位正电荷
C
14
14
16
D
14
16
14
不带电
(1)、上述粒子中属于原子的是。(2)、根据表格信息可知 C 的带电性为。(3)、表格中互为同位素的粒子是。(4)、比较 C 与 D 两种粒子,其中质量较大的是。35. 如图为某原子构成示意图,请你仔细观察此图片,谈谈你对原子结构的认识。(答出三条,合理均匀)
四、实验探究题
-
36. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。(1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α 粒子(带2个单位正电荷),射向一片极薄的金箔。他惊奇的发现,过去一直认为原 子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无 阻得通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。

根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:
A. ;
B.;
C.。
(2)、从原子结构模型建立的过程中,我们发现(填序号)。A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
37. 人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。【过程与现象】1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。结果发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的几乎达到180°,像是被金箔弹了回来。
【解释与结论】
(1)、绝大多数α粒子穿过金箔后方向不变,说明;(2)、通过上述实验,可推出的原子结构模型为;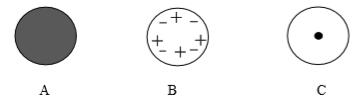 (3)、【分析与应用】当α粒子轰击金箔时,如图所示的运动轨迹不可能是(填字母)。
(3)、【分析与应用】当α粒子轰击金箔时,如图所示的运动轨迹不可能是(填字母)。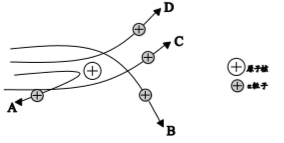 38. 在α粒子散射实验中,绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,甚至有极少数α粒子几乎达到180°,像是被金箔弹了回来。α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料。卢瑟福推测:除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
38. 在α粒子散射实验中,绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,甚至有极少数α粒子几乎达到180°,像是被金箔弹了回来。α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料。卢瑟福推测:除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。 (1)、支持卢瑟福推测的依据是。(2)、1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明 。A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒是。39. 人类对原子结构的认识永无止境。请根据所学知识回答:(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均 (填“正确”或“错误”)。
(1)、支持卢瑟福推测的依据是。(2)、1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明 。A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒是。39. 人类对原子结构的认识永无止境。请根据所学知识回答:(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均 (填“正确”或“错误”)。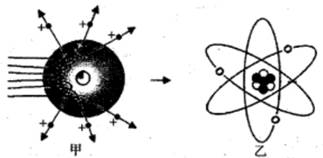 (2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个 。A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是:。40. 探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图)。
(2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个 。A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是:。40. 探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图)。 (1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(选填“会”或“不会”)发生大角度散射。(2)、绝大多数α粒子穿过后方向不变,说明 (填序号)。A、原子内部绝大部分空间是空的 B、原子的质量是均匀分布的(3)、从原子结构模型建立的过程中,我们发现 (填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(选填“会”或“不会”)发生大角度散射。(2)、绝大多数α粒子穿过后方向不变,说明 (填序号)。A、原子内部绝大部分空间是空的 B、原子的质量是均匀分布的(3)、从原子结构模型建立的过程中,我们发现 (填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质