冲刺2021高考化学押题训练(四)离子反应
试卷更新日期:2021-05-18 类型:三轮冲刺
一、单选题
-
1. 下列离子方程式书写正确的是( )A、通入H2S除去废水中的Cu2+等重金属离子:S2-+Cu2+=CuS↓ B、向NaAlO2溶液中滴入足量Ca(HCO3)2溶液:AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32- C、饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓ D、工业上用石灰乳制取漂白粉:Cl2+2OH- =ClO-+Cl-+H2O2. 下列反应对应的离子方程式正确的是( )A、 溶液中滴入稀硝酸: B、小苏打溶液中加入足量澄清石灰水: C、酸性高锰酸钾溶液与稀草酸反应: D、 溶液加入过量 溶液加热:3. 能正确表示下列变化的离子方程式是( )A、大理石与醋酸反应: +2CH3COOH=CO2↑+H2O+2CH3COO- B、用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-= +H2O C、硫酸铝溶液与过量氨水反应:Al3++4NH3·H2O= +4 +2H2O D、向NH4HCO3溶液中加过量的NaOH溶液: +OH-=NH3↑+H2O4. NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3 , Ka2=3.9×10-6) 溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
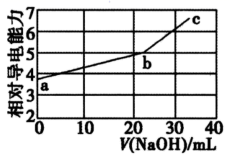 A、混合溶液的导电能力与离子浓度和种类有关 B、Na+与A-的导电能力之和大于HA-的导电能力 C、b点的混合溶液pH=7 D、c点的混合溶液中,c(Na+)>c(K+)>c(A2-)>c(OH-)5. 下列离子方程式正确的是( )A、浓烧碱溶液中加入铝片:Al+2OH-=AlO +H2↑ B、金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu C、碳酸氢钙溶液和氢氧化钠溶液混合:HCO +OH-=CO +H2O D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO +CO2+2H2O=Al(OH)3↓+HCO6. 下列实验现象或操作正确且与结论相匹配的是( )
A、混合溶液的导电能力与离子浓度和种类有关 B、Na+与A-的导电能力之和大于HA-的导电能力 C、b点的混合溶液pH=7 D、c点的混合溶液中,c(Na+)>c(K+)>c(A2-)>c(OH-)5. 下列离子方程式正确的是( )A、浓烧碱溶液中加入铝片:Al+2OH-=AlO +H2↑ B、金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu C、碳酸氢钙溶液和氢氧化钠溶液混合:HCO +OH-=CO +H2O D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO +CO2+2H2O=Al(OH)3↓+HCO6. 下列实验现象或操作正确且与结论相匹配的是( )现象或操作
结论
A
相同条件下,分别测量0.1 mol•L-1和0.01 mol•L-1醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
B
将H2O2溶液滴加到酸性KMnO4溶液中,溶液褪色
H2O2具有氧化性
C
常温下将大小相同的铝片分别加入到浓硝酸和稀硝酸中,浓硝酸比稀硝酸反应更剧烈
反应物浓度越大,反应速率越快
D
向碘水中加入CCl4振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
A、A B、B C、C D、D7. 向NaOH溶液中缓慢通入CO2气体,溶液中CO 的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )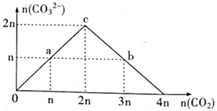 A、a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO )+2c(CO )+c(OH-) B、a、b、c三点溶液中水的电离程度:a=b<c C、a、b两点溶液的pH满足:pH(a)>pH(b) D、b点溶液满足:c(Na+)>c(HCO )>c(CO )>c(OH-)>c(H+)8. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L−1 Fe2(SO4)3溶液:Na+、K+、I−、CO B、0.1mol·L−1 KCl溶液:Cu2+、NH 、NO 、SO C、0.1mol·L−1 H2SO4溶液:Mg2+、K+、F−、NO D、0.1mol·L−1 Ba(OH)2溶液:Cu2+、Na+、SO 、HCO9. 下列离子方程式正确的是( )A、用稀硝酸溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O B、硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO +2H2O C、海带灰浸出液中滴加硫酸酸化的过氧化氢溶液:2I-+H2O2+2H+=I2+2H2O D、碳酸氢钠溶液与过量澄清石灰水混合:2HCO +Ca2++2OH-=CaCO3↓+2H2O+CO10. 根据下列图示所得出的结论错误的是( )
A、a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO )+2c(CO )+c(OH-) B、a、b、c三点溶液中水的电离程度:a=b<c C、a、b两点溶液的pH满足:pH(a)>pH(b) D、b点溶液满足:c(Na+)>c(HCO )>c(CO )>c(OH-)>c(H+)8. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L−1 Fe2(SO4)3溶液:Na+、K+、I−、CO B、0.1mol·L−1 KCl溶液:Cu2+、NH 、NO 、SO C、0.1mol·L−1 H2SO4溶液:Mg2+、K+、F−、NO D、0.1mol·L−1 Ba(OH)2溶液:Cu2+、Na+、SO 、HCO9. 下列离子方程式正确的是( )A、用稀硝酸溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O B、硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO +2H2O C、海带灰浸出液中滴加硫酸酸化的过氧化氢溶液:2I-+H2O2+2H+=I2+2H2O D、碳酸氢钠溶液与过量澄清石灰水混合:2HCO +Ca2++2OH-=CaCO3↓+2H2O+CO10. 根据下列图示所得出的结论错误的是( )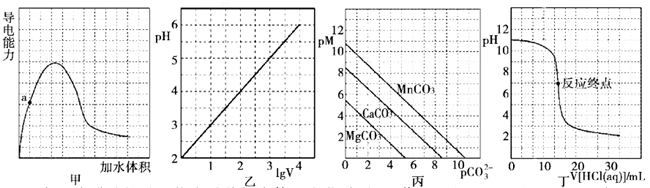 A、图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的 试纸测量a点的 ,则测量结果可能偏小 B、图乙表示 的盐酸溶液加水稀释至 随 的变化关系图 C、图丙表示一定温度下三种碳酸盐 的沉淀溶解平衡曲线图 ,则有 、 、 的 依次减小 D、图丁表示 盐酸滴定 溶液的滴定曲线11. 下列有关说法正确的是( )A、氧化钾溶于水能导电,所以氧化钾是电解质 B、强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 C、酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物 D、纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的 、 、 、 等重金属离子12. 在酸性溶液中能大量共存且为无色透明溶液的是( )A、 B、 C、 D、13. 下列说法正确的是( )A、N2O5属于酸性氧化物 B、蔗糖和铁都属于非电解质 C、CO2、SO2、NO2均为空气污染物 D、氧化钙常用在食品袋中做“去氧剂”14. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、含有FeCl2的溶液中: 、H+、K+、Ca2+ B、中性溶液中:Fe3+、 、 、 C、澄清透明溶液中:Cu2+、 、Cl-、Mg2+ D、 的溶液中: 、Na+、OH-、S2-15. 室温下,向 100mL 饱和 H2S 溶液中通入 SO2气体(气体体积换算成标准状况),发生反应: ,测得溶液 pH 与通入 SO2的关系如图。下列有关说法正确的是( )
A、图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的 试纸测量a点的 ,则测量结果可能偏小 B、图乙表示 的盐酸溶液加水稀释至 随 的变化关系图 C、图丙表示一定温度下三种碳酸盐 的沉淀溶解平衡曲线图 ,则有 、 、 的 依次减小 D、图丁表示 盐酸滴定 溶液的滴定曲线11. 下列有关说法正确的是( )A、氧化钾溶于水能导电,所以氧化钾是电解质 B、强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 C、酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物 D、纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的 、 、 、 等重金属离子12. 在酸性溶液中能大量共存且为无色透明溶液的是( )A、 B、 C、 D、13. 下列说法正确的是( )A、N2O5属于酸性氧化物 B、蔗糖和铁都属于非电解质 C、CO2、SO2、NO2均为空气污染物 D、氧化钙常用在食品袋中做“去氧剂”14. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、含有FeCl2的溶液中: 、H+、K+、Ca2+ B、中性溶液中:Fe3+、 、 、 C、澄清透明溶液中:Cu2+、 、Cl-、Mg2+ D、 的溶液中: 、Na+、OH-、S2-15. 室温下,向 100mL 饱和 H2S 溶液中通入 SO2气体(气体体积换算成标准状况),发生反应: ,测得溶液 pH 与通入 SO2的关系如图。下列有关说法正确的是( )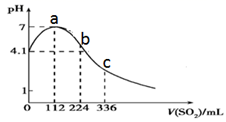 A、溶液的导电性:a>b>c B、整个过程中,水的电离程度先增大后减小 C、该温度下,H2S 的 Ka1数量级为 10-9 D、a 点之后,随 SO2气体的通入, 的值始终减小16. 下列各组离子在指定溶液中能大量共存的是( )A、常温下, 的溶液中: 、 、 、 B、加入 能放出 的溶液中: 、 、 、 C、常温下, 的溶液中: 、 、 、 D、常温下, 的溶液中: 、 、 、17. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程:
A、溶液的导电性:a>b>c B、整个过程中,水的电离程度先增大后减小 C、该温度下,H2S 的 Ka1数量级为 10-9 D、a 点之后,随 SO2气体的通入, 的值始终减小16. 下列各组离子在指定溶液中能大量共存的是( )A、常温下, 的溶液中: 、 、 、 B、加入 能放出 的溶液中: 、 、 、 C、常温下, 的溶液中: 、 、 、 D、常温下, 的溶液中: 、 、 、17. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程: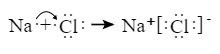 D、钢铁发生电化学腐蚀的正极反应:
18. 下列离子方程式正确的是( )A、用 从酸化的海带灰浸出液中提取碘: B、向碳酸氢铵溶液中加入过量的 NaOH溶液: C、向饱和的碳酸钠溶液中通入足量的二氧化碳: D、过量 SO2通入 NaClO溶液中:19. 下列指定反应的离子方程式正确的是( )A、酸化的NaIO3和NaI的溶液混合:I- +IO +6H+=I2 +3H2O B、实验室用氯化铝溶液和氨水制备氢氧化铝:Al3++3OH-=Al(OH)3↓ C、饱和Na2CO3溶液与CaSO4固体反应:CO (aq)+CaSO4(s) CaCO3(s)+SO (aq) D、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2 :Fe2++2OH-=Fe(OH)2 ↓20. 下列关于强弱电解质的叙述正确的是 ( )A、强电解质溶液的导电能力一定比弱电解质溶液强 B、NH3、CH3COOH、BaSO4、H3PO4都是弱电解质 C、CO2溶于水后能部分电离,故CO2是弱电解质 D、纯净的强电解质在液态时,有的导电,有的不导电21. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使甲基橙变红的溶液中:Na+、Cl−、CH3COO−、Fe2+ B、水电离的OH−浓度为10−12mol/L−1的溶液中:Mg2+、NH4+、AlO2−、SO32− C、无色溶液中:Al3+、NO3−、Cl−、SO42− D、c(H2C2O4)=0.5 mol/L溶液中:Na+、K+、MnO4−、Cl−22. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L-1 氨水溶液: Na+、 K+、OH-、NO3- B、0.1 mol·L-1 盐酸溶液: Na+、 K+、 SO42-、SiO32- C、0. 1 mol·L-1 KMnO4溶液: NH4+、Na+、 NO3-、I- D、0.1 mol·L-1 AgNO3溶液: NH4+、Mg2+、 Cl-、SO42-
D、钢铁发生电化学腐蚀的正极反应:
18. 下列离子方程式正确的是( )A、用 从酸化的海带灰浸出液中提取碘: B、向碳酸氢铵溶液中加入过量的 NaOH溶液: C、向饱和的碳酸钠溶液中通入足量的二氧化碳: D、过量 SO2通入 NaClO溶液中:19. 下列指定反应的离子方程式正确的是( )A、酸化的NaIO3和NaI的溶液混合:I- +IO +6H+=I2 +3H2O B、实验室用氯化铝溶液和氨水制备氢氧化铝:Al3++3OH-=Al(OH)3↓ C、饱和Na2CO3溶液与CaSO4固体反应:CO (aq)+CaSO4(s) CaCO3(s)+SO (aq) D、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2 :Fe2++2OH-=Fe(OH)2 ↓20. 下列关于强弱电解质的叙述正确的是 ( )A、强电解质溶液的导电能力一定比弱电解质溶液强 B、NH3、CH3COOH、BaSO4、H3PO4都是弱电解质 C、CO2溶于水后能部分电离,故CO2是弱电解质 D、纯净的强电解质在液态时,有的导电,有的不导电21. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使甲基橙变红的溶液中:Na+、Cl−、CH3COO−、Fe2+ B、水电离的OH−浓度为10−12mol/L−1的溶液中:Mg2+、NH4+、AlO2−、SO32− C、无色溶液中:Al3+、NO3−、Cl−、SO42− D、c(H2C2O4)=0.5 mol/L溶液中:Na+、K+、MnO4−、Cl−22. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L-1 氨水溶液: Na+、 K+、OH-、NO3- B、0.1 mol·L-1 盐酸溶液: Na+、 K+、 SO42-、SiO32- C、0. 1 mol·L-1 KMnO4溶液: NH4+、Na+、 NO3-、I- D、0.1 mol·L-1 AgNO3溶液: NH4+、Mg2+、 Cl-、SO42-二、多选题
-
23. 常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( )
 A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-24. 下列指定反应的离子方程式书写正确的是( )A、四氧化三铁溶于足量稀硝酸:3Fe3O4+28H++ =9Fe3++NO↑+14H2O B、工业上生产漂白粉的原理:Cl2+2OH-=Cl-+ClO-+H2O C、向硫酸铵溶液中滴入少量氢氧化钠溶液: +OH-=NH3·H2O D、向酸性高锰酸钾溶液中滴入少量H2O2溶液:2 +6H++7H2O2=2Mn2++6O2↑+10H2O
A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-24. 下列指定反应的离子方程式书写正确的是( )A、四氧化三铁溶于足量稀硝酸:3Fe3O4+28H++ =9Fe3++NO↑+14H2O B、工业上生产漂白粉的原理:Cl2+2OH-=Cl-+ClO-+H2O C、向硫酸铵溶液中滴入少量氢氧化钠溶液: +OH-=NH3·H2O D、向酸性高锰酸钾溶液中滴入少量H2O2溶液:2 +6H++7H2O2=2Mn2++6O2↑+10H2O三、实验探究题
-
25. 二氧化钒(VO2)是一种新型热敏材料,+4 价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体。过程如下:
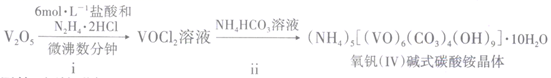
回答下列问题:
(1)、步骤i中生成VOCl2的同时还产生一种无色无污染的气体,所发生反应的化学方程式为。只用浓盐酸与V2O5反应也能制备VOCl2溶液,从安全与环保角度分析,该反应不被推广的主要原因是。(2)、步骤ii可在下图装置中进行。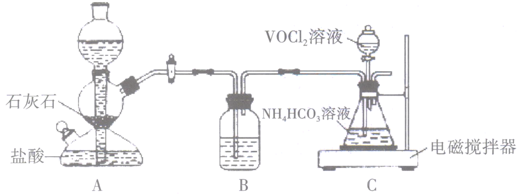
①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2 , 目的是。
②装置B中的试剂是。
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是 , 用无水乙醇洗涤的目的是。
(3)、测定氧钒(IV )碱式碳酸铵晶体粗产品中钒的含量。称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为: +Fe2++2H+=VO2++Fe3++H2O
①KMnO4溶液的作用是
②滴定终点时的现象为
③粗产品中钒的质量分数的表达式为
四、综合题
-
26. 由含锌废料(主要含ZnO、PbO、CuO及少量FeO、MnO)生产锌及氧化锌的流程如图所示:
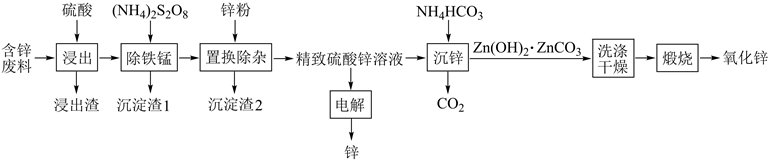
回答下列问题:
(1)、浸出渣主要成分为(填化学式,下同) ;沉淀渣2为。(2)、“除铁锰"”时,Mn(II)氧化生成MnO2( 转化为 ),配平该反应的离子方程式Mn2++ +H2O=MnO2↓+ +H+ , 。(3)、“沉锌”时,反应的化学方程式为;检验Zn(OH)2∙ZnCO3已洗涤干净的方法是。(4)、“电解”中产生(填化学式)可在(填操作单元名称)中循环利用。(5)、将Zn(OH)2∙ZnCO3加热分解可得到具有催化性能的活性氧化锌,若加热过程中固体质量减少了6. 2 kg,则理论上生成kg氧化锌。27. 以菱铁矿(主要成分FeCO3 , 还含有CaCO3和SiO2等杂质)为原料制备多功能水处理剂高铁酸钾(K2FeO4)的工艺流程如下: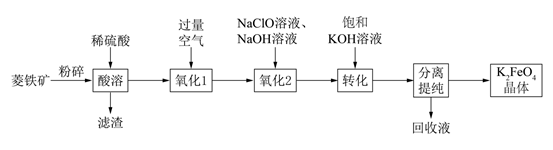
已知:①K2FeO4可溶于水、微溶于浓KOH溶液;
②FeO 在强碱性溶液中稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
回答下列问题:
(1)、K2FeO4中Fe元素的化合价是 ; 滤渣的主要成分有。(2)、“氧化1”过程所发生反应的离子方程式为;设计方案验证“氧化1”所得的溶液已经不再含有Fe2+(3)、NaClO的电子式为 ; “ 氧化2”过程中生成了Na2FeO4和NaCl写出该过程中发生的氧化还原反应的离子方程式(4)、提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用(填字母序号)和异丙醇。a.H2SO4溶液 b.KOH浓溶液 c.Fe2(SO4)3溶液
(5)、加饱和KOH溶液转化为K2FeO4后的溶液中,所含的阴离子除FeO 和OH-外,一定还含有。(6)、实验室也可按照如图所示的装置模拟电解法制备K2FeO4 , 其中阳极的电极反应式是。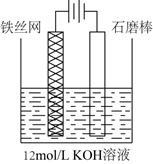 28. 黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂)。一种制备黄血盐的工艺如下:
28. 黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂)。一种制备黄血盐的工艺如下: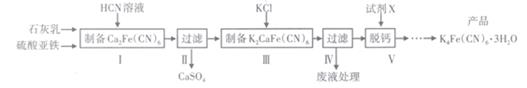
回答下列问题:
(1)、步骤I反应的化学方程式为(2)、步骤Ⅳ过滤所得的废液中含量较多的溶质为(填化学式)。(3)、步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6 , 所用的试剂X是(填名称)(4)、工艺中用到有毒的HCN溶液,含CN-的废水必须处理后才能排放。可用两段氧化法处理:第一次氧化: NaCN与NaClO反应,生成NaOCN和NaCl;
第二次氧化: NaOCN与NaClO反应,生成N2和两种盐(其中一种为酸式盐)。
已知HCN是一种苦杏仁味的无色剧毒液体(常温时,Ka=6.3×10-10),易挥发;HCN、HOCN中N元素的化合价相同。
①第一次氧化时,溶液应调节为 (填 “酸性”“碱性 ”或“中性"), 原因是。
②第二次氧化反应的离子方程式为
③常温下,0.1 mol•L-1 HCN溶液中,c(H+)=(列出计算式)。
29. 以菱锰矿(主耍成分MnCO3 , 还含有FeCO3、CaCO3、SiO2、Al2O3 , Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图: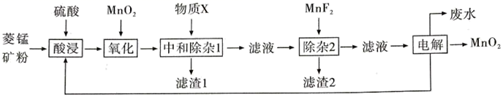
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)、写出“氧化”时发生反应的离子方程式。(2)、“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用 (填编号)。A、Cu B、CuCO3 C、NaOH D、MnCO3(3)、“除杂2”除去的主要离子是 (填离子符号)。(4)、除MnO2外该流程中可以循环使用的物质是。(5)、工业上采用如图所示的方法获得MnO2 , Mn2+将在极(填“C”或“D”)发生反应生成MnO2 , 电极反应式为。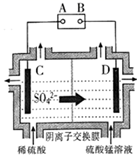 (6)、电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。[已知:H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15;Ksp(MnS)=1.4×10-15]30. 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图:
(6)、电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=。[已知:H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15;Ksp(MnS)=1.4×10-15]30. 铋是一种稀有金属,铋及其化合物在工业生产中用途广泛,如氯氧化铋常用于电子设备、汽车装饰材料、塑料助剂及生产干电池阴极。以下是一种用铋精矿(主要成分是Bi2S3还含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图: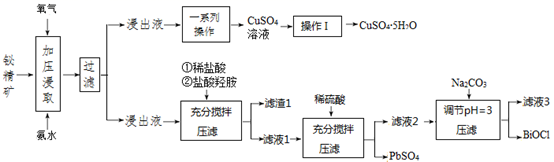 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
(1)、铋精矿在浸取时会先进行粉碎,目的是。(2)、加压氧化氨浸过程中,已知 CuS2发生如下反应: , 生成 ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式。(3)、操作Ⅰ为:。(4)、根据流程分析,盐酸羟胺在反应中起到什么作用:。(5)、流程中生成 BiOCl 的离子方程式:。(6)、滤液 3 中含有的金属阳离子有:。
-