冲刺2021高考化学押题训练(三)氧化还原反应
试卷更新日期:2021-05-18 类型:三轮冲刺
一、单选题
-
1. 将浓盐酸滴入KMnO4溶液中,产生黄绿色气体,溶液的紫红色褪去;向反应后的溶液中加入NaBiO3 , 溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。下列说法错误的是( )A、滴加盐酸时,KMnO4 是氧化剂,Cl2是氧化产物 B、此实验条件下,还原性:Cl->Mn2+>Bi3+ C、若有0.2 mol NaBiO3参加了反应,则整个过程转移电子为0.8NA D、已知Bi为第VA族元素,上述实验说明Bi具有较强的非金属性
-
2. 古籍中记载的下列事实或现象的形成,未涉及氧化还原反应的是( )A、《梦溪笔谈》:“石穴中水,所滴者皆为钟乳” B、《神农本草经》:“空青(蓝铜矿类)…能化铜铁鉉(铅)锡作金” C、《本草纲目》:“野外之鬼磷,其火色青,其状如炬,俗称鬼火…” D、《本草经疏》:“丹砂(HgS),味甘微寒而无毒…若经伏火…,则毒等砒硇,服之必毙”
-
3. 为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是其运载火箭的固体燃料,发生反应为2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,下列有 关该反应的说法正确的是( )A、上述条件下,氧化性:O2>NH4ClO4 B、该反应中,还原产物与氧化产物的物质的量之比为1:3 C、产生6.4 gO2时,反应转移的电子物质的量为0.8 mol D、0.5 mol NH4ClO4分解产生气体的体积为44.8 L
-
4. 下列过程不涉及氧化还原反应的是( )A、生物固氮 B、酿造米酒 C、海水提溴 D、侯氏制碱法制备纯碱
-
5. 硫化氢与甲醇合成甲硫醇的催化过程如下,下列说法中正确的是( )
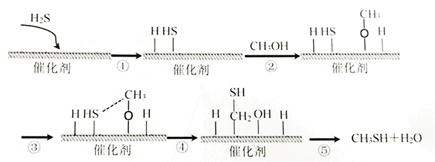 A、过程①放出能量 B、过程④中,只形成了C—S 键 C、硫化氢与甲醇合成甲硫醇的反应类型为取代反应 D、该催化剂可降低反应活化能,反应前后没有变化,并没有参加反应
A、过程①放出能量 B、过程④中,只形成了C—S 键 C、硫化氢与甲醇合成甲硫醇的反应类型为取代反应 D、该催化剂可降低反应活化能,反应前后没有变化,并没有参加反应 -
6. 2020 年,我国自主研制长征五号火箭“胖五”将嫦娥五号送入地月轨道并顺利从月球带回月壤。下列有关说法错误的是( )A、“胖五”用液氧、液氢作推进剂,在发射过程中发生氧化还原反应 B、“胖五”外壳为铝合金材料,其优点是熔点高、硬度大 C、月壤中可能含有未来能源材料3He,其中子数为 1 D、3He 与 4He 互为同位素
-
7. 北京大学研究员发现在钙钛矿活性层中引入稀土 Eu3+/Eu2+离子对,通过如图原理可消除零价铅和零价碘缺陷,提高钙钛矿太阳能电池的使用寿命。下列说法正确的是( )
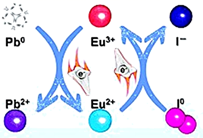 A、Eu3+/Eu2+离子对在反应过程中需定时补充 B、消除零价铅的反应为: C、消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应 D、整个过程中,电子从 I0转移给 Pb0
A、Eu3+/Eu2+离子对在反应过程中需定时补充 B、消除零价铅的反应为: C、消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应 D、整个过程中,电子从 I0转移给 Pb0 -
8. 化学反应中常伴有颜色变化,下列描述颜色变化的化学方程式错误的是( )A、 通入 溶液产生无色气体: B、 在 中燃烧产生白色和黑色固体: C、向 溶液中加入少量Zn粉,溶液黄色褪去: D、将表面覆盖黑色 的银器放入盛装食盐水的铝锅中煮沸后,银器重新变光亮:
-
9. 运用有关概念判断下列叙述正确的是 ( )A、1molH2燃烧放出的热量为H2的燃烧热 B、Na2SO3和H2O2的反应为氧化还原反应 C、
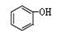 和
和 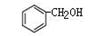 互为同系物
D、Fe(OH)3胶体和 FeSO4溶液均能产生丁达尔效应
互为同系物
D、Fe(OH)3胶体和 FeSO4溶液均能产生丁达尔效应
-
10. 某种飞船是以N2H4和N2O4为动力源,化学方程式为2N2H4+N2O4=3N2+ 4H2O,反应温度可高达2700℃,对于该反应,下列说法正确的是( )A、N2H4分子中所有原子可能共平面 B、N2O4 是还原剂 C、N2既是氧化产物又是还原产物 D、每转移16NA电子则会生成标况下67.2LN2
-
11. 某炼金厂的废水因连降暴雨而溢出,导致河水被严重污染,炼金废水中所含的CN- 有剧毒,其性质与卤素离子相似,还原性介于I-与Br- 之间,且HCN为弱酸。下列说法不正确的是( )A、NaCN是一种强电解质 B、CN- 可被Cl2氧化成(CN)2 C、(CN)2 能将Br-氧化 D、CN-可以和稀硫酸反应生成HCN
-
12. 下列诗句中所涉及的化学现象描述错误的是( )A、“春蚕到死丝方尽”中的“丝”的主要成分是蛋白质 B、“落日川渚寒,愁云绕天起”中的“云”属于胶体 C、“爆竹声中一岁除”涉及了氧化还原反应 D、“日照香炉生紫烟”描述了碘的升华
-
13. 氰氨化钙,俗称石灰氮,是一种高效的土壤消毒剂,其制备的化学方程式为:
CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
A、CO为氧化产物,H2为还原产物 B、CaCN2含有共价健,属于共价化合物 C、HCN既是氧化剂又是还原剂 D、每消耗10 g CaCO3转移电子0.4 mol -
14. 自然界中时刻存在着氮的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是( )
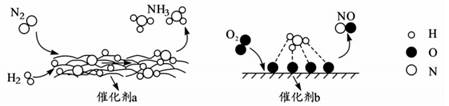 A、使用催化剂a、b均可以提高单位时间内生成物的产量 B、在催化剂b作用下,O2发生了氧化反应 C、催化剂a、b表面均发生了极性共价键的断裂 D、N2→NH3 , NH3→NO均属于氮的固定
A、使用催化剂a、b均可以提高单位时间内生成物的产量 B、在催化剂b作用下,O2发生了氧化反应 C、催化剂a、b表面均发生了极性共价键的断裂 D、N2→NH3 , NH3→NO均属于氮的固定 -
15. 化学与生产、生活密切相关。下列说法错误的是( )A、维生素C具有还原性,应密封保存 B、用Na2S处理工业废水中的Cu2+、Hg2+等重金属离子 C、75%的酒精能使蛋白质变性,可用于医用消毒 D、酸性洁厕灵与碱性“84消毒液”共用,可提高清洁效果
-
16. 探究Na2O2与水的反应,实验如图:
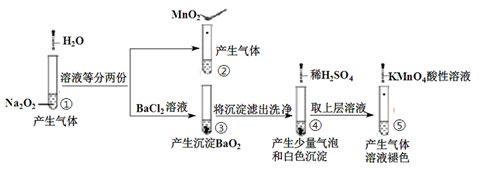
已知:H2O2⇌H++HO2-;HO2-⇌H++O22-
下列分析错误的是( )
A、①、④实验中均发生了氧化还原反应和复分解反应 B、①、⑤中产生的气体能使带火星的木条复燃,说明存在H2O2 C、③和④不能说明溶解性:BaO2>BaSO4 D、⑤中说明H2O2具有还原性 -
17. 化学与生产生活密切相关,下列说法错误的是( )A、铁粉有还原性可作吸氧剂 B、生石灰能与水反应可作干燥剂 C、福尔马林能杀菌防腐可作食品保鲜剂 D、明矾能水解形成胶体可作净水剂
-
18. 向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
 A、对比实验①和②可知还原性:Br->Cl- B、对比实验①和③可知氧化性:Br2>SO2 C、对比实验②和③可知酸性:H2SO4>HCl>H2SO3 D、由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
A、对比实验①和②可知还原性:Br->Cl- B、对比实验①和③可知氧化性:Br2>SO2 C、对比实验②和③可知酸性:H2SO4>HCl>H2SO3 D、由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性 -
19. 常温下,向H2O2溶液中滴加少量Fe2(SO4)3溶液,反应原理如图所示。关于该反应过程的说法正确的是( )
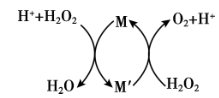 A、该反应过程中,M是Fe3+ , M′是Fe2+ B、当有1molO2生成时,转移2mo1电子 C、在H2O2分解过程中,溶液的pH逐渐降低 D、H2O2的氧化性比Fe3+强,还原性比Fe2+弱
A、该反应过程中,M是Fe3+ , M′是Fe2+ B、当有1molO2生成时,转移2mo1电子 C、在H2O2分解过程中,溶液的pH逐渐降低 D、H2O2的氧化性比Fe3+强,还原性比Fe2+弱 -
20. 下列实验的现象与结论相对应的是( )
A
B
C
D
实验


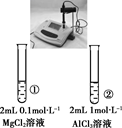
现象
一段时间后,a管液面高于b管液面
酸性KMnO4溶液褪色
pH计测得①中pH大于②中pH
试管①中有大量气泡,试管②中无现象
结论
a管发生吸氧腐蚀,b管发生析氢腐蚀
有乙烯生成可以使酸性KMnO4溶液褪色
金属性:Mg>Al
酸性:醋酸>碳酸>硼酸
A、A B、B C、C D、D -
21. 用来解释下列事实的方程式错误的是( )A、钢铁发生吸氧腐蚀的正极反应:O2+4e-+2H2O=4OH- B、将氯气通入石灰乳制备漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C、向Na2SiO3溶液中通过量CO2制备硅酸凝胶:SiO32-+2CO2+2H2O=H2SiO3+2HCO3- D、溶质物质的量比为1:1的明矾溶液和Ba(OH)2溶液混合:2SO42-+2Ba2++Al3++4OH-=AlO2-+2BaSO4↓+2H2O
二、多选题
-
22. 下列实验对应的现象及结论均正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
向FeCl3溶液中通入足量的H2S
生成两种沉淀
Fe3+的氧化性强于S
B
向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液
先出现浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
C
向FeCl3溶液中滴入几滴30%的H2O2溶液
有气体产生,一段时间后,FeCl3溶液颜色加深
Fe3+能催化H2O2 分解,且该分解反应为放热反应
D
铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体
加热时无明显现象,加入硝酸钾后溶液变蓝
硝酸钾起催化作用
A、A B、B C、C D、D -
23. 工业上除去NO的一种反应机理如图所示。下列说法中正确的是( )
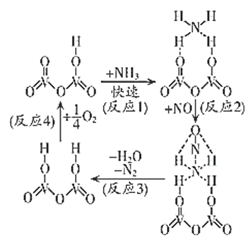 A、该反应的氧化剂为NO、O2 B、反应1决定整个反应的速率快慢 C、反应过程中V元素的化合价未发生变化 D、反应中除去1molNO,消耗1molNH3
A、该反应的氧化剂为NO、O2 B、反应1决定整个反应的速率快慢 C、反应过程中V元素的化合价未发生变化 D、反应中除去1molNO,消耗1molNH3
三、实验探究题
-
24. ClO2是一种优良的消毒剂,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,实验室在50℃时制备ClO2。
实验Ⅰ:制取并收集ClO2 , 装置如图所示:
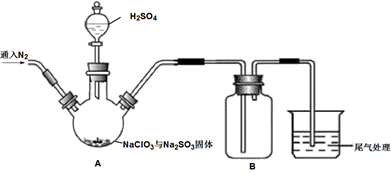 (1)、写出用上述装置制取ClO2的化学反应方程式。(2)、装置A中持续通入N2的目的是。装置B应添加(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。(3)、实验Ⅱ:测定装置A中ClO2的质量,设计装置如图:
(1)、写出用上述装置制取ClO2的化学反应方程式。(2)、装置A中持续通入N2的目的是。装置B应添加(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。(3)、实验Ⅱ:测定装置A中ClO2的质量,设计装置如图: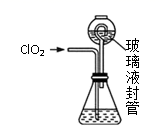
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L−1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I−+S4O62-)。
装置中玻璃液封管的作用是。
(4)、滴定终点的现象是。(5)、测得通入ClO2的质量m(ClO2)=g(用整理过的含c、V的代数式表示)。 -
25. 硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。(1)、制备硝酸铁
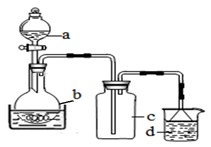
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、、 , 用浓硝酸洗涤、干燥。
(2)、探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是。
②用5mL 溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
(3)、实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验: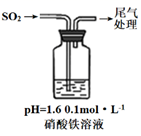
i.缓慢通入SO2 , 溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2 , 溶液逐渐变为深棕色。
已知:Fe2++NO⇌[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:。
⑤步骤ii后期反应的离子方程式是。
(4)、由以上探究硝酸铁的性质实验得出的结论是。 -
26. 某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2 , 冷却后过滤,滤液定容于250 mL容量瓶中;
Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
Ⅲ.向Ⅱ的锥形瓶中加入c mol·L−1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:ⅰ.F−与Fe3+生成稳定的FeF63−(无色)。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2+I− ⇌ I3−(棕黄色)。
ⅳ.I2+2Na2S2O3= 2NaI+Na2S4O6(无色)。
(1)、Ⅰ中Cu溶解的离子方程式是。(2)、Ⅱ中Cu2+和I−反应生成CuI白色沉淀和I2。①加入NH4F溶液的目的是。
②Cu2+和I−反应的离子方程式是。
③加入过量KI溶液的作用是。
(3)、室温时,CuSCN的溶解度比CuI小。CuI沉淀表面易吸附I2和I3− , 使测定结果不准确。Ⅲ中,在滴定至终点前加入KSCN溶液的原因是。(4)、样品中Cu的质量分数为(列出表达式)。
四、综合题
-
27. 钼酸钠晶体(Na2MoO4·2H2O) 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是MoS2 , 含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:
 (1)、为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。(2)、“浸取"时产生的气体A是。(3)、若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。(4)、“结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。(5)、重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。(6)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。
(1)、为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。(2)、“浸取"时产生的气体A是。(3)、若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。(4)、“结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。(5)、重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。(6)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。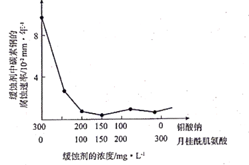
-
28. 某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:Ⅰ.ZnSO3· H2O微溶于水,ZnSO4易溶于水。
Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。

Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e− , 同时生成1 mol O2。
(1)、SO2造成的环境问题主要是。(2)、ZnO将SO2转化为ZnSO3· H2O的化学方程式是。(3)、将ZnSO3· H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3 , 研究O3氧化ZnSO3· H2O,其中溶液pH随时间变化的曲线如下:
①pH=3.5的溶液中含S(+4价)的离子主要是。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是。
③解释O3氧化可防止管道堵塞的原因:。
-
29. 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
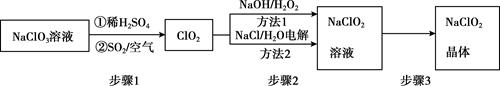
已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)、步骤1中,生成ClO2的离子方程式是 , 通入空气的作用是。(2)、方法1中,反应的离子方程式是 , 利用方法1制NaClO2时,温度不能超过20℃,可能的原因是。(3)、方法2中,NaClO2在生成(选填“阴极”或“阳极”)。(4)、NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶溶液中获得NaClO2的操作是。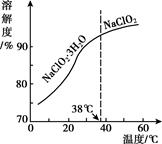 (5)、为测定制得的晶体中NaClO2的含量,做如下操作:
(5)、为测定制得的晶体中NaClO2的含量,做如下操作:①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol•L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O32-=2I-+S4O62-)。样品中NaClO2的质量分数为。(用含a、b、c的代数式表小)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是(用离子方程式和文字表示)。
(6)、NaClO2使用时,加入稀盐酸即可迅速得到ClO2。但若加入盐酸浓度过大,则气体产物中Cl2的含量会增大,原因是。 -
30. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
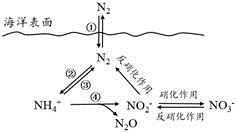 (1)、海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是(填图中数字序号)。(2)、下列关于海洋氮循环的说法正确的是(填字母序号)。
(1)、海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是(填图中数字序号)。(2)、下列关于海洋氮循环的说法正确的是(填字母序号)。a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)、有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:NH4++ 5O2=2NO2-+ H+++
(4)、有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:温度/℃
样本氨氮含量/mg
处理24 h
处理48 h
氨氮含量/mg
氨氮含量/mg
20
1008
838
788
25
1008
757
468
30
1008
798
600
40
1008
977
910
硝化细菌去除氨氮的最佳反应温度是 , 在最佳反应温度时,48 h内去除氨氮反应的平均速率是mg·L-1·h-1。
(5)、为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。右图是间接氧化工业废水中氨氮(NH4+)的示意图。
① 结合电极反应式简述间接氧化法去除氨氮的原理:。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将(填“增大”、“不变”或“减小”),请简述理由:。
