冲刺2021高考化学押题训练(一)物质的组成、性质、分类和化学用语
试卷更新日期:2021-05-18 类型:三轮冲刺
一、单选题
-
1. 下列有关化学用语表示正确的是( )A、次氯酸的结构式:H-Cl-O B、CaO2 的电子式:
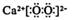 C、CO2分子的比例模型:
C、CO2分子的比例模型: 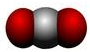 D、乙醇的分子式:CH3CH2OH
2. 下列离子方程式书写正确的是( )A、通入H2S除去废水中的Cu2+等重金属离子:S2-+Cu2+=CuS↓ B、向NaAlO2溶液中滴入足量Ca(HCO3)2溶液:AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32- C、饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓ D、工业上用石灰乳制取漂白粉:Cl2+2OH- =ClO-+Cl-+H2O3. 下列反应对应的离子方程式正确的是( )A、 溶液中滴入稀硝酸: B、小苏打溶液中加入足量澄清石灰水: C、酸性高锰酸钾溶液与稀草酸反应: D、 溶液加入过量 溶液加热:4. 下列物质中含有共价键的盐是( )A、KOH B、KClO C、KCl D、HClO5. 能正确表示下列变化的离子方程式是( )A、大理石与醋酸反应: +2CH3COOH=CO2↑+H2O+2CH3COO- B、用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-= +H2O C、硫酸铝溶液与过量氨水反应:Al3++4NH3·H2O= +4 +2H2O D、向NH4HCO3溶液中加过量的NaOH溶液: +OH-=NH3↑+H2O6. 下列离子方程式正确的是( )A、浓烧碱溶液中加入铝片:Al+2OH-=AlO +H2↑ B、金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu C、碳酸氢钙溶液和氢氧化钠溶液混合:HCO +OH-=CO +H2O D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO +CO2+2H2O=Al(OH)3↓+HCO7. 利用超分子可分离C60和C70.将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是( )
D、乙醇的分子式:CH3CH2OH
2. 下列离子方程式书写正确的是( )A、通入H2S除去废水中的Cu2+等重金属离子:S2-+Cu2+=CuS↓ B、向NaAlO2溶液中滴入足量Ca(HCO3)2溶液:AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32- C、饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓ D、工业上用石灰乳制取漂白粉:Cl2+2OH- =ClO-+Cl-+H2O3. 下列反应对应的离子方程式正确的是( )A、 溶液中滴入稀硝酸: B、小苏打溶液中加入足量澄清石灰水: C、酸性高锰酸钾溶液与稀草酸反应: D、 溶液加入过量 溶液加热:4. 下列物质中含有共价键的盐是( )A、KOH B、KClO C、KCl D、HClO5. 能正确表示下列变化的离子方程式是( )A、大理石与醋酸反应: +2CH3COOH=CO2↑+H2O+2CH3COO- B、用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-= +H2O C、硫酸铝溶液与过量氨水反应:Al3++4NH3·H2O= +4 +2H2O D、向NH4HCO3溶液中加过量的NaOH溶液: +OH-=NH3↑+H2O6. 下列离子方程式正确的是( )A、浓烧碱溶液中加入铝片:Al+2OH-=AlO +H2↑ B、金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu C、碳酸氢钙溶液和氢氧化钠溶液混合:HCO +OH-=CO +H2O D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO +CO2+2H2O=Al(OH)3↓+HCO7. 利用超分子可分离C60和C70.将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是( )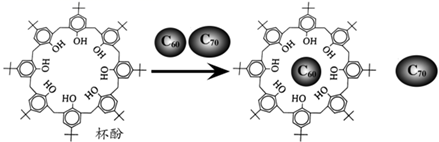 A、第一电离能:C<O B、杯酚分子中存在大π键 C、杯酚与C60形成氢键 D、C60与金刚石晶体类型不同8. 三草酸合铁酸钾( )是制备铁触媒的主要原料。该配合物在光照下发生分解: 。下列说法错误的是( )A、Fe3+的最高能层电子排布式为 3d5 B、 中铁离子的配位数为 6 C、 中 C原子的杂化方式为 sp2 D、CO2 分子中σ键和π键数目比为1:19. 侯氏制碱法主要反应原理:NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl。下列有关说法错误的是( )A、CO2空间构型为直线形 B、NaCl固体为离子晶体 C、Na的原子结构示意图为
A、第一电离能:C<O B、杯酚分子中存在大π键 C、杯酚与C60形成氢键 D、C60与金刚石晶体类型不同8. 三草酸合铁酸钾( )是制备铁触媒的主要原料。该配合物在光照下发生分解: 。下列说法错误的是( )A、Fe3+的最高能层电子排布式为 3d5 B、 中铁离子的配位数为 6 C、 中 C原子的杂化方式为 sp2 D、CO2 分子中σ键和π键数目比为1:19. 侯氏制碱法主要反应原理:NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl。下列有关说法错误的是( )A、CO2空间构型为直线形 B、NaCl固体为离子晶体 C、Na的原子结构示意图为 D、NH4Cl的电子式为
D、NH4Cl的电子式为  10. 下列离子方程式正确的是( )A、用稀硝酸溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O B、硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO +2H2O C、海带灰浸出液中滴加硫酸酸化的过氧化氢溶液:2I-+H2O2+2H+=I2+2H2O D、碳酸氢钠溶液与过量澄清石灰水混合:2HCO +Ca2++2OH-=CaCO3↓+2H2O+CO11. 以下有关垃圾分类说法正确的是( )A、茶叶果皮属于厨余垃圾,可通过转化变为有机氮肥 B、废旧玻璃属于可回收垃圾,其主要成分为新型无机非金属材料 C、食品包装塑料袋属于其他垃圾,其主要成分聚氯乙烯为有机高分子化合物 D、医疗废弃物属于有害垃圾,经过处理、消毒后可加工成儿童玩具12. 下列化学用语错误的是( )A、中子数为10的氧原子: O B、氯化钠的电子式:
10. 下列离子方程式正确的是( )A、用稀硝酸溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O B、硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO +2H2O C、海带灰浸出液中滴加硫酸酸化的过氧化氢溶液:2I-+H2O2+2H+=I2+2H2O D、碳酸氢钠溶液与过量澄清石灰水混合:2HCO +Ca2++2OH-=CaCO3↓+2H2O+CO11. 以下有关垃圾分类说法正确的是( )A、茶叶果皮属于厨余垃圾,可通过转化变为有机氮肥 B、废旧玻璃属于可回收垃圾,其主要成分为新型无机非金属材料 C、食品包装塑料袋属于其他垃圾,其主要成分聚氯乙烯为有机高分子化合物 D、医疗废弃物属于有害垃圾,经过处理、消毒后可加工成儿童玩具12. 下列化学用语错误的是( )A、中子数为10的氧原子: O B、氯化钠的电子式: C、CH4的比例模型:
C、CH4的比例模型:  D、乙炔的结构式:H-C≡C-H
13. 下列有关化学用语表示错误的是( )A、葡萄糖的最简式CH2O B、质量数为18的氧原子:18O C、NaClO 的电子式:
D、乙炔的结构式:H-C≡C-H
13. 下列有关化学用语表示错误的是( )A、葡萄糖的最简式CH2O B、质量数为18的氧原子:18O C、NaClO 的电子式: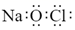 D、2-丁烯的结构简式: CH3CH=CHCH3
14. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程:
D、2-丁烯的结构简式: CH3CH=CHCH3
14. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程: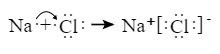 D、钢铁发生电化学腐蚀的正极反应:
D、钢铁发生电化学腐蚀的正极反应:
二、综合题
-
15. 在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。请回答:
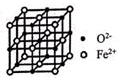 (1)、基态铁原子的价电子排布式为 , FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是 。(2)、氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为 ;Fe2+与O2-最短核间距为pm。(3)、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1)、基态铁原子的价电子排布式为 , FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是 。(2)、氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为 ;Fe2+与O2-最短核间距为pm。(3)、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。①Ni(NH3)6]SO4中阴离子的立体构型是。
②在[NiNH3)6]SO4中Ni2+ 与NH3之间形成的化学键称为 , 提供孤电子对的成键原子是。
(4)、无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3。已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式 , 1 mol该配合物中含有σ键的数目为。16. S、Se 、N、Fe等元素及其化合物在科学研究和工业生产中具有重要的作用。(1)、臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:
0.1mol 3﹣MBT中含有σ键数目为(NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是。
(2)、2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为 , 与其互为等电子体的阴离子为 (举一例)。(3)、铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是 (填序号,下同),违背洪特规则的是。
A.
 B.
B. 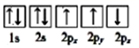 C.
C. 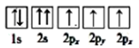 (4)、如图是金属铁晶体中的一个晶胞。
(4)、如图是金属铁晶体中的一个晶胞。
①该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为g•cm﹣3(用含有r、NA的最简代数式表示)。
17. 我国已经形成对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先。同时也是最早研究稀土—钴化合物结构的国家。请回答下列问题:(1)、钴原子的价层电子排布图为 , 其M层上共有个不同运动状态的电子。Fe和Co的第四电离能I4(Fe)I4(Co)(填“>”、“<”或“=”)。(2)、①为某含钴配合物的组成为CoCl3·5NH3·H2O,是该配合物中钴离子的配位数是6。1mol该配合物可以与足量的硝酸银反应生成3molAgCl沉淀,则该配合物的配体是 , 其中氮原子的杂化类型为。试判断NH3分子与钴离子形成配合物后,H—N—H键角会 (填“变大”、“变小”或“不变”),并说明理由。②某含钴配合物化学式为CoCl3·3NH3 , 该配合物在热NaOH溶液中发生反应产生絮状沉淀,并释放出气体,该反应的化学方程式为。该配合物中存在的化学键有(填字母)。
A.共价键 B.σ键 C.π键 D.配位键
(3)、一种铁氮化合物具有高磁导率,其结构如图所示: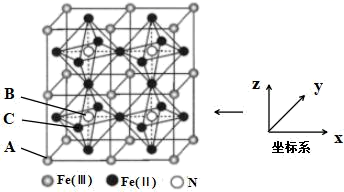
①该结构中单纯分析铁的堆积,其堆积方式为。
②已知A点的原子坐标参数为(0,0,0),B点的原子坐标参数为( ),则C点的原子坐标参数为。
18. 铬及其化合物用途广泛。回答下列问题:(1)、基态Cr原子价电子排布式为 , 有个未成对电子。(2)、重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂, 的结构如图。(NH4)2Cr2O7 中N、O、Cr三种元素第一电离能由大到小的顺序是(填元素符号),1 mol该物质中含σ键的数目为NA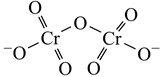 (3)、铬能形成多种配合物。
(3)、铬能形成多种配合物。①配合物a、b、c的化学式如下:
a, [Cr(H2O)4Cl2]Cl∙2H2O b. [Cr(H2O)5Cl]Cl2∙H2O c. [Cr(H2O)6 ]Cl3
相同物质的量的a、b、c分别与足量AgNO3溶液反应,生成AgCl的物质的量之比为。
②Reinecke salt的结构如图所示:
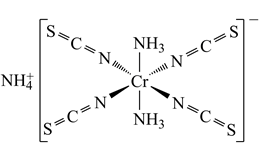
其中配位原子为(填元素符号);阳离子的空间结构为 , NCS-中碳原子杂化方式为。
(4)、一种半金属磁体的结构如图所示,其晶胞参数为a pm。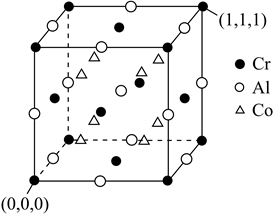
①距离每个Cr最近的Al有个,距离Cr(0,0,0)最近的Co的原子坐标为。
②该晶体的密度为g∙cm-3(NA表示阿伏加德罗常数的值)。
19. 海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。(1)、写出基态溴原子的价电子排布式 , 氟、氯、溴、氧四种元素中,电负性由大到小的顺序为(填元素符号) 。(2)、Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1 , 二者相差很大的原因是。(3)、X射线衍射测定等发现,I3AsF6 中存在I 离子。I 离子的几何构型为 , 中心原子的杂化类型为。(4)、C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。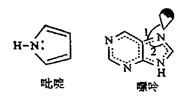
①1mol吡啶分子中含有σ键数目是NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为。
(5)、CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示: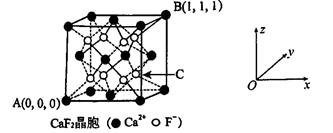
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为( , , )
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA , 则其密度为g•cm-3 (列出计算式即可) 。
20. 硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:(1)、Se元素基态原子的电子排布式为;第四周期中第一电离能比Se元素大的共有种(氪元素除外)。(2)、气态SeO3分子的价层电子对互斥模型为 ;SeO42-离子中Se原子的杂化方式为 。(3)、固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。①图1中Se-O键键长较短的是 (填“a"或“b"),其原因是。
②SeO2熔点为350℃,固态SeO2属于晶体,其熔点远高于SO2(-75.5℃)的原因是 。
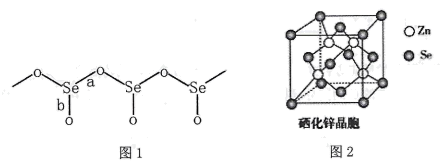 (4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为 g.cm-3。21. 硫及其化合物有许多用途。请回答下列问题。(1)、基态硫原子的价电子排布式为 , 其电子占据最高能级的电子云轮廓图形状为(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是 , SO2中心原子的价层电子对数为。(4)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有
(4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为 g.cm-3。21. 硫及其化合物有许多用途。请回答下列问题。(1)、基态硫原子的价电子排布式为 , 其电子占据最高能级的电子云轮廓图形状为(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是 , SO2中心原子的价层电子对数为。(4)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有A. H2O B. CO2 C. SO2 D. CH4
(5)、方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为 g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm 22. 闪锌矿与纤锌矿的主要成分均为ZnS。在一定条件下ZnO与ZnS、Se共热可制备荧光材料ZnSe。回答下列问题:(1)、基态Se原子的价电子排布式为 , 基态Zn与S原子成对电子数之比为。(2)、 的电负性由大到小的顺序为。制备 过程中会产生少量 ,其中 原子采用杂化, 的空间构型为。(3)、 晶胞与 晶胞相似(如图),晶胞中距离最近的两个 的距离为 ,请计算 晶胞的密度 。
22. 闪锌矿与纤锌矿的主要成分均为ZnS。在一定条件下ZnO与ZnS、Se共热可制备荧光材料ZnSe。回答下列问题:(1)、基态Se原子的价电子排布式为 , 基态Zn与S原子成对电子数之比为。(2)、 的电负性由大到小的顺序为。制备 过程中会产生少量 ,其中 原子采用杂化, 的空间构型为。(3)、 晶胞与 晶胞相似(如图),晶胞中距离最近的两个 的距离为 ,请计算 晶胞的密度 。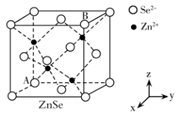 (4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点Se2-(0,0,0),B点Se2-的分数坐标为;从该晶胞中找出距离B点Se2-最远的Zn2+的位置(用分数坐标表示)。23. 我国科研工作者最近发现并制备了一系列主要由 O、P、Se、Bi 等元素组成的导电材料。回答下列问题:(1)、基态硒原子的价电子排布式为;SeO2的熔点为 350 ℃,加热易升华,固态SeO2属于 晶体。(2)、O、P、S三种元素中,电负性最大的是;键角:H2OH2Se(填">"、"<"或"=")。(3)、纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是;熔融状态的磷酸导电性很好,这是由于在纯磷酸中存在如下质子交换导电机理。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点Se2-(0,0,0),B点Se2-的分数坐标为;从该晶胞中找出距离B点Se2-最远的Zn2+的位置(用分数坐标表示)。23. 我国科研工作者最近发现并制备了一系列主要由 O、P、Se、Bi 等元素组成的导电材料。回答下列问题:(1)、基态硒原子的价电子排布式为;SeO2的熔点为 350 ℃,加热易升华,固态SeO2属于 晶体。(2)、O、P、S三种元素中,电负性最大的是;键角:H2OH2Se(填">"、"<"或"=")。(3)、纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是;熔融状态的磷酸导电性很好,这是由于在纯磷酸中存在如下质子交换导电机理。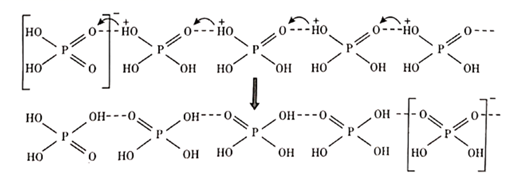
由此可以推知纯磷酸液体中存在的导电微粒是 和 , 的空间构型为。
(4)、硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的 层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为 , 其中Se的分数坐标为。晶胞棱边夹角均为90°,硒氧化铋的摩尔质量为 M g·mol-1 , 则晶体密度的表达式为g·cm-3(NA为阿伏加德罗常数的值)。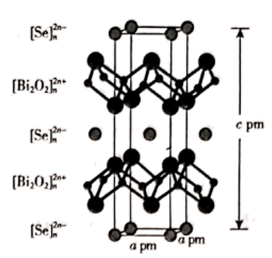 24. 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3 TiCl4↑+TiCl2 , 回答下列问题:(1)、基态钛原子的价电子排布式为。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是(写元素符号),原因是。(2)、钛的氯化物的部分物理性质如下表:
24. 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3 TiCl4↑+TiCl2 , 回答下列问题:(1)、基态钛原子的价电子排布式为。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是(写元素符号),原因是。(2)、钛的氯化物的部分物理性质如下表:氯化物
熔点/℃
沸点/℃
溶解性
TiCl4
-24
136
可溶于非极性的甲苯和氯代烃
TiCl2
1035
1500
不溶于氯仿、乙醚
①TiCl4与TiCl2的晶体类型分别是、。
②TiCl4与 互为等电子体,因为它们相同; 中心原子的杂化方式是。
(3)、Ti的配合物有多种。 的配体所含原子中电负性最小的是; 的球棍结构如图Ⅰ,Ti的配位数是。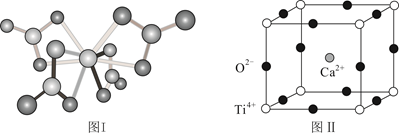 (4)、钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。
(4)、钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。①设NA为阿伏加德罗常数的值,计算一个晶胞的质量为g。
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则 。
25. B、Si和P 是组成半导体材料的重要元素。回答下列问题(1)、基态B、Si 和P中,单电子数最多的是 , 电负性最大的是。(2)、PCl3中心原子的杂化类型为 , BCl3与阴离子互为等电子体。(3)、SiCl4 极易与水反应,其反应机理如图。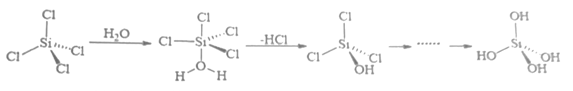
①上述反应机理涉及的分子中属于非极性分子的是。(填化学式)
②关于上述反应机理的说法正确的是。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
(4)、两种含硅化合物的晶胞结构如图所示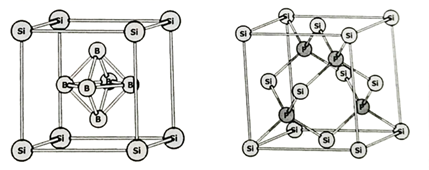
I Ⅱ
①这两种含硅化合物的化学式分别为和。
②I的晶胞参数为a pm,则Ⅰ的密度为 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和 pm,则Ⅱ的空间占有率为。
26. 铜是人类最早使用的金属之一,最近科学家发现 Cu 元素有很强的杀菌作用,还可代替Al 布线在硅芯片上。用黄铜矿(主要成分为 CuFeS2)生产粗铜,其反应原理如下: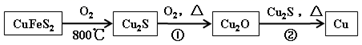
回答下列问题:
(1)、S 和 O 相比,第一电离能较小的元素是 ;在下列图示中,Si 的基态价电子排布图是(填选项字母)。A、
 B、
B、 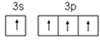 C、
C、  D、
D、 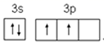 (2)、Cu2O 和 Cu2S 均为离子晶体,Cu2O 的熔点为 1235℃,Cu2S 的熔点为 1130℃,Cu2O熔点较高的原因是 。(3)、反应①、②中生成的气体 SO2中心原子的杂化方式为 , 分子的立体构型为 。(4)、与 NH3互为等电子体的粒子的化学式有 (写出一种)。工业上常用铜氨溶液制造人造丝,某学生做了如下实验:CuSO4溶液 蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为 。(5)、Cu2O 的晶胞结构如图所示,若原子坐标参数 A 为(0,0,0),B 为 ,则 C 原子的坐标参数为 。若该晶体的密度为 dg/cm3 , 阿伏加德罗常数的值为NA , 则该晶胞中 Cu 原子与 O 原子之间的距离为 pm。(用含 d 和 NA的式子表示)。
(2)、Cu2O 和 Cu2S 均为离子晶体,Cu2O 的熔点为 1235℃,Cu2S 的熔点为 1130℃,Cu2O熔点较高的原因是 。(3)、反应①、②中生成的气体 SO2中心原子的杂化方式为 , 分子的立体构型为 。(4)、与 NH3互为等电子体的粒子的化学式有 (写出一种)。工业上常用铜氨溶液制造人造丝,某学生做了如下实验:CuSO4溶液 蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为 。(5)、Cu2O 的晶胞结构如图所示,若原子坐标参数 A 为(0,0,0),B 为 ,则 C 原子的坐标参数为 。若该晶体的密度为 dg/cm3 , 阿伏加德罗常数的值为NA , 则该晶胞中 Cu 原子与 O 原子之间的距离为 pm。(用含 d 和 NA的式子表示)。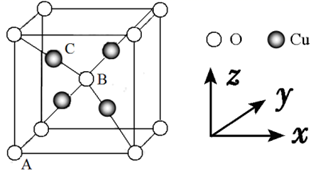 27. 在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:(1)、钴原子的价层电子的电子排布式为 , Co4+中存在种不同能级的电子。(2)、Co3+在水中易被还原成 Co2+ , 而在氨水中可稳定存在,其原因为。(3)、一种钴的配合物乙二胺四乙酸合钴的结构为
27. 在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:(1)、钴原子的价层电子的电子排布式为 , Co4+中存在种不同能级的电子。(2)、Co3+在水中易被还原成 Co2+ , 而在氨水中可稳定存在,其原因为。(3)、一种钴的配合物乙二胺四乙酸合钴的结构为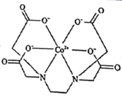 ,1mol 该配合物形成的配位键有mol,配位原子是 , 碳原子的杂化类型有。 (4)、钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个型小立方体构成,其化学式为 , 晶体中Al3+占据O2-形成的(填 “四面体空隙”或 “八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为g·cm-3(列计算式;1nm=10-9m)。
,1mol 该配合物形成的配位键有mol,配位原子是 , 碳原子的杂化类型有。 (4)、钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个型小立方体构成,其化学式为 , 晶体中Al3+占据O2-形成的(填 “四面体空隙”或 “八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为g·cm-3(列计算式;1nm=10-9m)。 28. 黄铜矿( )是炼铜的最主要矿物,在野外很容易被误认为黄金,故又称愚人金。(1)、基态 原子价层电子排布式为 , 其未成对电子数是。(2)、请判断沸点高低: (填写“>”或“<”)。 沸点低于 的原因是。(3)、S有多种价态的化合物。回答下列问题:
28. 黄铜矿( )是炼铜的最主要矿物,在野外很容易被误认为黄金,故又称愚人金。(1)、基态 原子价层电子排布式为 , 其未成对电子数是。(2)、请判断沸点高低: (填写“>”或“<”)。 沸点低于 的原因是。(3)、S有多种价态的化合物。回答下列问题:①下列关于气态 和 的说法中,正确的是。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
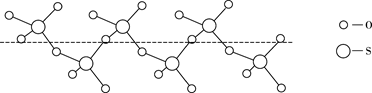
②将纯液态 冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图所示,此固态 中S原子的杂化轨道类型是。
③ 、 中S的化合价均为+6.与 互为等电子体的分子的化学式为 , 中过氧键的数目为。
(4)、 的晶胞如图所示,晶胞参数为a 、b 。 的晶胞中每个 原子与个S原子相连,晶体密度 (列出计算式即可,阿伏加德罗常数的数值为 )。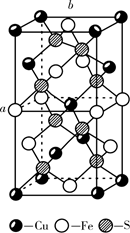 29. 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、化合物N2H4的电子式为。(2)、As原子的核外电子排布式为。(3)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是。(4)、NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是。(5)、Na3AsO4中含有的化学键类型包括;AsO43-空间构型为 , As4O6的分子结构如图所示,则在该化合物中As的杂化方式是。
29. 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、化合物N2H4的电子式为。(2)、As原子的核外电子排布式为。(3)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是。(4)、NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是。(5)、Na3AsO4中含有的化学键类型包括;AsO43-空间构型为 , As4O6的分子结构如图所示,则在该化合物中As的杂化方式是。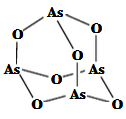 (6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1 , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为g·cm-3(用含NA、a的式子表示)。
(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1 , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为g·cm-3(用含NA、a的式子表示)。