云南省大理州祥云县2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-05-17 类型:期末考试
一、单选题
-
1. 化学与工农业生产和日常生活密切相关,下列说法正确的是( )A、漂白粉、漂白液和漂粉精既可作漂白剂,又可作消毒剂 B、硅胶可用作催化剂的载体,但不可用作干燥剂 C、常温下铝制容器可以盛放浓硫酸,是因为铝与浓硫酸不反应 D、明矾可作净水剂,是因为其溶于水电离出的Al3+具有强吸附性2. 下列相关微粒的化学用语正确的是( )A、中子数为14的铝原子: Al B、N2的结构式:N=N C、Na+的结构示意图:
 D、H2O的电子式:
D、H2O的电子式:  3. 下列各组混合物,能用分液漏斗进行分离的是( )A、汽油和植物油 B、水和四氯化碳 C、酒精和水 D、溴和四氯化碳4. 表示下列过程的离子方程式正确的是( )A、AgNO3溶液中加入铜片:Cu+2Ag+=Cu2++Ag B、等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O C、向氯化钙溶液中通入CO2气体:Ca2++H2O+CO2=CaCO3↓+2H+ D、Mg(OH)2与稀HNO3反应:OH-+H+=H2O5. 制备Fe3O4纳米颗粒的反应为 ,则下列说法正确的是( )A、该反应中的还原剂只有Fe2+ B、x=4 C、已知Fe3O4纳米颗粒直径为20nm,则Fe3O4纳米颗粒为胶体 D、每生成1molFe3O4 , 被 还原的O2为1mol6. 下列叙述中正确的是( )A、向含有 CaCO3沉淀的水中通入足量的CO2 , 沉淀不会溶解 B、向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶1 C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积不相同 D、分别向NaHCO3溶液和Na2CO3溶液中加入Ca(OH)2溶液,只有Na2CO3溶液产生沉淀7. 下列有关铁及其化合物的说法中正确的是( )A、除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、Fe3O4为红棕色晶体 D、Fe(OH)2和Fe(OH)3都能在空气中稳定存在8. 下列物质中,既含有离子键又含有极性共价键的是( )A、 B、 C、 D、9. 下列对有机物的描述错误的是( )A、淀粉的特征反应是在常温下遇碘化钾溶液变蓝 B、用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯,可以达到水果保鲜的要求 C、在加热条件下葡萄糖可与新制的氢氧化铜反应,生成砖红色沉淀 D、硝酸可以使蛋白质变黄,称为蛋白质的颜色反应,常用来鉴别部分蛋白质10. 下列变化是物理变化的是( )A、煤的干馏 B、石油分馏 C、石油裂化 D、乙烯聚合11. X、Y、Z、W为原子序数依次增大的短周期元素。X与Y可组成一种红棕色有刺激性气味的气体;Z的周期数是族序数的3倍;工业上常用冷的烧碱溶液吸收W的单质制取漂白液。下列叙述中正确的是( )A、简单离子半径的大小顺序:Z>W B、最高价氧化物对应的水化物酸性:W>X C、常温常压下,X、Z、W的氢化物都为气体 D、Y和Z组成的化合物中,阴、阳离子数之比为1:112. 联合国大会宣布2019年是“国际化学元素周期表年”(I YPT 2019)·下列运用元素周期律分析的推断中,错误的是( )A、铍(Be)的氧化物的水化物具有两性 B、砹(At)为有色固体,AgAt感光性很强,不溶于水 C、硫酸锶(SrSO4)是难溶于水的白色固体 D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体13. 下列反应是吸热反应的是( )A、NaOH 和 HCl 反应 B、Zn和HCl反应 C、Ba(OH)2•H2O 和NH4Cl反应 D、CO燃烧14. 在 反应中,表示该反应速率最快的是( )A、 B、 C、 D、15. 将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论错误的是( )
3. 下列各组混合物,能用分液漏斗进行分离的是( )A、汽油和植物油 B、水和四氯化碳 C、酒精和水 D、溴和四氯化碳4. 表示下列过程的离子方程式正确的是( )A、AgNO3溶液中加入铜片:Cu+2Ag+=Cu2++Ag B、等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O C、向氯化钙溶液中通入CO2气体:Ca2++H2O+CO2=CaCO3↓+2H+ D、Mg(OH)2与稀HNO3反应:OH-+H+=H2O5. 制备Fe3O4纳米颗粒的反应为 ,则下列说法正确的是( )A、该反应中的还原剂只有Fe2+ B、x=4 C、已知Fe3O4纳米颗粒直径为20nm,则Fe3O4纳米颗粒为胶体 D、每生成1molFe3O4 , 被 还原的O2为1mol6. 下列叙述中正确的是( )A、向含有 CaCO3沉淀的水中通入足量的CO2 , 沉淀不会溶解 B、向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶1 C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积不相同 D、分别向NaHCO3溶液和Na2CO3溶液中加入Ca(OH)2溶液,只有Na2CO3溶液产生沉淀7. 下列有关铁及其化合物的说法中正确的是( )A、除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、Fe3O4为红棕色晶体 D、Fe(OH)2和Fe(OH)3都能在空气中稳定存在8. 下列物质中,既含有离子键又含有极性共价键的是( )A、 B、 C、 D、9. 下列对有机物的描述错误的是( )A、淀粉的特征反应是在常温下遇碘化钾溶液变蓝 B、用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯,可以达到水果保鲜的要求 C、在加热条件下葡萄糖可与新制的氢氧化铜反应,生成砖红色沉淀 D、硝酸可以使蛋白质变黄,称为蛋白质的颜色反应,常用来鉴别部分蛋白质10. 下列变化是物理变化的是( )A、煤的干馏 B、石油分馏 C、石油裂化 D、乙烯聚合11. X、Y、Z、W为原子序数依次增大的短周期元素。X与Y可组成一种红棕色有刺激性气味的气体;Z的周期数是族序数的3倍;工业上常用冷的烧碱溶液吸收W的单质制取漂白液。下列叙述中正确的是( )A、简单离子半径的大小顺序:Z>W B、最高价氧化物对应的水化物酸性:W>X C、常温常压下,X、Z、W的氢化物都为气体 D、Y和Z组成的化合物中,阴、阳离子数之比为1:112. 联合国大会宣布2019年是“国际化学元素周期表年”(I YPT 2019)·下列运用元素周期律分析的推断中,错误的是( )A、铍(Be)的氧化物的水化物具有两性 B、砹(At)为有色固体,AgAt感光性很强,不溶于水 C、硫酸锶(SrSO4)是难溶于水的白色固体 D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体13. 下列反应是吸热反应的是( )A、NaOH 和 HCl 反应 B、Zn和HCl反应 C、Ba(OH)2•H2O 和NH4Cl反应 D、CO燃烧14. 在 反应中,表示该反应速率最快的是( )A、 B、 C、 D、15. 将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论错误的是( ) A、O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体 B、b→c段产生氢气的速率增大较快的主要原因是温度升高 C、c时刻反应生成的H2的量最多 D、c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小16. 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A、O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体 B、b→c段产生氢气的速率增大较快的主要原因是温度升高 C、c时刻反应生成的H2的量最多 D、c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小16. 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( ) A、A是Zn,B是Cu,C为稀硫酸 B、A是Cu,B是Zn,C为稀硫酸 C、A是Fe,B是Ag,C为稀AgNO3溶液 D、A是Ag,B是Fe,C为稀AgNO3溶液17. SF6是一种优良的绝缘气体,分子结构中只存在S—F键。在反应S(s) + 3F2(g)=SF6(g)中每生成1 mol SFs(g)释放出1220 kJ热量,1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F键需吸收的能量为160 kJ,则断裂1mol S-F键需吸收的能量为( )A、500 kJ B、450 kJ C、430 kJ D、330 kJ18. 下列反应中,属于加成反应的是( )A、CH3CH=CH2+Br2 CH3CHBrCH2Br B、CH3CH2OH CH2=CH2↑+H2O C、CH3COOH+CH3OH CH3COOCH3+H2O D、
A、A是Zn,B是Cu,C为稀硫酸 B、A是Cu,B是Zn,C为稀硫酸 C、A是Fe,B是Ag,C为稀AgNO3溶液 D、A是Ag,B是Fe,C为稀AgNO3溶液17. SF6是一种优良的绝缘气体,分子结构中只存在S—F键。在反应S(s) + 3F2(g)=SF6(g)中每生成1 mol SFs(g)释放出1220 kJ热量,1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F键需吸收的能量为160 kJ,则断裂1mol S-F键需吸收的能量为( )A、500 kJ B、450 kJ C、430 kJ D、330 kJ18. 下列反应中,属于加成反应的是( )A、CH3CH=CH2+Br2 CH3CHBrCH2Br B、CH3CH2OH CH2=CH2↑+H2O C、CH3COOH+CH3OH CH3COOCH3+H2O D、 +HNO3
+HNO3  +H2O
19. 下列五种烷烃:① ② ③ ④ ⑤ ,其沸点按由高到低的顺序排列正确的是( )A、①⑤②③④ B、②③④⑤① C、⑤②①③④ D、④①②⑤③20. 下列试剂不能用来鉴别乙醇和乙酸的是( )A、酸性高锰酸钾溶液 B、碳酸钠溶液 C、紫色石蕊溶液 D、蒸馏水21. 实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是( )
+H2O
19. 下列五种烷烃:① ② ③ ④ ⑤ ,其沸点按由高到低的顺序排列正确的是( )A、①⑤②③④ B、②③④⑤① C、⑤②①③④ D、④①②⑤③20. 下列试剂不能用来鉴别乙醇和乙酸的是( )A、酸性高锰酸钾溶液 B、碳酸钠溶液 C、紫色石蕊溶液 D、蒸馏水21. 实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是( ) A、向甲试管中先加浓硫酸,再加乙醇和乙酸 B、乙试管中导管不伸入液面下,是为了防止倒吸 C、加入过量乙酸,可使乙醇完全转化为乙酸乙酯 D、实验完毕,可将乙酸乙酯从混合物中过滤出来22. 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
A、向甲试管中先加浓硫酸,再加乙醇和乙酸 B、乙试管中导管不伸入液面下,是为了防止倒吸 C、加入过量乙酸,可使乙醇完全转化为乙酸乙酯 D、实验完毕,可将乙酸乙酯从混合物中过滤出来22. 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )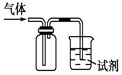
选项
试剂
现象
结论
A
酸性KMnO4溶液
溶液褪色
SO2有氧化性
B
品红溶液
溶液褪色
SO2有漂白性
C
NaOH溶液
无明显现象
SO2与NaOH溶液不反应
D
硫化氢水溶液
溶液变浑浊
SO2有还原性
A、A B、B C、C D、D23. 某有机物的结构为 ,这种有机物不可能具有的性质是( ) A、能跟NaOH溶液反应 B、能使酸性KMnO4溶液褪色 C、能发生酯化反应 D、能发生水解反应24. 下列关于金属冶炼的说法正确的是( )A、由于铝的金属性强,故工业上采用电解熔融AlCl3的方法生产单质铝 B、将钠投入氯化镁饱和溶液中,可置换出镁单质 C、根据金属的活泼性不同,采用不同的金属冶炼方法 D、铝热反应需要在高温下进行,是一个典型的吸热反应25. 利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( )
,这种有机物不可能具有的性质是( ) A、能跟NaOH溶液反应 B、能使酸性KMnO4溶液褪色 C、能发生酯化反应 D、能发生水解反应24. 下列关于金属冶炼的说法正确的是( )A、由于铝的金属性强,故工业上采用电解熔融AlCl3的方法生产单质铝 B、将钠投入氯化镁饱和溶液中,可置换出镁单质 C、根据金属的活泼性不同,采用不同的金属冶炼方法 D、铝热反应需要在高温下进行,是一个典型的吸热反应25. 利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( ) A、b极为正极,发生氧化反应 B、中间室的Na+向左室移动 C、用电器流过1 mol e-时,b电极产生标准状况2.24 L N2 D、a极的电极反应式为:C6H5OH+28e-+11H2O=6CO2↑+28H+
A、b极为正极,发生氧化反应 B、中间室的Na+向左室移动 C、用电器流过1 mol e-时,b电极产生标准状况2.24 L N2 D、a极的电极反应式为:C6H5OH+28e-+11H2O=6CO2↑+28H+二、综合题
-
26. 按要求回答问题:(1)、以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向极移动(填“正”或“负”)。
②电子流动方向由极流向极(填:“正”、“负”)。
③若有 1mol e- 流过导线,则理论上负极质量减少g。
④若将稀硫酸换成浓硝酸,负极电极方程式为:。
(2)、甲烷燃料电池是一种高效无污染的清洁电池,它用 KOH 做电解质。则负极反应方程式是。(3)、一定温度下,在容积为 2L 的密闭容器中进行反应:aN(g) bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的系数比为 a∶b∶c=。
②1 min 到 3 min 这段时刻,以 M 的浓度变化表示的平均反应速率为:。
③下列叙述中能说明上述反应达到平衡状态的是。
A.反应中当 M 与 N 的物质的量相等时
B.P 的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗 a mol N,同时消耗 b mol M
E 混合气体的压强不随时间的变化而变化F.M 的物质的量浓度保持不变
27. 海洋资源的利用具有广阔前景。(1)、下图是从海水中提取镁的简单流程:
①从悬浊液中将Mg(OH)2分离出来的操作名称为。
②Mg(OH)2转化为MgCl2的离子方程式是。
③由无水MgCl2制取Mg的化学方程式是。
(2)、海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
①灼烧所用仪器是下列中的哪一种(填字母序号)。
a. 蒸发皿
b. 坩埚
c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2 , 请写出该反应的离子方程式:。
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是(填字母序号)。
a. 乙酸
b. 四氯化碳
c. 硝酸
d. 苯
28. 下表是元素周期表的一部分:
根据要求回答下列问题:
(1)、十种元素中化学性质最不活泼的元素是(填元素符号,下同),形成化合物种类最多的元素是。(2)、A,C,D三种元素的最高价氧化物对应的水化物,其中碱性最强的是(填化学式,下同),E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是。(3)、I元素跟A元素形成化合物的电子式是。高温灼烧该化合物时,火焰呈色。(4)、分别写出B、G两种单质和水反应的离子方程式、。(5)、元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式:。29. 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题: (1)、丙的化学式为;从组成和性质上分析,丁属于(填“酸性”或“碱性”)氧化物。(2)、图中甲、乙、丁、戊中,属于电解质的是(填化学式);根据氯元素的化合价判断,乙物质。
(1)、丙的化学式为;从组成和性质上分析,丁属于(填“酸性”或“碱性”)氧化物。(2)、图中甲、乙、丁、戊中,属于电解质的是(填化学式);根据氯元素的化合价判断,乙物质。a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)、电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是。(4)、庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为。(5)、辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是。