湖南省张家界市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-05-17 类型:期末考试
一、单选题
-
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列四种能源:①天然气②太阳能 ③石油④风能,符合未来新能源标准的有( )A、①② B、②④ C、①③ D、③④2. 下列变化中,不属于化学变化的是( )A、煤的气化 B、石油的裂解 C、煤的干馏 D、石油的分馏3. 四种常见有机物的比例模型如图。下列说法错误的是 ( )
 A、甲能使酸性KMnO4溶液褪色 B、乙可与溴水发生加成反应 C、丙燃烧时能产生大量黑烟 D、丁的结构简式为CH3CH2OH4. 下列金属的冶炼原理中,属于热分解法的是( )A、2HgO 2Hg+O2 B、Fe3O4+4CO 3Fe+4CO2 C、Fe+CuSO4 =Cu+FeSO4 D、2NaCl(熔融) 2Na+Cl2↑5. 关于元素周期表的说法正确的( )A、元素周期表有8个主族 B、ⅠA族的元素全部是金属元素 C、元素周期表有7个周期 D、短周期是指第一、二周期6. 借助碱金属和卤族元素性质的递变性分析下面的推断,其中正确的是( )A、已知Ca是第四周期第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 B、已知As是第四周期第ⅤA族元素,故AsH3的稳定性比NH3的稳定性强 C、已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 D、已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大7. 朝核问题是全球关注的热点之一,已知 是一种重要的核工业原料,下列有关 说法正确的是( )A、 原子核中含有92个中子 B、 与 互为同位素 C、 原子核外有143个电子 D、 的摩尔质量为2358. 下面是用电子式表示某些物质的形成过程,其中正确的是( )A、
A、甲能使酸性KMnO4溶液褪色 B、乙可与溴水发生加成反应 C、丙燃烧时能产生大量黑烟 D、丁的结构简式为CH3CH2OH4. 下列金属的冶炼原理中,属于热分解法的是( )A、2HgO 2Hg+O2 B、Fe3O4+4CO 3Fe+4CO2 C、Fe+CuSO4 =Cu+FeSO4 D、2NaCl(熔融) 2Na+Cl2↑5. 关于元素周期表的说法正确的( )A、元素周期表有8个主族 B、ⅠA族的元素全部是金属元素 C、元素周期表有7个周期 D、短周期是指第一、二周期6. 借助碱金属和卤族元素性质的递变性分析下面的推断,其中正确的是( )A、已知Ca是第四周期第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 B、已知As是第四周期第ⅤA族元素,故AsH3的稳定性比NH3的稳定性强 C、已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 D、已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大7. 朝核问题是全球关注的热点之一,已知 是一种重要的核工业原料,下列有关 说法正确的是( )A、 原子核中含有92个中子 B、 与 互为同位素 C、 原子核外有143个电子 D、 的摩尔质量为2358. 下面是用电子式表示某些物质的形成过程,其中正确的是( )A、 B、
B、 C、
C、 D、
D、 9. 下列物质中,含非极性共价键的化合物是( )A、MgCl2 B、Na2O2 C、O2 D、NaOH10. 下列各反应中,符合如图所示能量变化的是( )
9. 下列物质中,含非极性共价键的化合物是( )A、MgCl2 B、Na2O2 C、O2 D、NaOH10. 下列各反应中,符合如图所示能量变化的是( ) A、HCl和NaOH的反应 B、Al和盐酸的反应 C、甲烷在氧气中的燃烧反应 D、Ba(OH)2·8H2O和NH4Cl的反应11. 燃料电池广泛应用于航天飞机。以30%KOH溶液为电解质溶液的这种电池,在使用时的电极反应如下:H2+2OH--2e-=2H2O,O2+2H2O+4e-=4OH-。据此判断下列说法中正确的是( )A、H2在正极发生氧化反应 B、供电时的总反应为:2H2+O2=2H2O C、燃料电池是将燃料燃烧时释放出的热能直接转化为电能 D、燃料电池的电极一定是由两种活泼性不同的金属组成12. 在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用N2表示的平均反应速率为0.15mol/(L·s)。则反应所经过的时间是( )A、2s B、2 min C、3s D、3 min13. 苯是重要的化工原料,关于苯的结构和性质叙述中,下列说法正确的是( )A、苯分子中含有碳碳双键 B、苯不能与溴发生取代反应 C、苯难溶于水,与水混合分层 D、苯能使KMnO4溶液褪色14. 下图是可逆反应X2+ 3Y2 2Z2在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
A、HCl和NaOH的反应 B、Al和盐酸的反应 C、甲烷在氧气中的燃烧反应 D、Ba(OH)2·8H2O和NH4Cl的反应11. 燃料电池广泛应用于航天飞机。以30%KOH溶液为电解质溶液的这种电池,在使用时的电极反应如下:H2+2OH--2e-=2H2O,O2+2H2O+4e-=4OH-。据此判断下列说法中正确的是( )A、H2在正极发生氧化反应 B、供电时的总反应为:2H2+O2=2H2O C、燃料电池是将燃料燃烧时释放出的热能直接转化为电能 D、燃料电池的电极一定是由两种活泼性不同的金属组成12. 在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用N2表示的平均反应速率为0.15mol/(L·s)。则反应所经过的时间是( )A、2s B、2 min C、3s D、3 min13. 苯是重要的化工原料,关于苯的结构和性质叙述中,下列说法正确的是( )A、苯分子中含有碳碳双键 B、苯不能与溴发生取代反应 C、苯难溶于水,与水混合分层 D、苯能使KMnO4溶液褪色14. 下图是可逆反应X2+ 3Y2 2Z2在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( ) A、t1时,只有正方向反应 B、t2时,反应到达限度 C、t2- t3 , 反应不再发生 D、t2- t3 , 各物质的浓度相等15. 将甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述错误的是( )
A、t1时,只有正方向反应 B、t2时,反应到达限度 C、t2- t3 , 反应不再发生 D、t2- t3 , 各物质的浓度相等15. 将甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述错误的是( ) A、该反应的生成物只有四种 B、该反应的条件是光照 C、该反应结束后量筒内液面上升(冷却到室温) D、该反应属于取代反应16. 下列物质互为同分异构体的一组是( )A、乙烯与乙烷 B、12C与14C C、CH3-CH2-CH2-CH2-CH3与
A、该反应的生成物只有四种 B、该反应的条件是光照 C、该反应结束后量筒内液面上升(冷却到室温) D、该反应属于取代反应16. 下列物质互为同分异构体的一组是( )A、乙烯与乙烷 B、12C与14C C、CH3-CH2-CH2-CH2-CH3与 D、
D、 和
和  17. 下列有机物分子中,所有碳原子不可能处于同一平面的是( )A、
17. 下列有机物分子中,所有碳原子不可能处于同一平面的是( )A、 B、CH3—CH2—CH3
C、
B、CH3—CH2—CH3
C、 D、
D、 18. 乙酸是生活中常见的有机物,其结构式如下图所示,下列关于乙酸的说法正确的是( )
18. 乙酸是生活中常见的有机物,其结构式如下图所示,下列关于乙酸的说法正确的是( ) A、乙酸与CaCO3反应,能证明酸性:乙酸﹥碳酸 B、乙酸与乙醇发生酯化反应是②键断裂 C、乙酸显酸性,发生电离是①键断裂 D、乙酸中的官能团是-COOH,叫羟基19. 下列实验中,没有颜色变化的是( )A、葡萄糖溶液与新制Cu(OH)2悬浊液混合加热 B、淀粉溶液中加入碘酒 C、鸡蛋清中加入浓硝酸 D、淀粉溶液中加入稀硫酸20. 已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论错误的是( )
A、乙酸与CaCO3反应,能证明酸性:乙酸﹥碳酸 B、乙酸与乙醇发生酯化反应是②键断裂 C、乙酸显酸性,发生电离是①键断裂 D、乙酸中的官能团是-COOH,叫羟基19. 下列实验中,没有颜色变化的是( )A、葡萄糖溶液与新制Cu(OH)2悬浊液混合加热 B、淀粉溶液中加入碘酒 C、鸡蛋清中加入浓硝酸 D、淀粉溶液中加入稀硫酸20. 已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论错误的是( ) A、反应速率υ(0-2min)﹥υ(2-4min)﹥υ(4-6min) B、反应前4min内温度对反应速率的影响比浓度大 C、若将锌粒改为锌粉,可加快产生H2的反应速率 D、反应前4min内生成H2的平均速率υ(H2)=0.09mol·L-1·min-121. 几种短周期元素的主要化合价及原子的原子半径数据见下表:
A、反应速率υ(0-2min)﹥υ(2-4min)﹥υ(4-6min) B、反应前4min内温度对反应速率的影响比浓度大 C、若将锌粒改为锌粉,可加快产生H2的反应速率 D、反应前4min内生成H2的平均速率υ(H2)=0.09mol·L-1·min-121. 几种短周期元素的主要化合价及原子的原子半径数据见下表:元素代号
L
M
Q
R
T
主要化合价
+2
+3
+6、﹣2
+7、﹣1
﹣2
原子半径/nm
0.160
0.143
0.102
0.099
0.074
据表中信息判断,下列有关叙述中,正确的是( )
A、常温下,将单质M投入到浓硝酸中,剧烈反应,产生大量红棕色气体。 B、常温下,M与T形成的化合物,易溶于水,且水溶液显碱性。 C、Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物。 D、M的氧化物既能和强酸又能和强碱反应,且产物不同。22. 一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为( )A、1.12L B、2.24L C、3.36L D、4.48L二、综合题
-
23. 现有下列四种物质a.葡萄糖b.乙醇 c.苹果汁d.油脂,请按下列要求填空(填代号):(1)、富含维生素 C 的是 ;(2)、可直接进入血液,补充能量的是;(3)、医药上常用作消毒剂,能有效杀灭2019-nCoV的是。(4)、工业上制备肥皂的主要原料是;24. 某兴趣小组用下图装置研究原电池的工作原理。
 (1)、甲中K断开时,装置中发生反应的离子方程式为;K闭合时,Cu棒上的现象为 , 外电路电流的方向由(填“Cu到Zn”或“Zn到Cu”)。(2)、乙图为氢氧燃料电池构造示意图,其中通入氧气的电极为电池的极(填“正”或负”),电极反应为。25. 下表列出了①~⑥六种元素在周期表中的位置:
(1)、甲中K断开时,装置中发生反应的离子方程式为;K闭合时,Cu棒上的现象为 , 外电路电流的方向由(填“Cu到Zn”或“Zn到Cu”)。(2)、乙图为氢氧燃料电池构造示意图,其中通入氧气的电极为电池的极(填“正”或负”),电极反应为。25. 下表列出了①~⑥六种元素在周期表中的位置:族
周期
IA
0
1
①
IIA
IIIA
IVA
VA
VIA
VIIA
2
②
③
④
3
⑤
⑥
(1)、画出元素⑤的原子结构示意图 ;(2)、写出元素⑤的最高价氧化物的水化物的电子式;(3)、②、③、⑥三种元素的非金属性由强到弱的顺序为(用元素符号表示);(4)、写出Cu与③的最高价氧化物的水化物稀溶液反应的离子方程式。26. 已知B的产量可以用来衡量一个国家的石油化工发展水平。A、B、C、D、E之间能进行如图所示的反应。 (1)、A的官能团的名称 , D的结构简式为。(2)、写出①发生的化学反应方程式。(3)、写出反应②的化学反应类型。(4)、下列关于化合物B的说法正确的是(填字母)。
(1)、A的官能团的名称 , D的结构简式为。(2)、写出①发生的化学反应方程式。(3)、写出反应②的化学反应类型。(4)、下列关于化合物B的说法正确的是(填字母)。a.B分子中所有原子都在同一平面上
b.B分子中不含官能团
c.B可以与Cl2发生加成反应
d.B不能使溴的四氯化碳溶液褪色
27. 某温度下,在密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。请回答下列问题: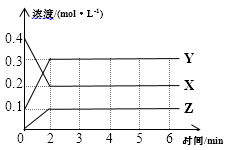 (1)、由图中数据分析:该反应的化学方程式为。(2)、反应开始至2min,X的平均反应速率为。(3)、不改变反应条件,3min至4min时Z的生成速率与5min至6min时Z的生成速率相比较,前者后者(填“大于”、“小于”或“等于”)。(4)、上述反应过程中,如果降低温度,则其反应速率(填“增大”、“减小”或“不变)。(5)、下列各项中不可以说明上述反应达到平衡的是(填字母)。
(1)、由图中数据分析:该反应的化学方程式为。(2)、反应开始至2min,X的平均反应速率为。(3)、不改变反应条件,3min至4min时Z的生成速率与5min至6min时Z的生成速率相比较,前者后者(填“大于”、“小于”或“等于”)。(4)、上述反应过程中,如果降低温度,则其反应速率(填“增大”、“减小”或“不变)。(5)、下列各项中不可以说明上述反应达到平衡的是(填字母)。a.X、Y、Z的反应速率之比为2∶2∶1
b.Y物质的物质的量保持不变
c.X的浓度保持不变
d.同一物质的正反应速率等于逆反应速率
e.消耗2mol X同时生成1mol Z
28. 某化学课外小组设计了如图所示的装置制取乙酸乙酯,回答下列问题: (1)、反应前加入三种药品(a.乙醇b.乙酸c.98%浓硫酸)的顺序是。
(1)、反应前加入三种药品(a.乙醇b.乙酸c.98%浓硫酸)的顺序是。a. abc b. cba c. bca d. acb
(2)、已知下列数据:乙醇
乙酸
乙酸乙酯
98%浓硫酸
熔点/℃
-117.3
16.6
-83.6
—
沸点/℃
78.5
117.9
77.5
338.0
资料:Ⅰ.温度高于140℃ 时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
Ⅱ.乙酸乙酯是无色透明液体,相对密度(水=1)为0.90,在水中会出现分层现象
①酯化反应的化学方程式为。
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是(填序号)。
a.T<77.5℃ b.T>140℃ c.105℃ <T<110℃
③欲分离出乙酸乙酯,应使用的分离方法是 (填操作方法名称)。
(3)、若实验所用乙酸的质量为6.0g,乙醇的质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是。