湖北省十堰市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-05-17 类型:期末考试
一、单选题
-
1. 从化学看生活,你认为下列说法合理的是( )A、绿色食品就是指颜色为绿色的食品 B、汽车尾气中的氮氧化物主要是汽油燃烧的产物 C、“煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾的形成 D、燃料电池是一种高效、环境友好型的发电装置,其能量转化率可达100%2. 下列物质中,属于只含有离子键的离子化合物的是( )A、CO2 B、Ca(OH)2 C、HF D、Na2O3. 下列是绿色制氢示意图,图示中未涉及的能量转化形式是( )
 A、风能→电能 B、化学能→电能 C、太阳能→电能 D、电能→化学能4. 欲加快铁片与稀硫酸的反应速率,下列措施不可行的是( )A、滴入适量的硫酸锌溶液 B、适当地增大硫酸的浓度 C、将铁片改成铁粉 D、升高温度5. 门捷列夫创制了元素周期表,并成功预言了11种元素,他利用的是元素的周期性变化规律,下列事实不能用元素周期律解释的是( )A、碱性:KOH>NaOH B、元素的金属性:Mg>Al C、元素的原子半径:S>Cl D、相对原子质量:Ar>K6. 下列过程属于化学变化的是( )A、海水的蒸馏 B、石油的分馏 C、煤的干馏 D、丁烷的液化7. 下列有机物属于烃的是( )A、淀粉[(C6H10O5)n] B、CH3CH(CH3)CH2CH2Br C、
A、风能→电能 B、化学能→电能 C、太阳能→电能 D、电能→化学能4. 欲加快铁片与稀硫酸的反应速率,下列措施不可行的是( )A、滴入适量的硫酸锌溶液 B、适当地增大硫酸的浓度 C、将铁片改成铁粉 D、升高温度5. 门捷列夫创制了元素周期表,并成功预言了11种元素,他利用的是元素的周期性变化规律,下列事实不能用元素周期律解释的是( )A、碱性:KOH>NaOH B、元素的金属性:Mg>Al C、元素的原子半径:S>Cl D、相对原子质量:Ar>K6. 下列过程属于化学变化的是( )A、海水的蒸馏 B、石油的分馏 C、煤的干馏 D、丁烷的液化7. 下列有机物属于烃的是( )A、淀粉[(C6H10O5)n] B、CH3CH(CH3)CH2CH2Br C、 D、
D、 8. 下列化学用语使用错误的是( )A、HClO的结构式:H-Cl-O B、MgCl2的电子式:
8. 下列化学用语使用错误的是( )A、HClO的结构式:H-Cl-O B、MgCl2的电子式: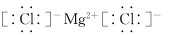 C、中子数为20的氯原子:37Cl
D、乙烷的球棍模型:
C、中子数为20的氯原子:37Cl
D、乙烷的球棍模型:  9. 历史上曾用羊皮银铜等作货币,目前世界上使用的货币有纸质货币、塑料(聚酯塑料)货币以及电子货币等。下列说法正确的是( )A、电子货币是由高纯硅等材料制成的货币 B、羊皮的主要成分为蛋白质 C、金属银和铜均可由其氧化物热分解得到 D、纤维素和聚酯塑料均是天然高分子10. 分子式为C4H9Cl 的同分异构体共有(不考虑立体异构)( )A、2种 B、3种 C、4种 D、5种11. H2(g)与ICl(g)的反应包含以下两步:
9. 历史上曾用羊皮银铜等作货币,目前世界上使用的货币有纸质货币、塑料(聚酯塑料)货币以及电子货币等。下列说法正确的是( )A、电子货币是由高纯硅等材料制成的货币 B、羊皮的主要成分为蛋白质 C、金属银和铜均可由其氧化物热分解得到 D、纤维素和聚酯塑料均是天然高分子10. 分子式为C4H9Cl 的同分异构体共有(不考虑立体异构)( )A、2种 B、3种 C、4种 D、5种11. H2(g)与ICl(g)的反应包含以下两步:I.H2(g)+ICl(g)=HCl(g)+HI(g),
II.HCl(g)+HI(g)+ICl(g)=I2(g)+2HCl(g)。反应过程中的能量变化曲线如图所示,下列有关说法错误的是( )
 A、反应I为吸热反应 B、反应II为放热反应 C、反应H2(g)+2ICl(g)=I2(g)+2HCl(g),每生成1molI2放出218kJ热量 D、反应I、II均为氧化还原反应12. 相同条件下,下列各有机物完全燃烧生成等体积的二氧化碳时消耗氧气的量最多的是( )A、CH3COOH B、C6H6 C、C2H5OH D、CH413. 由于锂电池的需求急剧增长,全球陷入锂资源“争夺战”。下列有关锂的说法正确的是( )A、Li的原子半径是第二周期所有主族元素中原子半径最小的 B、Li的金属性比钠强 C、Li、Cu及海水构成的电池中,Li为电池正极 D、电解LiCl熔盐可制取金属Li14. 下列关于食物中的基本营养物质的叙述错误的是( )A、葡萄糖和果糖都不能发生水解反应 B、油脂在酸性条件下的水解反应称为皂化反应 C、淀粉和纤维素都是天然高分子化合物 D、蛋白质在酶的催化作用下水解生成氨基酸15. 下列实验操作正确的是( )A、蒸发结晶时,用玻璃棒不断搅拌至溶液析出大量晶体,再用余热蒸干 B、除去 还原 时在玻璃管内壁产生的铜,先用稀盐酸溶解,再用水清洗 C、用洁净的铂丝蘸取食盐灼烧并直接观察火焰颜色,判断食盐中是否添加了 D、用分液漏斗分离苯萃取 后的混合液体时,先放出水层,再从下口放出有机层16. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、7.8g苯中含碳碳双键的数目为3NA B、5.8g正丁烷中含C-H的数目为NA C、1molCH4与1molCl2在光照下充分反应,生成CH3Cl的分子数为NA D、0.1mol乙酸与金属钠充分反应产生氢气的分子数为0.1NA17. 下列说法正确的是( )A、H2S的还原性和热稳定性都比HCl强 B、元素硅、锗都位于金属元素与非金属元素的交界处,其单质都可以用作半导体材料 C、若X+和Y—的核外电子层结构相同,则原子序数:Y>X D、同主族元素Ca和Ba分别位于第四周期和第六周期,碱性:Ca(OH)2>Ba(OH)218. CHClF2(二氟一氯甲烷)常用作制冷剂,可通过下列反应制得。下列说法错误的是( )
A、反应I为吸热反应 B、反应II为放热反应 C、反应H2(g)+2ICl(g)=I2(g)+2HCl(g),每生成1molI2放出218kJ热量 D、反应I、II均为氧化还原反应12. 相同条件下,下列各有机物完全燃烧生成等体积的二氧化碳时消耗氧气的量最多的是( )A、CH3COOH B、C6H6 C、C2H5OH D、CH413. 由于锂电池的需求急剧增长,全球陷入锂资源“争夺战”。下列有关锂的说法正确的是( )A、Li的原子半径是第二周期所有主族元素中原子半径最小的 B、Li的金属性比钠强 C、Li、Cu及海水构成的电池中,Li为电池正极 D、电解LiCl熔盐可制取金属Li14. 下列关于食物中的基本营养物质的叙述错误的是( )A、葡萄糖和果糖都不能发生水解反应 B、油脂在酸性条件下的水解反应称为皂化反应 C、淀粉和纤维素都是天然高分子化合物 D、蛋白质在酶的催化作用下水解生成氨基酸15. 下列实验操作正确的是( )A、蒸发结晶时,用玻璃棒不断搅拌至溶液析出大量晶体,再用余热蒸干 B、除去 还原 时在玻璃管内壁产生的铜,先用稀盐酸溶解,再用水清洗 C、用洁净的铂丝蘸取食盐灼烧并直接观察火焰颜色,判断食盐中是否添加了 D、用分液漏斗分离苯萃取 后的混合液体时,先放出水层,再从下口放出有机层16. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、7.8g苯中含碳碳双键的数目为3NA B、5.8g正丁烷中含C-H的数目为NA C、1molCH4与1molCl2在光照下充分反应,生成CH3Cl的分子数为NA D、0.1mol乙酸与金属钠充分反应产生氢气的分子数为0.1NA17. 下列说法正确的是( )A、H2S的还原性和热稳定性都比HCl强 B、元素硅、锗都位于金属元素与非金属元素的交界处,其单质都可以用作半导体材料 C、若X+和Y—的核外电子层结构相同,则原子序数:Y>X D、同主族元素Ca和Ba分别位于第四周期和第六周期,碱性:Ca(OH)2>Ba(OH)218. CHClF2(二氟一氯甲烷)常用作制冷剂,可通过下列反应制得。下列说法错误的是( )CHCl3+2HF
 CHClF2+2HClA、CHClF2分子中所有原子处于同一平面 B、该反应属于取代反应 C、CHClF2属于共价化合物 D、反应时最好用水浴加热19. 超高纯氢氟酸主要用来切割半导体基板芯片,是微电子行业制作过程中的关键性基础化工材料之一。下列说法正确的是( )A、 的热稳定性比 弱 B、氢氟酸的酸性比盐酸强 C、氢氟酸可以贮存在玻璃瓶中 D、 与 在暗处可化合为20. 实验室可用苯(沸点为80.1℃)与浓硝酸、浓硫酸组成的混酸反应制取硝基苯(难溶于水,不与酸或碱溶液反应,密度比水大,无色液体),装置如图所示,下列说法错误的是( )
CHClF2+2HClA、CHClF2分子中所有原子处于同一平面 B、该反应属于取代反应 C、CHClF2属于共价化合物 D、反应时最好用水浴加热19. 超高纯氢氟酸主要用来切割半导体基板芯片,是微电子行业制作过程中的关键性基础化工材料之一。下列说法正确的是( )A、 的热稳定性比 弱 B、氢氟酸的酸性比盐酸强 C、氢氟酸可以贮存在玻璃瓶中 D、 与 在暗处可化合为20. 实验室可用苯(沸点为80.1℃)与浓硝酸、浓硫酸组成的混酸反应制取硝基苯(难溶于水,不与酸或碱溶液反应,密度比水大,无色液体),装置如图所示,下列说法错误的是( ) A、配制混酸时,将浓硫酸慢慢加入浓硝酸中并不断搅拌 B、水浴加热时,一般用沸水浴 C、反应的化学方程式为
A、配制混酸时,将浓硫酸慢慢加入浓硝酸中并不断搅拌 B、水浴加热时,一般用沸水浴 C、反应的化学方程式为 +HO-NO2
+HO-NO2  +H2O
D、反应后纯化硝基苯,需经冷却、水洗、碱液洗、水洗、干燥及蒸馏
21. 海洋锰结核中含有大量锰、铁、铜、钴等金属元素,被公认为是一种重要的陆地矿产替代资源。已知铝、锰、锌、铁、钴(Co)、铜的金属活动性依次减弱。下列冶炼方法或反应不能达到制取对应金属单质目的的是( )A、3MnO2+4Al 3Mn+2Al2O3 B、3CO+Fe2O3 2Fe+3CO2 C、Cu2S+O2 2Cu+SO2 D、2Co2O3 4Co+3O2↑22. 往恒容密闭容器中通入amolNO2气体,在一定温度下分解生成O2和NO,各物质的浓度随时间的变化如图所示。下列说法错误的是( )
+H2O
D、反应后纯化硝基苯,需经冷却、水洗、碱液洗、水洗、干燥及蒸馏
21. 海洋锰结核中含有大量锰、铁、铜、钴等金属元素,被公认为是一种重要的陆地矿产替代资源。已知铝、锰、锌、铁、钴(Co)、铜的金属活动性依次减弱。下列冶炼方法或反应不能达到制取对应金属单质目的的是( )A、3MnO2+4Al 3Mn+2Al2O3 B、3CO+Fe2O3 2Fe+3CO2 C、Cu2S+O2 2Cu+SO2 D、2Co2O3 4Co+3O2↑22. 往恒容密闭容器中通入amolNO2气体,在一定温度下分解生成O2和NO,各物质的浓度随时间的变化如图所示。下列说法错误的是( ) A、X表示NO,Y表示O2 B、t1min时,NO2的正反应速率比逆反应速率大 C、t3min时,c(NO2)+c(NO)+c(O2)=1.5amol•L-1 D、t2min时,NO2在混合物中所占的物质的量分数为0.2523. 在绿色化学工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%。在用CH2=CH2合成CH3CH2COOCH3的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )A、CO和CH3OH B、CH3CH2OH和CO2 C、CO和CH4 D、H2和CO224. 金属燃料电池是一类重要的电池,其工作原理如图所示。下列说法正确的是( )
A、X表示NO,Y表示O2 B、t1min时,NO2的正反应速率比逆反应速率大 C、t3min时,c(NO2)+c(NO)+c(O2)=1.5amol•L-1 D、t2min时,NO2在混合物中所占的物质的量分数为0.2523. 在绿色化学工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%。在用CH2=CH2合成CH3CH2COOCH3的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )A、CO和CH3OH B、CH3CH2OH和CO2 C、CO和CH4 D、H2和CO224. 金属燃料电池是一类重要的电池,其工作原理如图所示。下列说法正确的是( ) A、正极上O2被氧化 B、蔗糖可作为电解质 C、电流由金属电极经导线流向空气电极 D、消耗相同质量的Zn、Al、Mg时,通过导线转移的电子数最多的是Al25. 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X最外层电子数之和为13,Y是同周期主族元素中半径最大的元素,Z的最外层电子数是Y的最外层电子数的3倍。下列说法错误的是( )A、原子半径: B、W的简单气态氢化物的热稳定性比X的强 C、W、X、Y、Z的简单离子的电子层结构均相同 D、Y、Z的最高价氧化物对应的水化物可在水溶液中发生反应
A、正极上O2被氧化 B、蔗糖可作为电解质 C、电流由金属电极经导线流向空气电极 D、消耗相同质量的Zn、Al、Mg时,通过导线转移的电子数最多的是Al25. 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X最外层电子数之和为13,Y是同周期主族元素中半径最大的元素,Z的最外层电子数是Y的最外层电子数的3倍。下列说法错误的是( )A、原子半径: B、W的简单气态氢化物的热稳定性比X的强 C、W、X、Y、Z的简单离子的电子层结构均相同 D、Y、Z的最高价氧化物对应的水化物可在水溶液中发生反应二、综合题
-
26. 香花石是1958年中国地质学家发现的第一种世界新矿物,其主要成分的化学式为Ca3Li2(BeSiO4)3F2。回答下列问题:(1)、质子数与中子数相等的Ca原子的符号为 , Ca2+的结构示意图为。(2)、Si位于元素周期表第周期族。(3)、香花石的主要成分的组成元素中,原子半径最小的是(填元素符号,下同),最大的是。(4)、用电子式表示CaO2(过氧化钙)的形成过程:。27. 氢氧燃料电池是符合绿色化学理念的新型燃料电池,其原理如图所示。
 (1)、通入的气体A是(填化学式)。(2)、通入气体B的电极上的反应式为。(3)、若总共消耗气体3.36L(标准状况下),则通过外电路的电子的物质的量为mol。(4)、若将此电池作为电源,电解熔融的氧化铝制备金属铝,理论上制备9g的金属铝,需消耗氢气的体积为L(标准状况下)。28. 乙二醇是重要的工艺原料,可由乙烯或合成气等为原料制备,部分合成方法如下:
(1)、通入的气体A是(填化学式)。(2)、通入气体B的电极上的反应式为。(3)、若总共消耗气体3.36L(标准状况下),则通过外电路的电子的物质的量为mol。(4)、若将此电池作为电源,电解熔融的氧化铝制备金属铝,理论上制备9g的金属铝,需消耗氢气的体积为L(标准状况下)。28. 乙二醇是重要的工艺原料,可由乙烯或合成气等为原料制备,部分合成方法如下:
回答下列问题:
(1)、A的化学名称为。(2)、E中官能团的名称为。(3)、C的分子式为。(4)、反应②的化学方程式为 , 该反应的反应类型为。(5)、W是C的同分异构体,1molW与足量NaHCO3反应可生成1molCO2 , 与足量金属钠反应可生成1molH2 , 则W的同分异构体有种(不考虑立体异构)。29. 海洋是一个巨大的化学资源宝库,下图是海水资源综合利用的部分流程图。 (1)、由海水提取的粗盐中常含有 等,可以加入(填化学式)除去。(2)、步骤①反应的离子方程式为。(3)、步骤②中溴单质被SO2还原为Br- , 硫元素被氧化为 ,从该反应原理中不能得出溴的非金属性强于硫,其原因是。(4)、步骤④为无水MgCl2电解制取金属镁的过程。若生成11.2L(标准状况下)Cl2 , 则消耗无水MgCl2的质量为g。30. 某化学课外活动小组设计了如图所示的装置(图中夹持装置未画出,“Δ”表示酒精灯热源)来研究乙醇催化氧化的实验。已知:无水乙醇的沸点为78℃,新制氢氧化铜悬浊液可用于验证乙醇催化氧化反应的氧化产物。
(1)、由海水提取的粗盐中常含有 等,可以加入(填化学式)除去。(2)、步骤①反应的离子方程式为。(3)、步骤②中溴单质被SO2还原为Br- , 硫元素被氧化为 ,从该反应原理中不能得出溴的非金属性强于硫,其原因是。(4)、步骤④为无水MgCl2电解制取金属镁的过程。若生成11.2L(标准状况下)Cl2 , 则消耗无水MgCl2的质量为g。30. 某化学课外活动小组设计了如图所示的装置(图中夹持装置未画出,“Δ”表示酒精灯热源)来研究乙醇催化氧化的实验。已知:无水乙醇的沸点为78℃,新制氢氧化铜悬浊液可用于验证乙醇催化氧化反应的氧化产物。 (1)、发生反应时,装置A中反应的还原剂是(填化学式,下同),D中反应的氧化剂是。(2)、装置B的作用是;装置C中热水的作用是。(3)、装置D中发生的氧化反应的化学方程式为。(4)、实验一段时间后,若撤掉装置D中的酒精灯,则反应(填“能”或“不能”)继续进行,原因是。31. 氨是化肥工业和基本有机化工的重要原料,合成氨反应是化学上最重要的反应之一
(1)、发生反应时,装置A中反应的还原剂是(填化学式,下同),D中反应的氧化剂是。(2)、装置B的作用是;装置C中热水的作用是。(3)、装置D中发生的氧化反应的化学方程式为。(4)、实验一段时间后,若撤掉装置D中的酒精灯,则反应(填“能”或“不能”)继续进行,原因是。31. 氨是化肥工业和基本有机化工的重要原料,合成氨反应是化学上最重要的反应之一 (1)、N2和H2在常温常压下反应极慢,为提高合成氨反应的速率,工业上除采取增大压强以提高浓度外,还可采取的措施是(答一条即可)(2)、已知反应N2(g)+3H2(g) 2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
(1)、N2和H2在常温常压下反应极慢,为提高合成氨反应的速率,工业上除采取增大压强以提高浓度外,还可采取的措施是(答一条即可)(2)、已知反应N2(g)+3H2(g) 2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示①图a中N点对应的时间是图b中的(填“t1”“t2”或“t3”)
②图b中,0~t1内平均速率v正(N2)=umol•L-1•min-1 , 则t1~t2内平均速率v正(N2)应(填标号)mol•L-1•min-1
A.大于u B.等于u C.小于u
(3)、往恒温恒容密闭容器中通入1molN2和3molH2 , 充分反应后,测得压强为起始时压强的75%,N2的转化率为。(4)、某兴趣小组同学设计了如图所示装置模拟工业上合成氨。
①流经橡胶管处的气体成分为(填化学式)
②能说明有氨生成的现象是。