湖北省荆门市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-05-17 类型:期末考试
一、单选题
-
1. 以“赏中华诗词、寻文化基因、品生活之美”为基本宗旨的《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析错误的是( )A、诗句“只要功夫深,铁杵磨成针”,该过程只涉及物理变化 B、庾信的《杨柳歌》“独忆飞絮鹅毛下,非复青丝马尾垂”从化学成分分析现实生活中“飞絮”“鹅毛”主要成分都是蛋白质 C、王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应 D、曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能2. 下列说法错误的是( )A、
 与
与  互称为同分异构体
B、淀粉与纤维素不属于同分异构体,也不属于同系物
C、煤的气化、液化都属于化学变化,石油分馏属于物理变化
D、从2019年7月1日起我国全面实施垃圾分类,提高废品回收率,以减少对环境的影响
3. 下列说法正确的是( )A、在由分子所构成的物质中,分子间作用力越大,该物质越稳定 B、冰融化时,水分子中H-O键发生断裂 C、离子的还原性: D、沸点:4. 下列有关化学用语正确的是( )A、次氯酸电子式:
互称为同分异构体
B、淀粉与纤维素不属于同分异构体,也不属于同系物
C、煤的气化、液化都属于化学变化,石油分馏属于物理变化
D、从2019年7月1日起我国全面实施垃圾分类,提高废品回收率,以减少对环境的影响
3. 下列说法正确的是( )A、在由分子所构成的物质中,分子间作用力越大,该物质越稳定 B、冰融化时,水分子中H-O键发生断裂 C、离子的还原性: D、沸点:4. 下列有关化学用语正确的是( )A、次氯酸电子式: B、乙醇的分子式:C2H5OH
C、用电子式表示氯化氢分子的形成过程:
B、乙醇的分子式:C2H5OH
C、用电子式表示氯化氢分子的形成过程:  D、CS2分子比例模型:
D、CS2分子比例模型:  5. 某反应由两步反应A B C构成,它的反应能量曲线如图,下列叙述正确的是( )
5. 某反应由两步反应A B C构成,它的反应能量曲线如图,下列叙述正确的是( )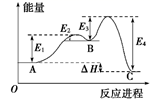 A、两步反应均为吸热反应 B、三种化合物中C最稳定 C、A与C的能量差为E4 D、A B反应,反应条件一定要加热6. 几种短周期元素的原子半径及主要化合价见下表:
A、两步反应均为吸热反应 B、三种化合物中C最稳定 C、A与C的能量差为E4 D、A B反应,反应条件一定要加热6. 几种短周期元素的原子半径及主要化合价见下表:元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.089
0.102
0.143
0.074
主要化合价
+2
+2
-2、+4、+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A、单质与稀硫酸反应的速率快慢:R>Y>X B、离子半径:X2+ >T2- C、元素最高价氧化物对应的水化物的碱性:Y > R >X D、相同条件下,气态氢化物的稳定性:T>Z7. 用A、B、C、D四块金属片进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。
据此,判断四种金属的活动性顺序是( )
A、A>B>C>D B、C>A>B>D C、A>C>D>B D、B>D>C>A8. 下列由相关实验现象所推断出的结论中,正确的是( )A、Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 B、加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华 C、Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明Fe与两种酸均发生置换反应 D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水9. 海洋约占地球表面积的71%,其开发利用的部分流程如图所示。下列说法错误的是( )
①试剂1可以选用NaOH溶液
②从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=2Cl-+Br2
③工业上,电解熔融MgO冶炼金属镁可减小能耗
④制铝:工业上电解熔融氯化铝来制备铝
⑤制钠:电解饱和NaCl溶液来制备钠
⑥炼铁:用CO在高温下还原铁矿石中的铁
A、①③④⑥ B、②③④⑥ C、①②③⑤ D、①③④⑤10. 为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )选项
①
②
③
④
被提纯物质
乙醇(水)
乙醇(乙酸)
乙烷(乙烯)
溴苯(溴)
除杂试剂
生石灰
氢氧化钠溶液
酸性高锰酸钾溶液
KI溶液
分离方法
蒸馏
分液
洗气
分液
A、① B、② C、③ D、④11. 关于反应4Li+2SOCl2=4LiCl+S+SO2↑的叙述正确的是( )A、SOCl2既是氧化剂又是还原剂 B、该反应可在水溶液中进行 C、若生成1molSO2 , 转移8mole- D、若将该反应设计成原电池,SOCl2在正极上发生反应12. 短周期主族元素A、B、X、Y的原子序数依次增大,A、B、X、Y原子的最外层电子数之和为18,A原子的最外层电子数是其内层电子数的2倍,X2+与B2-具有相同的电子层结构。下列说法正确的是( )A、单质的沸点:B>X B、B、X、Y的原子半径大小顺序为:X>Y>B C、A的最高价氧化物对应的水化物的酸性强于Y的 D、B分别与X、Y形成的化合物中化学键类型相同13. 化学与科技、社会、环境密切相关。下列有关说法正确的是( )A、pH小于7的雨水被称为酸雨 B、明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 C、推广使用燃煤脱硫技术,主要是为了防治SO2污染 D、PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小可吸入颗粒物,其与空气形成的分散系属于胶体14. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
向蔗糖中加入浓硫酸
蔗糖变黑,并放出刺激性气味的气体
浓硫酸具有脱水性和强氧化性
D
将铜片放入浓硫酸中
无明显现象
铜片发生了钝化
A、A B、B C、C D、D15. 在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是( )A、10秒时,用O2表示该反应的平均反应速率为0.01 mol/(L·s) B、当反应达平衡时,SO3的物质的量可能为0.4 mol C、当SO2和O2的生成速率之比为2:1时,达到该反应限度 D、向容器内充入SO2 , 可以提高反应速率二、综合题
-
16. 下表是元素周期表的一部分,用化学用语回答下列问题:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
①
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩
4
(1)、请画出元素⑨阴离子的结构示意图:。(2)、②⑥⑦的原子半径由大到小的顺序为(填元素符号)。(3)、①-⑨号元素中元素的最高价氧化物对应的水化物中酸性最强的是 , 碱性最强的是 , ③ 、⑧两种元素的最简单氢化物的熔点较高的是(均用化学式表示)。(4)、③⑤两种元素的原子按1:1组成的常见化合物的电子式为;元素⑤的最高价氧化物对应水化物中含有的化学键类型为。(5)、欲比较③和⑧两种元素的非金属性强弱,可以作为验证的证据是(填字母)。A 比较这两种元素单质的沸点
B 比较这两种元素单质与氢气化合的难易
C 比较这两种元素的最高价氧化物对应水化物的酸性
(6)、⑨单质与水反应的离子方程式为。17. 反应:aA(g)+bB(g) cC(g)在恒温恒容条件下进行,各物质的浓度随时间变化的曲线如图所示。

(1)、该反应的化学方程式中,a:b:c为。(2)、反应从起始至20min内,A的平均反应速率v (A)=。平衡时B的体积分数为。(3)、判断该反应是否达到平衡的依据为(填字母)。
(1)、该反应的化学方程式中,a:b:c为。(2)、反应从起始至20min内,A的平均反应速率v (A)=。平衡时B的体积分数为。(3)、判断该反应是否达到平衡的依据为(填字母)。A 压强不随时间改变
B A的物质的量分数不随时间改变
C 气体的密度不随时间改变
D 单位时间内消耗A和B的物质的量相等
(4)、下列措施能增大反应速率的是(填字母)。A 升高温度 B 降低压强 C 减小C的浓度 D 加入合适的催化剂
(5)、N点的正反应速率v正(C)(填“大于”“小于”或“等于”)M点的逆反应速率v逆(C)。18. 已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,它们之间有如图转化关系,请回答下列问题: (1)、写出D中官能团的名称 , B中官能团的电子式。(2)、在F的同系物中最简单的有机物的空间构型为。(3)、A的结构式为。(4)、反应①、⑥的反应类型分别是 , 。(5)、实验室中用于鉴别乙烯和乙烷的试剂可选用(填序号)。
(1)、写出D中官能团的名称 , B中官能团的电子式。(2)、在F的同系物中最简单的有机物的空间构型为。(3)、A的结构式为。(4)、反应①、⑥的反应类型分别是 , 。(5)、实验室中用于鉴别乙烯和乙烷的试剂可选用(填序号)。A 水 B 溴的四氯化碳溶液 C 氢气 D 酸性高锰酸钾溶液
(6)、写出下列编号对应反应的化学方程式:④⑦
19.(1)、目前海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,有关海洋中部分资源的利用如图所示,回答下列问题:
①实验室制取淡水常用的操作①是 , 操作②使用的玻璃仪器除了烧杯和玻璃棒之外必不可少的是。
②向含I-的溶液中加入试剂X的目的是使I-被氧化成I2 , 若X为硫酸酸化的H2O2溶液,写出该反应的离子方程式。
③下述物质中不可做试剂Y的是(填序号)
A 苯 B 乙醇 C 乙酸 D 四氯化碳
④我国从海水中直接获得的精盐还常常要添加(填序号)来预防地方甲状腺肿。
A 碘酸钾 B 碘单质 C 氯化钾
(2)、氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O 2H2↑+O2↑。制得的氢气可用于燃料电池。①分解海水的反应属于(填“放热”或“吸热”)反应,该化学反应中的氧气、氢气的总能量(填“>”、“=”或“<”)水的总能量。
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-=2H2O B极:O2+4e-=2O2-
B极是电池的极,电子从该极(填“流入”或“流出”)。当消耗标况下氢气33.6L时,则导线中转移电子的物质的量为mol。
20. 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。(1)、他们设计如图实验装置,请你参与探究,并回答问题:
①装置A用于验证SO2的漂白性,其中所盛试剂名称为;装置B观察到的现象为 , 装置C反应的离子方程式为。
②实验时,向装有铜片的试管中加入50mL浓硫酸并加热,反应一段时间,共收集到2.24L(标准状况)的SO2 , 将反应后的混合物先稀释,再加入足量锌粉,放出15.68L(标准状况)的H2 , 则原浓硫酸的物质的量浓度为 , 反应消耗锌粉的质量为。
③另一实验小组同学欲用装置乙代替装置甲,写出装置乙中产生气体的化学方程式。你认为装置乙的优点是(任写一点)。
(2)、装置D的作用是。