湖北省十堰市2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2021-05-17 类型:期末考试
一、单选题
-
1. 化学是一门从分子、原子层次上研究物质的性质、组成、结构与变化规律的自然学科。下列说法错误的是( )A、化学的特征就是认识分子和制造分子,具有创造性和实用性 B、制陶、冶金及酿酒的过程中.都一定发生了化学变化 C、随着先进仪器的不断使用,研究化学已不再需要通过实验方法 D、化学家可以在微观层面上操纵分子和原子,组装分子器件和分子机器等2. 下列烷烃的系统命名正确的是( )A、1-甲基丁烷 B、2,3-甲基丁烷 C、3-甲基丁烷 D、3-乙基戊烷3. 下列物质中一定互为同系物的是( )A、C2H4与C3H6 B、
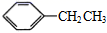 与
与  C、CH3CH2OH与CH3CH2OCH3
D、HCHO与CH3(CH2)4CHO
4. 下列化学用语错误的是( )A、乙烯的结构简式CH2=CH2 B、Fe2+的价层电子排布式:3d54s1 C、丙烷分子的球棍模型:
C、CH3CH2OH与CH3CH2OCH3
D、HCHO与CH3(CH2)4CHO
4. 下列化学用语错误的是( )A、乙烯的结构简式CH2=CH2 B、Fe2+的价层电子排布式:3d54s1 C、丙烷分子的球棍模型: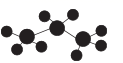 D、镁原子的核外电子排布图:
D、镁原子的核外电子排布图:  5. 相同质量的下列各烃,完全燃烧后生成CO2最多的是( )A、甲烷 B、乙烷 C、乙烯 D、乙炔6. 下列晶体中分类正确的一组是( )
5. 相同质量的下列各烃,完全燃烧后生成CO2最多的是( )A、甲烷 B、乙烷 C、乙烯 D、乙炔6. 下列晶体中分类正确的一组是( )选项
离子晶体
共价晶体
分子晶体
A
B
C
干冰
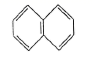
D
金刚石
玻璃
A、A B、B C、C D、D7. 若将基态6C的电子排布式写成1s22s22p2x , 它违背了( )A、能量守恒原理 B、泡利原理 C、能量最低原理 D、洪特规则8. 化学与生活有着密切的联系,下列说法正确的是( )A、米酒酿制过程中未涉及氧化还原反应 B、淀粉和纤维素互为同分异构体 C、在温水中,加酶洗衣粉的洗涤效果更佳 D、纤维都是天然高分子化合物9. 下列对1-氯丙烷和2-氯丙烷分别与NaOH的乙醇溶液共热的反应描述正确的是( )A、都是取代反应 B、两者产物不同 C、碳氢键断裂的位置相同 D、两者产物均能使溴水褪色10. 青藏高原上的铜矿探索、半导体照明产业化、文物保护、大型二氧化氯制备系统及纸浆无元素氯漂白等关键技术或应用直接面向国家重大需求。这些致力于服务百姓美好生活的科技成果斩获了2019年多项国家科学技术大奖。下列有关认识错误的是( )A、古代的青铜器、现代的铜质奖牌,都是纯铜 B、半导体照明具有高效、节能、环保等显著特点,是实现节能减排的有效途径 C、生态环境的保护和环境污染的防治对保护文物至关重要 D、二氧化氯属无毒型消毒剂,可用于水果、蔬菜的杀菌11. 短周期元素 在元素周期表中的位置如图,元素 的焰色反应为紫色。下列说法正确的是( ) A、 的沸点比 的高 B、 形成的化合物的水溶液呈碱性 C、 与 形成的化合物中一定不含共价键 D、 分别与 形成的化合物中, 的化合价相同12. 下列现象与氢键无关的是( )A、NH3的熔、沸点比PH3的高 B、NH3分子加热难分解 C、冰的密度比液态水的密度小 D、小分子的醇、羧酸可以和水以任意比例互溶13. 设NA为阿伏加德罗常数的值下列说法正确的是( )A、0.1mol羟基中含有的电子总数为NA B、22.4L(标准状况)丁烷完全裂解,生成乙烯分子的数目为NA C、0.1molCO(NH2)2完全燃烧生成N2、CO2和H2O转移的电子数为0.6NA D、0.1mol乙酸乙酯在稀硫酸催化下充分水解.生成乙醇分子的数目为0.1NA14. 下列化合物在水中的溶解度,排列次序正确的是( )
A、 的沸点比 的高 B、 形成的化合物的水溶液呈碱性 C、 与 形成的化合物中一定不含共价键 D、 分别与 形成的化合物中, 的化合价相同12. 下列现象与氢键无关的是( )A、NH3的熔、沸点比PH3的高 B、NH3分子加热难分解 C、冰的密度比液态水的密度小 D、小分子的醇、羧酸可以和水以任意比例互溶13. 设NA为阿伏加德罗常数的值下列说法正确的是( )A、0.1mol羟基中含有的电子总数为NA B、22.4L(标准状况)丁烷完全裂解,生成乙烯分子的数目为NA C、0.1molCO(NH2)2完全燃烧生成N2、CO2和H2O转移的电子数为0.6NA D、0.1mol乙酸乙酯在稀硫酸催化下充分水解.生成乙醇分子的数目为0.1NA14. 下列化合物在水中的溶解度,排列次序正确的是( )a. HOCH2CH2OH b. CH3CH2CH2OH c. CH3CH2COOCH3 d. HOCH2CH(OH)CH2OH
A、d>b>c>a B、c>d>a>b C、c>d>b>a D、d>a>b>c15. 下列离子组在指定溶液中能大量共存的是( )A、FeCl2溶液中:H+、 、 B、pH=1的溶液中:K+、Br-、ClO- C、KI溶液中:Mg2+、Fe3+ 、Cl- D、中性溶液中: 、Cl-、Na+16. 合成橡胶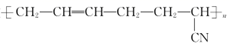 ,是由两种单体共聚而成的,该聚合物的单体是( ) A、CH3-CH=CH2和CH3-CH=CH-CN B、CH2=CH-CH=CH2和CH2=CH-CN C、CH3-C≡C-CH3和CH2=CH-CN D、CH3-CH=CH-CH3和CH2=CH-CN17. 下列不能形成配位键的组合的是( )A、Cu2+、NH3 B、BF3、NH3 C、CH4、Ag+ D、Co3+、CO18. 下列叙述错误的是( )A、人的皮肤在强紫外线的照射下会被灼伤 B、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 C、棉花和木材的主要成分都是纤维素.蚕丝和蜘蛛丝的主要成分都是蛋白质 D、蜂蚁叮咬人的皮肤时会将分泌物甲酸注入人体.此时可在患处涂抹小苏打溶液19. 下列说法错误的是( )A、每一个能层中电子的填充顺序都为ns→np→nd→nf B、用n表示电子层数,则每个电子层最多可容纳的电子数为2n2 C、元素周期表中,p区所含元素种类最多 D、电子的运动状态可从电子层、能级、原子轨道、电子的自旋状态四个方面进行描述20. 某羧酸酯的分子式为 , 该酯完全水解可得到 羧酸和 丙醇,该羧酸的结构有( )A、4种 B、5种 C、6种 D、7种21. 四种元素基态原子的电子排布式如下:① ;② ;③ ;④ 。下列有关比较中正确的是( )A、第一电离能:④>③>②>① B、原子半径:④>③>①>② C、电负性:③>④>①>② D、最高正化合价:④=①>③=②22. 下列反应方程式书写正确的是( )A、用对苯二甲酸与乙二醇合成涤纶:n
,是由两种单体共聚而成的,该聚合物的单体是( ) A、CH3-CH=CH2和CH3-CH=CH-CN B、CH2=CH-CH=CH2和CH2=CH-CN C、CH3-C≡C-CH3和CH2=CH-CN D、CH3-CH=CH-CH3和CH2=CH-CN17. 下列不能形成配位键的组合的是( )A、Cu2+、NH3 B、BF3、NH3 C、CH4、Ag+ D、Co3+、CO18. 下列叙述错误的是( )A、人的皮肤在强紫外线的照射下会被灼伤 B、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 C、棉花和木材的主要成分都是纤维素.蚕丝和蜘蛛丝的主要成分都是蛋白质 D、蜂蚁叮咬人的皮肤时会将分泌物甲酸注入人体.此时可在患处涂抹小苏打溶液19. 下列说法错误的是( )A、每一个能层中电子的填充顺序都为ns→np→nd→nf B、用n表示电子层数,则每个电子层最多可容纳的电子数为2n2 C、元素周期表中,p区所含元素种类最多 D、电子的运动状态可从电子层、能级、原子轨道、电子的自旋状态四个方面进行描述20. 某羧酸酯的分子式为 , 该酯完全水解可得到 羧酸和 丙醇,该羧酸的结构有( )A、4种 B、5种 C、6种 D、7种21. 四种元素基态原子的电子排布式如下:① ;② ;③ ;④ 。下列有关比较中正确的是( )A、第一电离能:④>③>②>① B、原子半径:④>③>①>② C、电负性:③>④>①>② D、最高正化合价:④=①>③=②22. 下列反应方程式书写正确的是( )A、用对苯二甲酸与乙二醇合成涤纶:n +n
+n 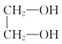
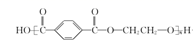 +2nH2O
B、用银氨溶液检验葡萄糖中的醛基:CH2OH(CHOH)4CHO+2 +2OH- CH2OH(CHOH)4COO-+ +3NH3+2Ag↓+H2O
C、麦芽糖在稀硫酸催化作用下发生水解C12H22O11:(麦芽糖)+H2O C6H12O6(萄萄糖)+ C6H12O6(果糖)
D、由丙烯合成聚丙烯:nCH2=CHCH3
+2nH2O
B、用银氨溶液检验葡萄糖中的醛基:CH2OH(CHOH)4CHO+2 +2OH- CH2OH(CHOH)4COO-+ +3NH3+2Ag↓+H2O
C、麦芽糖在稀硫酸催化作用下发生水解C12H22O11:(麦芽糖)+H2O C6H12O6(萄萄糖)+ C6H12O6(果糖)
D、由丙烯合成聚丙烯:nCH2=CHCH3  23. 氯仿常因保存不慎而被氧化、产生剧毒物光气(COCl2),反应为2CHCl3+O2 2HCl+2COCl2 , 光气的结构式为
23. 氯仿常因保存不慎而被氧化、产生剧毒物光气(COCl2),反应为2CHCl3+O2 2HCl+2COCl2 , 光气的结构式为 ,下列说法正确的是( ) A、COCl2分子中所有原子的最外层都满足8电子稳定结构 B、CHCl3分子中含有4个σ键,中心C原子采用sp2杂化 C、COCl2分子为含极性键的非极性分子 D、CHCl3为正四面体结构24. 实验室经常利用KMnO4来检验产物或验证性质,图示为部分装置图,下列说法错误的是( )
,下列说法正确的是( ) A、COCl2分子中所有原子的最外层都满足8电子稳定结构 B、CHCl3分子中含有4个σ键,中心C原子采用sp2杂化 C、COCl2分子为含极性键的非极性分子 D、CHCl3为正四面体结构24. 实验室经常利用KMnO4来检验产物或验证性质,图示为部分装置图,下列说法错误的是( )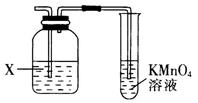 A、若X为NaOH溶液时,则KMnO4可用于溴乙烷发生消去反应的产物检验 B、若X为NaOH溶液时,则KMnO4可用于乙醇发生消去反应的产物检验 C、若X为CuSO4溶液时,则KMnO4可用于实验室制取乙炔时验证其性质 D、若X为溴水,则KMnO4可用于乙醛发生还原反应的产物检验25. 储氢合金是一类能够大性吸收氢气,并与氢气结合成金属氢化物的材料,如镧(La)镍(Ni)合金.它吸收氢气可结合成金属氢化物。某镧镍储氢合金晶胞结构如图.该材料中La、Ni、H2的粒子个数比为( )
A、若X为NaOH溶液时,则KMnO4可用于溴乙烷发生消去反应的产物检验 B、若X为NaOH溶液时,则KMnO4可用于乙醇发生消去反应的产物检验 C、若X为CuSO4溶液时,则KMnO4可用于实验室制取乙炔时验证其性质 D、若X为溴水,则KMnO4可用于乙醛发生还原反应的产物检验25. 储氢合金是一类能够大性吸收氢气,并与氢气结合成金属氢化物的材料,如镧(La)镍(Ni)合金.它吸收氢气可结合成金属氢化物。某镧镍储氢合金晶胞结构如图.该材料中La、Ni、H2的粒子个数比为( )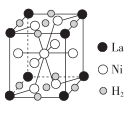 A、8:9:10 B、1:5:6 C、1:5:3 D、1:5:5
A、8:9:10 B、1:5:6 C、1:5:3 D、1:5:5二、综合题
-
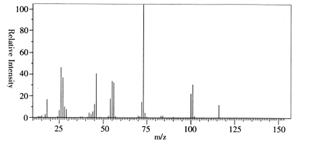
26. 某含C、H、O三种元素的未知物A,现对A进行分析探究。(1)、经燃烧分析实验测定,该未知物中碳的质量分数为41.38%,氢的质量分数为3.45%,则A的实验式为。(2)、利用质谱法测定A的相对分子质量,其质谱图如下,则A的分子式为。
 (3)、A的红外光谱图如下,分析该图得出A中含2种官能团,官能团的名称是、。
(3)、A的红外光谱图如下,分析该图得出A中含2种官能团,官能团的名称是、。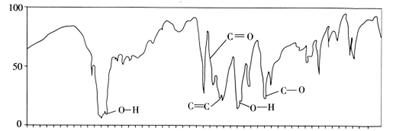 (4)、A的核磁共振氢谱图如下,综合分析A的结构简式为。
(4)、A的核磁共振氢谱图如下,综合分析A的结构简式为。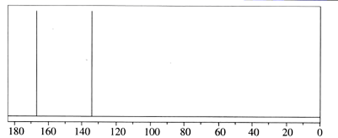 27. 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。(1)、氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=(用含(a、b、c的代数式表示)kJ•mol-1。(2)、研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
27. 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。(1)、氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=(用含(a、b、c的代数式表示)kJ•mol-1。(2)、研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。催化剂
Ru
Rh
Ni
Pt
Pd
Fe
初始速率
7.9
4.0
3.0
2.2
1.8
0.5
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)、关于合成氨工艺的理解,下列说法错误的是____________(填字母)。A、合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源 B、使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率 C、合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高(4)、电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。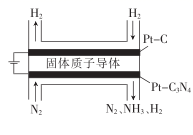
①Pt—C3N4 , 电极上产生NH3的电极反应式为。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:。
28. Q、X、Y、Z、W五种元素的原子序数依次增大.Y、Z、W的核外电子数成等差数列。已知①Q原子的最外层电子数是次外层电子数的2倍;②Y、Z同主族,Y原子的价电子排布图为 。
。 请回答下列问题:
(1)、基态Z原子的电子排布式为。(2)、以上五种元素中有一种元素不在周期表的p区、该元素的名称为。(3)、Q、X、Y三种元素的第一电离能按由大到小的顺序是(填元素符号,下同),电负性由大到小的顺序为。29. 世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有关于炼锌技术的记载。回答下列问题(1)、硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。①配合物[Zn(NH3)4]SO4中,[Zn(NH3)4]2+的名称是。
② 中,中心原子的轨道杂化类型为。
③NH3极易溶于水,除了因为它们都是极性分子外还因为。
(2)、Zn2+的4s和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间构型为。(3)、氧化锌的结构有多种,其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加德罗常数的值则立方闪锌矿晶体的密度为g•cm-3。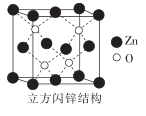 30. 磷酸氯喹是一种抗疟疾的药物,已在临床上使用多年。同时临床上还发现它对新冠肺炎有一定疗效,且未发现和药物有关的严重不良反应。
30. 磷酸氯喹是一种抗疟疾的药物,已在临床上使用多年。同时临床上还发现它对新冠肺炎有一定疗效,且未发现和药物有关的严重不良反应。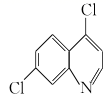 是合成磷酸氯喹的中间体,可由苯在一定条件下合成,具合成路线如下:
是合成磷酸氯喹的中间体,可由苯在一定条件下合成,具合成路线如下: 
已知:
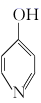 +NaOH
+NaOH 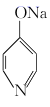 +H2O
+H2O回答下列问题
(1)、E中含氧官能团的名称为。(2)、A B,C D的反应类型分别为 , 。(3)、E F反应分两步进行,先与氢氧化钠反应,再酸化。写请出E与氢氧化钠反应的化学方程式:。(4)、由D转化成E的过程中需要使用丙二酸二乙酯,其分子式为C7H12O4。M与丙二酸二乙酯互为同分异构体.写出符合下列条件的M的结构简式:。①分子中含有甲基
②1molM能与足量的碳酸氢钠溶液反应生成标准状况下的气体44.8L
③核磁共振氢谱显示只有3组峰,且峰面积之比为9:2:l
31. 己二酸在化工生产中有重要作用。某兴趣小组用50%的硝酸作氧化剂.钒酸铵作催化剂,氧化环己醇制备己二酸,其反应原理为3 +8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。 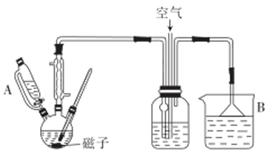
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出已二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)、仪器A的名称为 , 仪器B中所盛装的试剂为。(2)、实验过程中,最适宜的加热方法为;该加热方法的优点是。(3)、本实验中称量钒酸铵的仪器应选用(填“托盘天平”或“电子天平”)。(4)、减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:。(5)、为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是____________(填标号)。A、使用甲基橙作指示剂 B、滴定前俯视读数,滴定后仰视读数 C、实验用的碱滴定管、锥形瓶水洗后均未润洗