上海市黄浦区2021年中考化学二模试卷
试卷更新日期:2021-05-17 类型:中考模拟
一、单选题
-
1. 以下属于非金属元素的是( )A、Si B、Mg C、Al D、K2. 表示两个氯分子的符号是( )A、Cl2 B、2Cl2 C、2Cl D、2ClO23. 有关硫酸钾的说法正确的是( )A、俗称草木灰 B、难溶于水 C、硫元素为+6价 D、属于氧化物4. 不属于氦气用途的是( )A、作保护气 B、填充飞艇 C、作吸附剂 D、作电光源5. 红磷燃烧的化学方程式书写正确的是( )A、 B、 C、 D、6. 有关电解水的实验说法错误的是( )A、与水电解器电源正极相连的电极上产生了氧气 B、产生的氢气与氧气的体积比为1:8 C、通过该实验能证明水的元素组成 D、该实验过程说明水分子是可分的7. 以下物质中碳元素以化合态形式存在的是( )A、金刚石 B、石墨 C、碳-60 D、干冰8. 对以下四种液体在室温时的pH推测,可能合理的是( )A、盐酸:pH=1 B、蒸馏水:pH=8 C、碳酸钠溶液:pH=6 D、氯化钠溶液:pH=99. 关于胆矾的说法正确的是( )A、类别:纯净物 B、组成:5种元素 C、式量:160 D、物理性质:白色粉末10. 导管位置正确的实验装置是( )
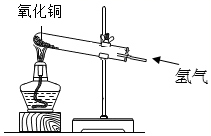


氢气还原氧化铜
实验室制氧气
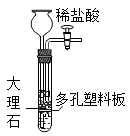
实验室制二氧化碳
收集氧气
A
B
C
D
A、A B、B C、C D、D11. 通过观察颜色鉴别下列各组物质,方法可行的是( )A、氧气与二氧化碳 B、氯化铁溶液与硝酸银溶液 C、木炭粉与二氧化锰 D、蔗糖溶液与氯化钠溶液12. 等物质的量的一氧化碳和二氧化碳,具有相同的( )A、质量 B、氧原子质量 C、分子个数 D、碳元素的百分含量13. 溶液M只含一种溶质,向其中滴入硝酸钡溶液,产生白色沉淀,再加入足量的稀硝酸,沉淀不溶解,有关溶液M的分析正确的是( )A、一定是硫酸 B、一定是碳酸钠 C、可能是盐酸 D、可能是硫酸钠14. 在100g含碳酸钙90%的石灰石中,加入过量的稀盐酸(杂质不参加反应)。有关说法正确的是( )A、参加反应的碳酸钙与生成的二氧化碳的质量比为1:1 B、盐酸过量越多,生成的二氧化碳也越多 C、参加反应的碳酸钙的物质的量为0.1mol D、生成的氯化钙中,钙元素的质量为36g15. 某气体可用下图所示方法收集,推测该气体一定具有的性质是( )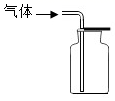 A、密度比空气大 B、易溶于水 C、无色无味 D、化学性质活泼
A、密度比空气大 B、易溶于水 C、无色无味 D、化学性质活泼二、多选题
-
16. 溶液甲是100g20%的硫酸,对其进行如下图所示的操作,得到溶质质量分数为10%的溶液乙。有关溶液乙的说法正确的是( )
 A、溶液的pH:乙<甲 B、溶液质量:200g C、溶质与溶剂的质量比: D、溶质物质的量的计算式:17. 有关过氧化氢溶液与二氧化锰混合制取氧气的实验,说法正确的是( )A、该反应为复分解反应 B、反应装置可以选用启普发生器 C、反应过程中水的质量增加 D、生成氧气的质量小于反应物中氧元素的质量
A、溶液的pH:乙<甲 B、溶液质量:200g C、溶质与溶剂的质量比: D、溶质物质的量的计算式:17. 有关过氧化氢溶液与二氧化锰混合制取氧气的实验,说法正确的是( )A、该反应为复分解反应 B、反应装置可以选用启普发生器 C、反应过程中水的质量增加 D、生成氧气的质量小于反应物中氧元素的质量三、填空题
-
18. 人类每时每刻都离不开空气。
①空气中含量最多的气体的化学式是。分离液态空气得到氧气的过程属于。(填“物理”或“化学”)变化。实验室制取氧气,反应物中须含有元素,臭氧可以吸收紫外线,氧气和臭氧互为。
②煤燃烧产生的二氧化硫,排放到空气中会形成。因此需要对煤进行脱硫处理。天然气的主要成分是甲烷(CH4),甲烷属于(选填“有机”或“无机”)物,其摩尔质量为 g/mol,1.204×1024个甲烷分子的物质的量为mol。氢气是一种清洁能源,氢气燃烧的化学方程式是。
19. 氯化钠是重要的工业原料。(1)、①灼烧氯化钠,火焰呈色,在氯化钠溶液中滴入的硝酸银溶液的现象是:;用氯化钠固体配制100g15%的氯化钠溶液,需称取氯化钠 g。(2)、②下表是氯化钠的部分溶解度。温度/℃
20
40
50
60
80
90
100
溶解度·g100g水
35.9
36.4
37.0
37.1
18.0
38.5
39.2
Ⅰ.判断溶液状态:20℃时,在35.5g氯化钠固体中加入100g水,所得溶液为(选填“饱和”或“不饱和”)溶液。
(3)、Ⅱ.提纯氯化钠:某固体是氯化钠和硝酸钾的混合物,其中约含20%的硝酸钾,通过溶解、蒸发结晶、趁热过滤可得到纯净的氯化钠。以上三个步骤在操作前均需查阅氯化钠、硝酸钾在某些温度下的溶解度。请写出查阅氯化钠,硝酸钾的溶解度对于蒸发结晶这一个步骤的意义。四、流程题
-
20. 某固体粉末含铜、氧化铜和铁,为测定其中铜元素的含量,分别取ag该样品开展实验,获取,称量滤渣铜的质量并进行计算,实验前,设计了如下方案。(1)、(方案一)

①滤液N中最多含溶质种:滤渣M中只含铜。不含铁的原因是。
(2)、(方案二)
一氧化碳与氧化铜反应的现象是;该反应的化学方程式是。
(3)、比较以上两种方案,哪一种能更准确测定铜元素的含量并写出理由,。五、科学探究题
-
21. 碱是一类重要的物质,氢氧化钠和氢氧化钙是常见的碱。(1)、我国古代劳动人民在生产,生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是。写出氢氧化钙的一种用途。(2)、为验证氢氧化钙和氢氧化钠的性质。进行如下图所示实验(装置气密性良好)。

步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析。产生上述现象的原因。乙中产生的白色沉淀的化学式是。
(3)、在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。
Ⅰ.由上图可知,氢氧化钠的溶液与盐酸反应会(选填“放出”或“吸收”)热量:滴入稀盐酸的体积为(选填“a”“b”“c”成“d”)mL时两者恰完全反应。
(4)、Ⅱ.设计实验。证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。
-