北京市顺义区2021年中考化学一模试卷
试卷更新日期:2021-05-17 类型:中考模拟
一、单选题
-
1. 下列变化中,属于化学变化的是 ( )A、矿石粉碎 B、纸张燃烧 C、酒精挥发 D、冰雪融化2. 下列金属中,活动性最强的是 ()A、镁 B、铜 C、锌 D、铝3. 地壳中含量最多的金属元素是( )A、O B、Si C、Al D、Fe4. 下列人体所必需的元素,摄入量过低会导致贫血的是( )A、钙 B、铁 C、锌 D、碘5. 下列物质与水混合,能形成溶液的是( )A、碳酸钙 B、面粉 C、植物油 D、蔗糖6. “维扬一枝花,四海无同类”,我们能闻到琼花的香味说明了( )
 A、分子在不断运动 B、分子的质量很小 C、分子之间有间隔 D、分子的体积很小7. 下列物质中,能用作钾肥的是( )A、K2CO3 B、CO(NH2)2 C、NH4NO3 D、Ca(H2PO4)28. 下列物质属于氧化物的是( )A、O2 B、H2SO4 C、CaO D、ZnCl29. 下列物质性质的表述中,属于化学性质的是()A、氧气无色无味 B、铝呈银白色 C、蔗糖易溶于水 D、碳酸易分解10. 牙膏中的含氟化合物对牙齿有保护作用.一种氟原子的原子核内有9个质子和10个中子,该原子的核电荷数为( )A、7 B、9 C、10 D、1911. 垃圾分类从你我他开始。废弃塑料瓶属于( )
A、分子在不断运动 B、分子的质量很小 C、分子之间有间隔 D、分子的体积很小7. 下列物质中,能用作钾肥的是( )A、K2CO3 B、CO(NH2)2 C、NH4NO3 D、Ca(H2PO4)28. 下列物质属于氧化物的是( )A、O2 B、H2SO4 C、CaO D、ZnCl29. 下列物质性质的表述中,属于化学性质的是()A、氧气无色无味 B、铝呈银白色 C、蔗糖易溶于水 D、碳酸易分解10. 牙膏中的含氟化合物对牙齿有保护作用.一种氟原子的原子核内有9个质子和10个中子,该原子的核电荷数为( )A、7 B、9 C、10 D、1911. 垃圾分类从你我他开始。废弃塑料瓶属于( ) A、可回收物 B、有害垃圾 C、厨余垃圾 D、其他垃圾12. 下列物质中,含有氧分子的是( )
A、可回收物 B、有害垃圾 C、厨余垃圾 D、其他垃圾12. 下列物质中,含有氧分子的是( )
A、O2 B、H2O C、CO2 D、H2O213. 下列物质在氧气中燃烧,火星四射,有黑色固体生成的是( )A、红磷 B、木炭 C、镁条 D、铁丝14. 氢氧化钠是重要的化工原料,其俗称是( )A、纯碱 B、烧碱 C、小苏打 D、熟石灰15. 以下各图能表示纯净物的是(图中不同小球代表不同原子)( )A、 B、
B、 C、
C、 D、
D、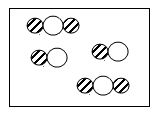 16. 下列物质敞口放置,质量会减轻的是( )A、氢氧化钠 B、浓硫酸 C、浓盐酸 D、碳酸钙17. 下列实验操作中,正确的是( )A、倾倒液体
16. 下列物质敞口放置,质量会减轻的是( )A、氢氧化钠 B、浓硫酸 C、浓盐酸 D、碳酸钙17. 下列实验操作中,正确的是( )A、倾倒液体 B、点燃酒精灯
B、点燃酒精灯  C、稀释浓硫酸
C、稀释浓硫酸  D、检查气密性
D、检查气密性  18. 某同学制作的试剂标签如下,其中化学式书写正确的是( )A、
18. 某同学制作的试剂标签如下,其中化学式书写正确的是( )A、 B、
B、 C、
C、 D、
D、 19. 将适量的下列物质充分混合,温度基本不变的是( )A、氯化钠和水 B、氢氧化钠和水 C、生石灰和水 D、氯化铵和氢氧化钡20. 下列说法错误的是( )A、吸附是常用的净水方法 B、点燃氢气前要验纯 C、生铁和钢都是合金 D、含有Ca2+的水称为硬水21. 用30% 的过氧化氢溶液配制5%的过氧化氢溶液,下列仪器不需要的是( )A、
19. 将适量的下列物质充分混合,温度基本不变的是( )A、氯化钠和水 B、氢氧化钠和水 C、生石灰和水 D、氯化铵和氢氧化钡20. 下列说法错误的是( )A、吸附是常用的净水方法 B、点燃氢气前要验纯 C、生铁和钢都是合金 D、含有Ca2+的水称为硬水21. 用30% 的过氧化氢溶液配制5%的过氧化氢溶液,下列仪器不需要的是( )A、 B、
B、 C、
C、 D、
D、 22. 下列物质的用途,错误的是( )A、干冰用作致冷剂 B、盐酸用于除铁锈 C、小苏打用作发酵粉 D、NaOH在食品包装中作干燥剂23. 科研人员利用单原子催化剂制造燃料甲醇(CH3OH),反应的微观示意图如下。下列说法错误的是( )
22. 下列物质的用途,错误的是( )A、干冰用作致冷剂 B、盐酸用于除铁锈 C、小苏打用作发酵粉 D、NaOH在食品包装中作干燥剂23. 科研人员利用单原子催化剂制造燃料甲醇(CH3OH),反应的微观示意图如下。下列说法错误的是( ) A、该反应化学方程式为 B、甲醇由三种元素组成 C、甲醇属于有机化合物 D、反应前后催化剂的质量不变24. 甲、乙两种固体的溶解度曲线如图所示。下列说法错误的是( )
A、该反应化学方程式为 B、甲醇由三种元素组成 C、甲醇属于有机化合物 D、反应前后催化剂的质量不变24. 甲、乙两种固体的溶解度曲线如图所示。下列说法错误的是( ) A、20℃时,甲、乙的溶解度相等 B、甲的饱和溶液从40℃降温到20℃,析出20克甲 C、乙的饱和溶液从20℃升温到40℃,变成不饱和溶液 D、40℃时,乙的饱和溶液中溶质的质量分数的计算方法是25. 在点滴板的4个孔穴中放有4种物质,分别滴加稀硫酸,进行如图所示的实验,观察到以下现象:
A、20℃时,甲、乙的溶解度相等 B、甲的饱和溶液从40℃降温到20℃,析出20克甲 C、乙的饱和溶液从20℃升温到40℃,变成不饱和溶液 D、40℃时,乙的饱和溶液中溶质的质量分数的计算方法是25. 在点滴板的4个孔穴中放有4种物质,分别滴加稀硫酸,进行如图所示的实验,观察到以下现象:
孔穴
1
2
3
4
现象
溶液变红
得到黄色溶液
有气泡冒出
无明显现象
对点滴板中原物质的推理,正确的是( )
A、1中可能是酚酞溶液 B、2中可能是氧化铁 C、3中一定是碳酸盐 D、4中一定是氢氧化钠溶液二、填空题
-
26. 为减缓温室效应,我国计划在2060年实现“碳中和”的目标。碳排放无处不在,以手机为例。
手机中金属、塑料等材料的生产过程会排放CO2。
(1)、塑料属于。A 金属材料 B 天然有机高分子材料 C 合成有机高分子材料 D 无机非金属材料
(2)、工业上用CO与赤铁矿(主要成分为Fe2O3)炼铁时会产生CO2 , 该反应的化学方程式为。27. 手机运输过程中使用的交通工具要消耗化石燃料。(1)、化石燃料包括天然气、和煤。(2)、“CNG”汽车以天然气为燃料,其产生CO2的化学方程式为。28. 实现“碳中和”,一方面要减少CO2排放,另一方面要尽量吸收不可避免的碳排放。写出一种吸收CO2的化学方程式表示。29. 小明家买了一罐大米,上面写着“充氮保鲜装”(下图)。 (1)、包装中充入氮气可以保鲜,因为氮气。(2)、小明从罐中取出一试管气体,伸入燃着的木条,观察到木条熄灭。该实验(填“能”或“不能”)证明罐中充入了氮气,理由是。30. 二氧化氯(ClO2)是常用的饮用水消毒剂。
(1)、包装中充入氮气可以保鲜,因为氮气。(2)、小明从罐中取出一试管气体,伸入燃着的木条,观察到木条熄灭。该实验(填“能”或“不能”)证明罐中充入了氮气,理由是。30. 二氧化氯(ClO2)是常用的饮用水消毒剂。 (1)、二氧化氯中氯元素的化合价为。(2)、自来水管道中存在“Fe3+”。科研人员研究“Fe3+”对二氧化氯灭菌率的影响,结果如图所示。由此得出的结论是。31. 载人航天器中的水气整合系统如下图所示。
(1)、二氧化氯中氯元素的化合价为。(2)、自来水管道中存在“Fe3+”。科研人员研究“Fe3+”对二氧化氯灭菌率的影响,结果如图所示。由此得出的结论是。31. 载人航天器中的水气整合系统如下图所示。 (1)、CO2再利用反应器中装有特定催化剂,反应的化学方程式是。(2)、整个循环系统中未被利用的物质是。
(1)、CO2再利用反应器中装有特定催化剂,反应的化学方程式是。(2)、整个循环系统中未被利用的物质是。三、科普阅读题
-
32. 阅读下列科普短文(原文作者郑永春,王世杰等,原文有删改)。
模拟月壤是与月球月壤具有相似的矿物组成、化学成分和物理力学性质的地球物质,是月球样品的地球化学复制品,用于月球探测的地面试验。
以长白山的四海火山渣为初始物质,中国科学院地球化学研究所研制成功CAS-1模拟月壤。
CAS-1模拟月壤主量元素组成与某登月采集的月壤样品平均化学组成的比较如图1所示。

为确定CAS-1 模拟月壤经历风化成土作用的强度,对其进行了有机营养元素的常规土壤分析,结果见表1。
表1 CAS-1 模拟月壤的有机营养元素组成(WB/%)及pH
C
N
H
S
pH(水:土=2.5:1)
0.155
0.022
0.134
0.034
8.28
CAS-1模拟月壤的C、N、H、S含量远远低于地球土壤,基本上没有经历生物成土作用,属于典型的岩石质。
由于经历的风化程度和成熟度不同,月壤的颗粒形态极为多变,从圆球状、椭球状到极端棱角状都有出现。CAS-1模拟月壤的颗粒形态表现为典型的研磨形成的颗粒特征,为尖锐棱角状,与月壤颗粒的形态稍有差异。但多次测量CAS-1模拟月壤中值粒径与月壤样品的中值粒径或平均粒径相似。
回答下列问题:
(1)、CAS-1 模拟月壤显(填“酸性”“碱性”或“中性”)。(2)、月壤中含量钛元素(Ti)和铬元素(Cr),两者的本质区别是。(3)、从图1可知,月壤中含量最高的元素是。(4)、CAS-1模拟月壤的组成中,明显低于月壤的是。(5)、下列有关CAS-1模拟月壤的说法错误的是。A 模拟月壤来源于月球表面
B 模拟月壤与月壤的物理力学性质相似
C 模拟月壤与月壤的颗粒形状相同
D 若以5:1的水土比测试模拟月壤的pH,数值不会增大
四、流程题
-
33. 丙酸钙[(C2H5COO)2Ca]可作食品防霉剂,国家标准规定了其最大使用量。丙酸钙的工业生产过程如下图所示。
 (1)、石灰窑中的反应在高温下进行,生成两种氧化物,反应的化学方程式为。(2)、过筛的目的是除去未分解的石灰石等杂质,检验滤渣中含有石灰石所加的试剂是。(3)、制备丙酸钙时需要调节反应锅中的pH,调节操作中加入的物质可以是。(4)、已知反应锅中发生中和反应。上述流程中,不涉及的基本反应类型是。
(1)、石灰窑中的反应在高温下进行,生成两种氧化物,反应的化学方程式为。(2)、过筛的目的是除去未分解的石灰石等杂质,检验滤渣中含有石灰石所加的试剂是。(3)、制备丙酸钙时需要调节反应锅中的pH,调节操作中加入的物质可以是。(4)、已知反应锅中发生中和反应。上述流程中,不涉及的基本反应类型是。五、计算题
-
34. 食盐不仅是日常生活中重要的调味品,也是氯碱工业的原料,反应的化学方程式为: 。用该方法制取142t氯气,可得到氢氧化钠多少t?
六、实验题
-
35. 依据下图回答问题:
 (1)、A装置用于制取氧气,反应的化学方程式为。收集氧气可选择的装置是。(2)、E实验观察到木炭剧烈燃烧。36. 依据下图所示实验回答问题。
(1)、A装置用于制取氧气,反应的化学方程式为。收集氧气可选择的装置是。(2)、E实验观察到木炭剧烈燃烧。36. 依据下图所示实验回答问题。 (1)、A实验中观察到的现象是。(2)、B实验用玻璃棒引流的目的是。(3)、C中热水的作用是。对比铜片上的白磷和红磷,得出的结论是。37. 用图1装置探究空气中氧气的含量,测得实验过程中气压的变化如图2所示。
(1)、A实验中观察到的现象是。(2)、B实验用玻璃棒引流的目的是。(3)、C中热水的作用是。对比铜片上的白磷和红磷,得出的结论是。37. 用图1装置探究空气中氧气的含量,测得实验过程中气压的变化如图2所示。
 (1)、红磷燃烧的化学方程式为。(2)、图2中,c点对应的实验操作是。38. 课外小组同学用两种方法验证Zn、Fe、Cu的金属活动性顺序(如图)。
(1)、红磷燃烧的化学方程式为。(2)、图2中,c点对应的实验操作是。38. 课外小组同学用两种方法验证Zn、Fe、Cu的金属活动性顺序(如图)。 (1)、方法1:向三只试管中加入的溶液A为稀盐酸,得出Zn的金属活动性比Fe强,依据的现象是。(2)、方法2:仅向试管①和③中加入溶液A,则A是。该过程中发生反应的化学方程式为。39. 烧杯A中盛有一定量的碳酸钠溶液,进行如图所示的实验。
(1)、方法1:向三只试管中加入的溶液A为稀盐酸,得出Zn的金属活动性比Fe强,依据的现象是。(2)、方法2:仅向试管①和③中加入溶液A,则A是。该过程中发生反应的化学方程式为。39. 烧杯A中盛有一定量的碳酸钠溶液,进行如图所示的实验。 (1)、碳酸钠溶液显碱性,得出此结论的依据是。(2)、步骤②中发生反应的化学方程式为。(3)、步骤③观察到的现象是。
(1)、碳酸钠溶液显碱性,得出此结论的依据是。(2)、步骤②中发生反应的化学方程式为。(3)、步骤③观察到的现象是。七、科学探究题
-
40. 小明网购金鱼时,商家附赠了一包增氧颗粒(如图),对其进行研究。

(查阅资料)
①增氧颗粒的主要成分为过碳酸钠(2Na2CO3·3H2O2)溶于水时分解生成碳酸钠和过氧化氢。
②养殖水体中的溶氧含量一般应保持在5-8mg/L,当溶氧量低于3mg/L时,不利于鱼类生长。
(进行实验)
探究1.用图1所示装置进行实验。

实验步骤
实验现象
1.完全溶解后,伸入带火星的木条
有小气泡冒出,木条无明显现象
2.向试管中加入适量稀盐酸,伸入燃着的木条
探究2.各取1升鱼池水,分别加入不同质量的增氧颗粒,并用传感器测定溶氧量(图2),结果如下表:

序号
①
②
③
所加增氧颗粒质量(g)
0.3g
0.6
1.2
最大溶氧量(mg/L)
9.25
9.38
9.80
探究3.在1L下列水样中放入2.4g增氧颗粒,并用图2装置测定溶氧量(mg/L),结果如下表:
序号
①
②
③
④
水样
鱼池水
自来水
中水
蒸馏水
加增氧颗粒前
8.4
8.4
8.5
10.63
增氧颗粒溶解后
10.99
10.12
10.82
11.55
(反思与评价)
(1)、探究1的步骤2中,预期的现象是。(2)、探究3的实验目的是。(3)、通过探究3发现了一些新问题,你想进一步研究的问题是。(4)、(解释与结论)投入增氧颗粒后,水中溶氧量增加的原因用化学方程式表示为。
(5)、依据以上探究,在运输金鱼的过程中,若水体溶氧量小于3mg/L,应向每升水中加入g增氧颗粒,理由是。
-
-
-