北京市大兴区2021年中考化学一模试卷
试卷更新日期:2021-05-17 类型:中考模拟
一、单选题
-
1. 空气成分中,体积分数约占78%的是( )
A、氮气 B、氧气 C、二氧化碳 D、稀有气体2. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、木炭 B、红磷 C、氢气 D、铁丝3. 下列物质中,属于溶液的是( )A、糖水 B、牛奶 C、米粥 D、豆浆4. 铝能制成铝箔是因为铝具有( )A、延展性 B、导电性 C、导热性 D、抗腐蚀性5. “垃圾分类工作就是新时尚”。废旧报纸应投入的垃圾箱是( )A、 B、
B、 C、
C、 D、
D、 6. 为帮助登山人员解决呼吸困难的问题,应携带的物质是( )A、氢气 B、氧气 C、氮气 D、二氧化碳7. 碳酸钠是重要的化工原料,其俗称为( )A、火碱 B、烧碱 C、纯碱 D、熟石灰8. 草木灰是一种农家肥,其主要成分是K2CO3 , 它属于( )A、钾肥 B、磷肥 C、氮肥 D、复合肥9. 下列含金属元素的物质是( )A、H2SO4 B、Al2O3 C、NO2 D、P2O510. 下列物质中,属于氧化物的是( )A、CO2 B、KMnO4 C、O2 D、Ca(OH)211. 实验室保存下列物质,不需要密封保存的是( )
6. 为帮助登山人员解决呼吸困难的问题,应携带的物质是( )A、氢气 B、氧气 C、氮气 D、二氧化碳7. 碳酸钠是重要的化工原料,其俗称为( )A、火碱 B、烧碱 C、纯碱 D、熟石灰8. 草木灰是一种农家肥,其主要成分是K2CO3 , 它属于( )A、钾肥 B、磷肥 C、氮肥 D、复合肥9. 下列含金属元素的物质是( )A、H2SO4 B、Al2O3 C、NO2 D、P2O510. 下列物质中,属于氧化物的是( )A、CO2 B、KMnO4 C、O2 D、Ca(OH)211. 实验室保存下列物质,不需要密封保存的是( )
A、浓硫酸 B、氢氧化钠 C、石灰石 D、浓盐酸12. 下列不属于二氧化碳用途的是( )A、作燃料 B、用作气体肥料 C、用于灭火 D、生产碳酸饮料13. 下列符号表示1个氢分子的是()A、H B、H2 C、H+ D、2H14. 铷原子钟被誉为导航卫星的“心脏”。元素周期表中铷元素的信息如下图所示,对图中信息理解错误的是( ) A、质子数为37 B、元素名称为铷 C、元素符号为Rb D、核外电子数为85.4715. 下列物质中,含氧分子的是( )A、O2 B、H2O C、CO2 D、SO216. 水变为水蒸气,水分子发生的变化是( )A、间隔增大 B、质量增大 C、体积增大 D、个数增多17. 下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列说法中,错误的是( )
A、质子数为37 B、元素名称为铷 C、元素符号为Rb D、核外电子数为85.4715. 下列物质中,含氧分子的是( )A、O2 B、H2O C、CO2 D、SO216. 水变为水蒸气,水分子发生的变化是( )A、间隔增大 B、质量增大 C、体积增大 D、个数增多17. 下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列说法中,错误的是( ) A、实验时红磷要过量 B、将点燃的红磷伸入集气瓶后再将弹簧夹夹紧乳胶管 C、待红磷熄灭,温度恢复到室温后再打开弹簧夹 D、最终进入瓶中水的体积约为氧气的体积18. 高铁酸钠(Na2FeO4)是一种绿色消毒剂,主要用于饮用水处理。高铁酸钠(Na2FeO4)中铁元素的化合价为( )A、+1 B、+4 C、+6 D、+719. 下列是人体中几种体液的正常pH,酸性最强的是( )A、胆汁(6.8﹣7.4) B、唾液(6.6﹣7.1) C、血液(7.35﹣7.45) D、胃液(0.8﹣1.5)20. 红枣醋中含有一种酸(C4H6O5),具有解酒护肝健胃的作用。下列说法正确的是( )A、该酸中氢元素的质量分数最大 B、该酸中氢、氧原子个数比为6:4 C、该酸中碳、氢元素的质量比为8:1 D、该酸是由碳、氢、氧元素组成的混合物21. 氯碱工业的反应原理是电解饱和食盐水(主要成分为NaCl和H2O),下列物质不可能是氯碱工业产品的是( )A、H2 B、Cl2 C、Na2CO3 D、NaOH22. 下列行为不符合实验安全要求的是( )A、熄灭酒精灯时,用灯帽盖灭 B、稀释浓硫酸时,将水注入浓硫酸中 C、使用氢氧化钠时,戴上橡胶手套 D、液体加热时,试管口不能对着人23. 下列物质的性质中,属于化学性质的是( )A、金刚石硬度大 B、甲烷具有可燃性 C、氯化钠是白色固体 D、酒精具有挥发性24. KNO3的溶解度曲线如图所示。下列说法错误的是( )
A、实验时红磷要过量 B、将点燃的红磷伸入集气瓶后再将弹簧夹夹紧乳胶管 C、待红磷熄灭,温度恢复到室温后再打开弹簧夹 D、最终进入瓶中水的体积约为氧气的体积18. 高铁酸钠(Na2FeO4)是一种绿色消毒剂,主要用于饮用水处理。高铁酸钠(Na2FeO4)中铁元素的化合价为( )A、+1 B、+4 C、+6 D、+719. 下列是人体中几种体液的正常pH,酸性最强的是( )A、胆汁(6.8﹣7.4) B、唾液(6.6﹣7.1) C、血液(7.35﹣7.45) D、胃液(0.8﹣1.5)20. 红枣醋中含有一种酸(C4H6O5),具有解酒护肝健胃的作用。下列说法正确的是( )A、该酸中氢元素的质量分数最大 B、该酸中氢、氧原子个数比为6:4 C、该酸中碳、氢元素的质量比为8:1 D、该酸是由碳、氢、氧元素组成的混合物21. 氯碱工业的反应原理是电解饱和食盐水(主要成分为NaCl和H2O),下列物质不可能是氯碱工业产品的是( )A、H2 B、Cl2 C、Na2CO3 D、NaOH22. 下列行为不符合实验安全要求的是( )A、熄灭酒精灯时,用灯帽盖灭 B、稀释浓硫酸时,将水注入浓硫酸中 C、使用氢氧化钠时,戴上橡胶手套 D、液体加热时,试管口不能对着人23. 下列物质的性质中,属于化学性质的是( )A、金刚石硬度大 B、甲烷具有可燃性 C、氯化钠是白色固体 D、酒精具有挥发性24. KNO3的溶解度曲线如图所示。下列说法错误的是( ) A、0~60 ℃,KNO3的溶解度随温度升高而增大 B、60 ℃时,100 g 水中最多溶解110 g KNO3 C、20 ℃时,KNO3饱和溶液中溶质质量分数为31.6% D、将20 ℃的KNO3饱和溶液升温至60℃,溶液中溶质质量不变25. 下列实验方法能达到实验目的的是( )
A、0~60 ℃,KNO3的溶解度随温度升高而增大 B、60 ℃时,100 g 水中最多溶解110 g KNO3 C、20 ℃时,KNO3饱和溶液中溶质质量分数为31.6% D、将20 ℃的KNO3饱和溶液升温至60℃,溶液中溶质质量不变25. 下列实验方法能达到实验目的的是( )选项
实验目的
实验方法
A
鉴别稀盐酸和NaCl溶液
滴加酚酞溶液
B
鉴别纯棉线和羊毛线
观察颜色
C
区分硬水和软水
闻气味
D
除去O2中混有的水蒸气
将混合气通过浓硫酸
A、A B、B C、C D、D二、填空题
-
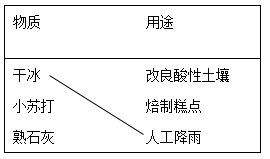
26. 补齐物质及其用途的连线。
 27. 如图为某奶制品营养成分表。请回答问题。
27. 如图为某奶制品营养成分表。请回答问题。 (1)、表中的“钠”“钙”指的是(填“原子” 或“元素”)。(2)、人体每日要摄入足量的钙。儿童或青少年缺钙会患 ___________(填序号)。A、贫血 B、元素佝偻病 C、夜盲症(3)、图中列出的营养素有种。28. 水是一种重要的资源。(1)、电解水实验揭示了水的组成。右图实验中得到氧气的试管是(填“1”或“2”),该反应的化学方程式为。
(1)、表中的“钠”“钙”指的是(填“原子” 或“元素”)。(2)、人体每日要摄入足量的钙。儿童或青少年缺钙会患 ___________(填序号)。A、贫血 B、元素佝偻病 C、夜盲症(3)、图中列出的营养素有种。28. 水是一种重要的资源。(1)、电解水实验揭示了水的组成。右图实验中得到氧气的试管是(填“1”或“2”),该反应的化学方程式为。 (2)、自来水厂净水过程中用到活性炭,其作用是。29. 手推车是超市购物的常用工具。
(2)、自来水厂净水过程中用到活性炭,其作用是。29. 手推车是超市购物的常用工具。 (1)、手推车各部件中,由有机合成材料制成的是把手和。(2)、生铁支架在春夏之季更易生锈的原因是 , 工业上常用赤铁矿冶炼生铁,反应的化学方程式为。30. 实验室制取气体所需装置如下图所示。
(1)、手推车各部件中,由有机合成材料制成的是把手和。(2)、生铁支架在春夏之季更易生锈的原因是 , 工业上常用赤铁矿冶炼生铁,反应的化学方程式为。30. 实验室制取气体所需装置如下图所示。 (1)、装置中标“a”的仪器名称是。(2)、用二氧化锰和过氧化氢溶液制取氧气时,所选用的发生装置是。(3)、用高锰酸钾制取氧气时,反应的化学方程式为。
(1)、装置中标“a”的仪器名称是。(2)、用二氧化锰和过氧化氢溶液制取氧气时,所选用的发生装置是。(3)、用高锰酸钾制取氧气时,反应的化学方程式为。三、科普阅读题
-
31. 阅读下面科普短文。

为应对CO2等温室气体引起的气候变化问题,世界各国以全球协约的方式减排温室气体,我国提出碳达峰和碳中和目标。碳达峰指的是在某一时间,CO2的排放量达到历史最高值,之后逐步回落;碳中和指的是通过植树造林、节能减排等形式,抵消CO2的排放量。我国目标是争取2030年前达到碳达峰,2060年实现碳中和。
现阶段我国的能源结构以化石燃料为主,其燃烧释放出大量的CO2.实现碳中和的路径之一为降低化石能源在消费能源中的比例,提高可再生、非化石能源比例。路径之二为捕集、利用和封存CO2.如利用废气中的CO2制取甲醇(CH3OH),反应的微观示意图如图1所示。在实际生产中,CH3OH的产率除受浓度、温度、压强等因素影响外,还受催化剂CuO质量分数的影响(如图2所示)。

我国科学家们撰文提出“液态阳光”概念,即将太阳能转化为可稳定存储并且可输出的燃料,实现燃料零碳化。随着科学技术的发展,今后的世界,每天的阳光将为我们提供取之不尽、用之不竭的热、电,还有可再生燃料!
依据文章内容回答下列问题。
(1)、我国碳达峰的目标是。(2)、化石燃料包括煤、、天然气。(3)、根据图1,写出CO2制取甲醇的化学方程式:。(4)、由图2可得到的结论是。(5)、下列说法正确的是(填序号)。A碳达峰、碳中和中的“碳”指的是碳单质
B控制化石燃料的使用可减少碳排放
C碳中和指的是没有碳排放
D“液态阳光”将实现燃料零碳化
四、流程题
-
32. 以空气等为原料合成氨(NH3)、尿素[CO(NH2)2]R的简易生产流程如下图所示。
 (1)、① 中发生的变化属于(填“物理变化”或“化学变化”)。(2)、补全 ③ 中反应的化学方程式:2NH3 + CO2 CO(NH2)2 + 。33. 氟化工产品生产过程中产生的副产品盐酸可制备氯化钙,其主要工艺流程如下图所示。
(1)、① 中发生的变化属于(填“物理变化”或“化学变化”)。(2)、补全 ③ 中反应的化学方程式:2NH3 + CO2 CO(NH2)2 + 。33. 氟化工产品生产过程中产生的副产品盐酸可制备氯化钙,其主要工艺流程如下图所示。 (1)、化灰池中发生反应的基本反应类型为。(2)、中和锅中发生反应的化学方程式为。(3)、上述流程中,用于分离提纯的设备有。
(1)、化灰池中发生反应的基本反应类型为。(2)、中和锅中发生反应的化学方程式为。(3)、上述流程中,用于分离提纯的设备有。五、实验题
-
34. 下图所示的一组实验可用于验证可燃物燃烧的条件。
 (1)、磷燃烧反应的化学方程式为。(2)、设计铜片上的白磷与红磷作对比,其目的是。(3)、得到“可燃物燃烧需要与氧气接触”的结论,依据的现象是。35. 从下图选择仪器进行实验,除去粗盐中难溶性杂质。
(1)、磷燃烧反应的化学方程式为。(2)、设计铜片上的白磷与红磷作对比,其目的是。(3)、得到“可燃物燃烧需要与氧气接触”的结论,依据的现象是。35. 从下图选择仪器进行实验,除去粗盐中难溶性杂质。 (1)、除去粗盐中难溶性杂质的基本实验步骤为:溶解、过滤、。(2)、溶解过程中玻璃棒的作用是。(3)、过滤时除滤纸外,还需要的仪器有(填序号)。36. 利用如图装置进行实验。
(1)、除去粗盐中难溶性杂质的基本实验步骤为:溶解、过滤、。(2)、溶解过程中玻璃棒的作用是。(3)、过滤时除滤纸外,还需要的仪器有(填序号)。36. 利用如图装置进行实验。 (1)、试管1中发生反应的化学方程式为。(2)、试管2中出现的现象是。(3)、能证明Fe的金属活动性比Cu强的实验现象是。
(1)、试管1中发生反应的化学方程式为。(2)、试管2中出现的现象是。(3)、能证明Fe的金属活动性比Cu强的实验现象是。六、简答题
-
37. 利用图1装置研究NaOH与CO2的反应。用等体积的氢氧化钠溶液、水分别进行实验,将注射器内液体全部推入,测得一段时间内温度和压强的变化如图2、图3所示。
 (1)、图2可说明NaOH与CO2发生了化学反应,其依据是。(2)、写出NaOH与CO2发生反应的化学方程式。(3)、由图3可得到的结论是。
(1)、图2可说明NaOH与CO2发生了化学反应,其依据是。(2)、写出NaOH与CO2发生反应的化学方程式。(3)、由图3可得到的结论是。七、科学探究题
-
38. 维生素C(C6H8O6)简称VC , 又称抗坏血酸,是人体非常重要的一种营养素。课外小组同学利用实验探究其性质并比较饮料中VC的含量。
实验准备:VC片研碎后加蒸馏水溶解,过滤得到无色透明VC溶液。
(1)、Ⅰ.探究VC的性质(进行实验)用右图装置完成实验。

(实验记录)试管中有气泡产生,烧杯中澄清石灰水变浑浊。
(解释与结论)
由上述实验可知,VC溶液呈(填“酸性”“碱性”或“中性”)。
(2)、烧杯中发生反应的化学方程式为。(3)、Ⅱ.比较饮料中VC的含量(查阅资料) ① 淀粉溶液遇碘(I2)变蓝。
② VC可以和碘发生反应:C6H8O6 + I2= C6H6O6 + 2HI。
(进行实验)取8支试管,分别加入0.6%的淀粉溶液和0.06%的碘水(每支试管中加入淀粉溶液的量相同,碘水的量相同),溶液变蓝。再逐滴加入不同的饮料,记录溶液蓝色褪去时所加的饮料滴数。
实验序号
饮料名称
开盖后存放时间/h
所用饮料滴数
1
A饮料
0
2
2
B饮料
0
47
3
C饮料
0
大于50滴不褐色
4
D饮料
0
7
5
E饮料
0
10
6
E饮料
12
12
7
E饮料
24
18
8
E饮料
36
41
(解释与结论)
VC属于(填“无机化合物”或“有机化合物”)。
(4)、设计实验1~5的目的是。(5)、对比实验5~8可得到的结论是。(6)、(反思与评价)根据实验的数据,请你为同学们饮用饮料提出合理建议:。
八、计算题
-
39. 钛(Ti)和钛合金被认为是21世纪的重要金属材料。钛可通过如下反应制得:
TiCl4 + 2Mg Ti + 2MgCl2 , 若要制得96 g钛,计算至少需要镁的质量。
-
-
-