初中科学 化学方程式计算
试卷更新日期:2021-05-09 类型:二轮复习
一、单选题
-
1. 在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的2倍,则下列说法正确的是( )
甲的质量/g
乙的质量/g
丙的质量/g
丁的质量/g
反应前
64
10
1
16
t时刻
32
A
反应后
0
54
b
0
A、生成物只有乙 B、a等于15 C、b等于36 D、该反应方程式中甲与丁的化学计量数之比为2:1二、解答题
-
2. 科学兴趣小组对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究,测定石头纸中碳酸钙的质量分数。
实验方法是:均匀称取七份样品分别和稀盐酸反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),用电子天平及有关装置进行实验,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
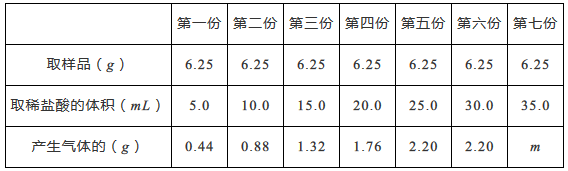
通过对数据的分析和比较,回答下列有关问题
 (1)、m为。(2)、石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)(3)、在坐标图中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图。3. 复合墙纸是室内装饰的常用材料,含大量碳酸钙,有低碳环保的优势。为测定复合墙纸中碳酸钙的含量,某同学称取50克复合墙纸样品,平均分成5份,分别加入溶质质量分数相同、质量不同的稀盐酸中进行实验(化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),实验数据如表:(假设墙纸中的其它成分既不溶于水,也不与稀盐酸反应)
(1)、m为。(2)、石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)(3)、在坐标图中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图。3. 复合墙纸是室内装饰的常用材料,含大量碳酸钙,有低碳环保的优势。为测定复合墙纸中碳酸钙的含量,某同学称取50克复合墙纸样品,平均分成5份,分别加入溶质质量分数相同、质量不同的稀盐酸中进行实验(化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),实验数据如表:(假设墙纸中的其它成分既不溶于水,也不与稀盐酸反应)组别 1 2 3 4 5 加入样品的质量/克 10 10 10 10 10 加入稀盐酸的质量/克 10 20 30 40 50 充分反应后生成气体的质量/克 0.44 0.88 1.32 1.54 1.54 (1)、根据实验数据判断盐酸过量的组别是。(2)、根据化学方程式列式计算该样品中碳酸钙的质量分数。(3)、该稀盐酸中氯元素的质量分数为。4. 石灰石是主要矿产品之一。某校研究性学习小组想要测量当地矿石中含CaCO3的质量分数。取一些矿石样品,再取稀盐酸200克并平均分成4份,进行实验。实验结果如下:实验组别
1
2
3
4
加样品的质量(克)
5
10
15
20
生成CO2的质量(克)
1.76
M
4.4
4.4
 (1)、哪几次反应中矿石有剩余? 。(2)、上表中M的数值是。(3)、如果采用如上右图所示的装置制取并收集气体,再利用二氧化碳密度求出二氧化碳气体质量。则下列说法正确的是。
(1)、哪几次反应中矿石有剩余? 。(2)、上表中M的数值是。(3)、如果采用如上右图所示的装置制取并收集气体,再利用二氧化碳密度求出二氧化碳气体质量。则下列说法正确的是。A、若反应时间过短,会因反应不充分,使测量结果不准。
B、若反应一段时间后,排出反应装置内原有空气再连接收集气体装置,会使结果更准确
(4)、试计算这种矿石中CaCO3的质量分数。5. 实验室通常用化学方法制取氧气,某同学取质量为m 的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题: (1)、t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段;(2)、请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)6. 为了测定某种贝壳中碳酸钙的质量分数,某探究小组的同学称取40g贝壳样品,分别在5只烧杯中进行了实验,实验数据见下表(贝壳中杂质既不溶于水也不能与盐酸反应):根据实验设计及有关数据进行分析与计算:
(1)、t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段;(2)、请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)6. 为了测定某种贝壳中碳酸钙的质量分数,某探究小组的同学称取40g贝壳样品,分别在5只烧杯中进行了实验,实验数据见下表(贝壳中杂质既不溶于水也不能与盐酸反应):根据实验设计及有关数据进行分析与计算:烧杯A
烧杯B
烧杯C
烧杯D
烧杯E
加入贝壳样品的质量/g
8
8
8
8
8
加入稀盐酸的质量/g
10
20
30
40
50
充分反应后生成气体的质量/g
0.77
1.54
x
3.08
3.08
(1)、表格中x的值为。(2)、样品中碳酸钙的质量分数。(3)、烧杯D中物质充分反应后所得溶液溶质的质量分数(计算结果精确到0.1%)。7. 现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:
NaHCO3+HCl=NaCl+CO2↑+H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2的与加入稀盐酸的数据如图。
 (1)、当加入g盐酸时,才开始产生CO2;图中V=mL。(2)、请计算:①所加入盐酸中HCl的质量分数为多少?
(1)、当加入g盐酸时,才开始产生CO2;图中V=mL。(2)、请计算:①所加入盐酸中HCl的质量分数为多少?②原样品中Na2CO3和NaHCO3的质量各是多少?
8. 为确定某大理石样品的纯度,某兴趣小组进行如下实验:称取一定量该大理石(主要成分是CaCO3;,杂质不参加反应)加入烧杯中,向其中逐渐加入稀盐酸至完全反应。反应结束后,称量烧杯的总质量(溶解的气体忽略不计),有关数据记录如下表。烧杯
大理石
稀盐酸
反应后烧杯总质量
质量(克)
90
9
50
145.7
(1)、实验中判断碳酸钙已经完全反应的方法是。(2)、实验中产生的二氧化碳质量为克,请计算该大理石样品的纯度。(计算结果精确到0.1%)9. 有A、B两种物质组成的混合物四份,总质量均为12克。A和B在一定条件下可发生化合反应生成物质C。四份混合物内含A和B的质量,及它们充分反应后生成C的质量见下表。物质
第一份
第二份
第三份
第四份
反应前A的质量(克)
11
8
a
反应前B的质量(克)
1
4
b
反应后生成C的质量(克)
5
10
7.5
(1)、第一份混合物中参加反应的A和B的质量比为。(2)、第二份混合物在反应结束后,反应物中的有剩余。(3)、若第三份混合物恰好能完全反应,则a的值是。(4)、第四份混合物反应前,A和B的质量比为。10. 兴趣小组为测定石灰石中碳酸钙的质量分数,把15g石灰石样品加入烧杯中,另取291.6g稀盐酸平均分三次滴加入烧杯中,充分反应后(杂质不溶于水也不与酸反应),烧杯中剩余固体的质量如表所示。实验次数
第一次
第二次
第三次
剩余固体的质量/克
10
5
5
求:
(1)、该石灰石样品中碳酸钙的质量为克。(2)、第一次实验结束时,生成二氧化碳气体的质量为克。(3)、第二次实验结束时,所得溶液的溶质质量分数为多少?11. 为研究影响化学反应快慢的因素,某同学选取成分相同的粉末状大理石、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸在锥形瓶中反应(样品中杂质不与稀盐酸反应),实验装置如图所示。实验中每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳质量,数据记录见下表:
时间/分
0
2
4
6
8
10
12
14
16
18
粉末状大理石生成的CO2质量/克
0
1.45
1.75
1.96
2.10
2.16
2.19
2.20
2.20
2.20
块状大理石生成的CO2质量/克
O
0.45
0.80
1.10
1.36
1.60
1.81
1.98
2.11
2.18
(1)、实验过程中,判断反应结束的现象是;(2)、块状大理石最多能产生 克二氧化碳。(3)、分析数据可知影响反应快慢的因素有。(4)、该大理石样品中含碳酸钙的质量分数是多少?(写出计算过程)12. 实验室制取氧气时,某同学取质量为15.0g的氯酸钾和二氧化锰的固体混合物加热,固体质量与反应时间的关系如图甲所示。 (1)、t0~t1时段固体质量不变,是因为;t4~t5时段固体质量不变,是因为。(2)、t4时,制得氧气质量是克。(3)、t5时MnO2的质量为多少?(写出计算过程)(4)、请在图乙中画出固体中氧元素质量在t0~t5时段的变化曲线。(应做适当标注)13. 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
(1)、t0~t1时段固体质量不变,是因为;t4~t5时段固体质量不变,是因为。(2)、t4时,制得氧气质量是克。(3)、t5时MnO2的质量为多少?(写出计算过程)(4)、请在图乙中画出固体中氧元素质量在t0~t5时段的变化曲线。(应做适当标注)13. 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:样品编号
①
②
③
④
稀盐酸的质量
25g
50g
m
150g
剩余固体的质量
7.5g
5g
2g
2g
分析题中有关信息和图表,回答下列问题:
(1)、该石灰石样品中碳酸钙的质量分数为多少?(2)、40克该石灰石样品充分反应后可以产生多少克二氧化碳?(3)、编号③所用稀盐酸的质量m为 。A、可能是30克 B、一定是50克 C、一定是80克 D、大于或等于80克(4)、该实验所用的稀盐酸的溶质质量分数是多少?14. 某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取25.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。求: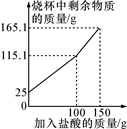 (1)、产生CO2的总质量为g。(2)、鸡蛋壳中碳酸钙的质量分数。(3)、所用盐酸的质量分数(保留1位小数)。15. 为测定大理石中碳酸钙的质量分数,某实验小组将 15g 大理石放在烧杯中,加入过量的稀盐酸,装置总质量随加入盐酸的变化关系如图。已知大理石中杂质不溶于水也不和盐酸反应。
(1)、产生CO2的总质量为g。(2)、鸡蛋壳中碳酸钙的质量分数。(3)、所用盐酸的质量分数(保留1位小数)。15. 为测定大理石中碳酸钙的质量分数,某实验小组将 15g 大理石放在烧杯中,加入过量的稀盐酸,装置总质量随加入盐酸的变化关系如图。已知大理石中杂质不溶于水也不和盐酸反应。 (1)、大理石中碳酸钙的质量分数为。(2)、m 的数值为。(3)、B 点的溶质为。(4)、计算 A 点溶质的质量分数。16. 为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,小乐称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入稀盐酸100克(足量),每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表:
(1)、大理石中碳酸钙的质量分数为。(2)、m 的数值为。(3)、B 点的溶质为。(4)、计算 A 点溶质的质量分数。16. 为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,小乐称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入稀盐酸100克(足量),每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表:时间(分钟)
0
0.5
1.0
1.5
2.0
2.5
3.0
电子天平示数(克)
160
158.2
157
156.4
156.04
156.04
156.04
(1)、若产生的气体全部是鸡蛋壳中的碳酸钙与稀盐酸反应生成的CO2 , 根据实验结果计算出该鸡蛋壳中碳酸钙的质量分数(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)。(2)、下列哪些情况会导致实验中钙元素质量分数测量结果偏大? (选填字母)。A、盐酸溶质质量分数过大 B、鸡蛋壳未晾干 C、鸡蛋壳未充分研碎17. 实验室制取氧气时,某同学取一定质量的氯酸钾和二氧化锰混合,加热并进行测量记录,反应产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题: (反应的化学方程式为:2KClO3 2KCl+3O2↑)
 (1)、t0-t1和t4-t3时段固体质量都不变,为什么?(2)、请根据图中数据计算混合物中氯酸钾的质量多少?(写出计算过程)(3)、请在图乙的坐标中,画出固体中钾元素质量在t0-t5时段变化的示意图。18. 取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:(1)、生成氧气的质量?(2)、参加反应的氯酸钾的质量?(写出计算过程)(3)、氯化钾溶液的质量?(写出计算过程)19. 将30克氯酸钾与5克二氧化锰充分混合后加热,反应一段时间后冷却称量,测得剩余固体物质为25.4克。试分析回答:(反应的化学方程式为2KClO3 KCl+3O2↑)
(1)、t0-t1和t4-t3时段固体质量都不变,为什么?(2)、请根据图中数据计算混合物中氯酸钾的质量多少?(写出计算过程)(3)、请在图乙的坐标中,画出固体中钾元素质量在t0-t5时段变化的示意图。18. 取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:(1)、生成氧气的质量?(2)、参加反应的氯酸钾的质量?(写出计算过程)(3)、氯化钾溶液的质量?(写出计算过程)19. 将30克氯酸钾与5克二氧化锰充分混合后加热,反应一段时间后冷却称量,测得剩余固体物质为25.4克。试分析回答:(反应的化学方程式为2KClO3 KCl+3O2↑) (1)、此时,生成氧气多少克? 。(2)、试通过计算分析剩余固体物质的具体组成情况。(3)、在发生反应的过程中,二氧化锰在固体混合物中所占质量分数随时间的变化情况更接近于图中的 (选填字母)。20. 由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某科学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H 两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。(说明:浓硫酸能吸收水分,碱石灰可吸收水和二氧化碳)
(1)、此时,生成氧气多少克? 。(2)、试通过计算分析剩余固体物质的具体组成情况。(3)、在发生反应的过程中,二氧化锰在固体混合物中所占质量分数随时间的变化情况更接近于图中的 (选填字母)。20. 由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某科学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H 两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。(说明:浓硫酸能吸收水分,碱石灰可吸收水和二氧化碳)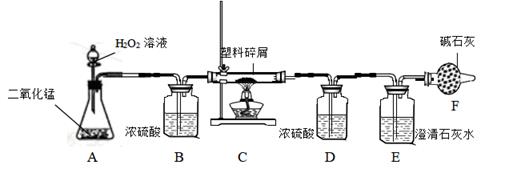 (1)、仪器A 中所发生的反应化学方程式为。(2)、若仪器 C 的玻璃管中放入的塑料试样质量为 bg,塑料试样完全燃烧后,若仪器 D 增重 ag,则该塑料试样中氢元素的质量分数为(计算结果可用分数形式表示)(3)、若装置中没有连接仪器 B,将使该塑料试样中氢元素的质量测算结果(选填“偏小”、“偏大”或“无影响”)。21. 为测定某石灰石矿中碳酸钙的含量,兴趣小组同学称取12.5g石灰石矿样品粉末于烧杯中,将80g稀盐酸分四次加入,充分反应,测得实验数据如下表所示(杂质不溶于水,也不参与反应,生成的气体全部逸出):
(1)、仪器A 中所发生的反应化学方程式为。(2)、若仪器 C 的玻璃管中放入的塑料试样质量为 bg,塑料试样完全燃烧后,若仪器 D 增重 ag,则该塑料试样中氢元素的质量分数为(计算结果可用分数形式表示)(3)、若装置中没有连接仪器 B,将使该塑料试样中氢元素的质量测算结果(选填“偏小”、“偏大”或“无影响”)。21. 为测定某石灰石矿中碳酸钙的含量,兴趣小组同学称取12.5g石灰石矿样品粉末于烧杯中,将80g稀盐酸分四次加入,充分反应,测得实验数据如下表所示(杂质不溶于水,也不参与反应,生成的气体全部逸出):第一次
第二次
第三次
第四次
加入稀盐酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
30.5
48.5
68.1
88.1
(1)、石灰石矿完全反应生成二氧化碳的总质量为g。(2)、该石灰石矿中碳酸钙的质量分数为多少?(写出计算过程)(3)、第三次实验结束后所得溶液中的溶质为 (填化学式)。22. 为了测定石灰石中碳酸钙的含量,小东进行了如下实验;取10.0g石灰石放于烧杯中,向烧杯中滴加稀盐酸,实验测得烧杯中剩余物质的质量与加入稀盐酸的质量之间的关系如图所示。整个过程不考虑稀盐酸的挥发和气体的溶解,石灰石中的杂质也不与稀盐酸反应。求: (1)、产生CO2的总质量为g。(2)、石灰石中碳酸钙的质量分数(写出计算过程)。23. 某纯碱样品中含有少量NaCl,小丽同学取该样品23g全部溶解于150g水中,再逐滴加入160g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示.(提示:相关反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑)
(1)、产生CO2的总质量为g。(2)、石灰石中碳酸钙的质量分数(写出计算过程)。23. 某纯碱样品中含有少量NaCl,小丽同学取该样品23g全部溶解于150g水中,再逐滴加入160g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示.(提示:相关反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑)计算当恰好完全反应时:
 (1)、产生的二氧化碳的质量是 克.(2)、此时所得到的溶液中溶质的质量分数(写出必要的计算过程,结果保留到0.1%)24. 我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25g样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示.
(1)、产生的二氧化碳的质量是 克.(2)、此时所得到的溶液中溶质的质量分数(写出必要的计算过程,结果保留到0.1%)24. 我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25g样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示.(1)求样品中碳酸钙的质量分数;
(2)所加稀盐酸的溶质质量分数.
 25. 在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示:
25. 在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示: (1)、100g稀盐酸中氯化氢的质量 .(2)、恰好完全反应后,所得溶液中溶质的质量分数?26. 工业上常用二氧化碳和氨气(化学式:NH3)反应来制取尿素[化学式:CO(NH2)2],该反应的化学方程式为:CO2+2NH3
(1)、100g稀盐酸中氯化氢的质量 .(2)、恰好完全反应后,所得溶液中溶质的质量分数?26. 工业上常用二氧化碳和氨气(化学式:NH3)反应来制取尿素[化学式:CO(NH2)2],该反应的化学方程式为:CO2+2NH3 CO(NH2)2+H2O,现生产240t尿素,需要氨气的质量为多少? 27. 将25g石灰石样品放入烧杯中(杂质既不溶于水也不参加反应),加入稀盐酸至恰好完全反应,共用去稀盐酸100g.烧杯内剩余物质的总质量为116.2g.请计算:(1)、生成二氧化碳的质量为 g.(2)、石灰石样品中碳酸钙的质量分数为多少?(3)、反应后所得溶液中溶质质量分数为多少?(结果保留至1%)28. 某纯碱样品中含有少量氯化钠,某同学称取11.4g样品放入烧杯中,向烧杯中加入73g稀盐酸.恰好完全反应后烧杯中剩余的总质量为80g(假设产生的气体全部逸出)(计算结果精确到0.1%).(1)、反应生成气体的质量为 g.(2)、样品中碳酸钠的质量是多少?(3)、反应后所得溶液中溶质质量分数是多少?29. 取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4g,将剩余固体加入一定量的水中,充分搅拌后过滤、滤液是10%的氯化钾溶液(假设溶液无损失).计算:
CO(NH2)2+H2O,现生产240t尿素,需要氨气的质量为多少? 27. 将25g石灰石样品放入烧杯中(杂质既不溶于水也不参加反应),加入稀盐酸至恰好完全反应,共用去稀盐酸100g.烧杯内剩余物质的总质量为116.2g.请计算:(1)、生成二氧化碳的质量为 g.(2)、石灰石样品中碳酸钙的质量分数为多少?(3)、反应后所得溶液中溶质质量分数为多少?(结果保留至1%)28. 某纯碱样品中含有少量氯化钠,某同学称取11.4g样品放入烧杯中,向烧杯中加入73g稀盐酸.恰好完全反应后烧杯中剩余的总质量为80g(假设产生的气体全部逸出)(计算结果精确到0.1%).(1)、反应生成气体的质量为 g.(2)、样品中碳酸钠的质量是多少?(3)、反应后所得溶液中溶质质量分数是多少?29. 取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4g,将剩余固体加入一定量的水中,充分搅拌后过滤、滤液是10%的氯化钾溶液(假设溶液无损失).计算:(1)生成氧气的质量.
(2)二氧化锰的质量.
(3)氯化钾溶液中水的质量.
30. 测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.(已知CaCO3+2HCl═CaCl2+H2O+CO2↑杂质不参与反应,也不溶于水) (1)、石灰石样品中碳酸钙的质量是 g;(2)、石灰石样品中碳酸钙的质量分数是 ;(3)、计算稀盐酸溶质的质量分数.
(1)、石灰石样品中碳酸钙的质量是 g;(2)、石灰石样品中碳酸钙的质量分数是 ;(3)、计算稀盐酸溶质的质量分数.
-