广东普宁勤建2020-2021学年九年级下学期化学第一次月考试卷
试卷更新日期:2021-05-08 类型:月考试卷
一、单选题(本大题包括15小题,共45分)
-
1. 下列过程中,不是化学变化的是( )A、铁锅生锈 B、煤的干馏 C、用酒精浸泡紫罗兰花自制酸碱指示剂 D、大米酿酒2. 安全始终处于第一位,安全无小事。下列常用危险化学品标志或与燃烧爆炸有关的图标中,表示错误的是( )A、剧毒品
 B、爆炸品
B、爆炸品  C、禁止放易燃物
C、禁止放易燃物  D、禁止吸烟
D、禁止吸烟  3. 下列关于“物质—在空气中燃烧的现象—所属基本反应类型”的描述正确的是( )A、硫—蓝紫色火焰—化合反应 B、木炭—红光—氧化反应 C、红磷—白烟—化合反应 D、石蜡—黄光—化合反应4. 下列化学用语书写正确的是( )A、2个氮原子-N2 B、钙离子-Ca+2 C、氯化铁-FeCl2 D、氦气-He5. 下列实验操作中,正确的是( )A、干燥氨气
3. 下列关于“物质—在空气中燃烧的现象—所属基本反应类型”的描述正确的是( )A、硫—蓝紫色火焰—化合反应 B、木炭—红光—氧化反应 C、红磷—白烟—化合反应 D、石蜡—黄光—化合反应4. 下列化学用语书写正确的是( )A、2个氮原子-N2 B、钙离子-Ca+2 C、氯化铁-FeCl2 D、氦气-He5. 下列实验操作中,正确的是( )A、干燥氨气 B、滴管用后不洗涤直接插回原瓶
B、滴管用后不洗涤直接插回原瓶  C、测定某溶液的pH
C、测定某溶液的pH  D、蒸发
D、蒸发  6. DHA (C22H32O2)是一种不饱和脂肪酸,俗称“脑黄金”,具有增强记忆与思维能力、提高智力等作用、下列关于DHA的说法中正确的是( )A、它是一种有机高分子化合物 B、DHA中氢、氧元素的质量比为1 : 1 C、它是由碳、氢、氧三种元素的原子构成 D、每一个DHA分子中含有56个质子7. 如图为钕在元素周期表中的相关信息,下列有关钕的说法正确的是( )
6. DHA (C22H32O2)是一种不饱和脂肪酸,俗称“脑黄金”,具有增强记忆与思维能力、提高智力等作用、下列关于DHA的说法中正确的是( )A、它是一种有机高分子化合物 B、DHA中氢、氧元素的质量比为1 : 1 C、它是由碳、氢、氧三种元素的原子构成 D、每一个DHA分子中含有56个质子7. 如图为钕在元素周期表中的相关信息,下列有关钕的说法正确的是( ) A、钕原子的质子数为60 B、钕的相对原子质量是144.2g C、钕原子核外有84个电子 D、钕属于非金属元素8. 实验室用氯化钠固体配制 100g 溶质质量分数为 8%的氯化钠溶液,下列说法中正确的是( )A、经计算,所需氯化钠的质量为 0.8g B、将氯化钠直接放在托盘天平的右盘称量 C、量筒量水时仰视读数会使配得的溶液溶质质量分数偏小 D、配制溶液时,所需玻璃仪器有烧杯、玻璃棒、酒精灯9. 控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
A、钕原子的质子数为60 B、钕的相对原子质量是144.2g C、钕原子核外有84个电子 D、钕属于非金属元素8. 实验室用氯化钠固体配制 100g 溶质质量分数为 8%的氯化钠溶液,下列说法中正确的是( )A、经计算,所需氯化钠的质量为 0.8g B、将氯化钠直接放在托盘天平的右盘称量 C、量筒量水时仰视读数会使配得的溶液溶质质量分数偏小 D、配制溶液时,所需玻璃仪器有烧杯、玻璃棒、酒精灯9. 控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )



A.探究铁、镁金属活动性强弱
B.探究二氧化碳与水是否发生反应
C.探究不同溶剂中物质溶解性大小
D.探究温度对分子运动快慢的影响
A、A B、B C、C D、D10. 如图是A、B、C为三种物质的溶解度曲线,下列说法错误的是( ) A、可用降温结晶法从A,C的固体混合物中提纯A B、t2℃时三种饱和溶液降温至t1℃,溶质质量分数:B>A=C C、若A,B,C中有一种是易溶气体溶解度曲线,那一定是C D、用同一种方法能将A,B,C的饱和溶液均变为不饱和溶液11. 下列对知识的归纳总结都正确的一组是( )
A、可用降温结晶法从A,C的固体混合物中提纯A B、t2℃时三种饱和溶液降温至t1℃,溶质质量分数:B>A=C C、若A,B,C中有一种是易溶气体溶解度曲线,那一定是C D、用同一种方法能将A,B,C的饱和溶液均变为不饱和溶液11. 下列对知识的归纳总结都正确的一组是( )A化学与生活
B化学与健康
①焙制糕点时可加入适量的碳酸氢钠
②用洗洁精清洗油污属于乳化现象
①使用铁锅做菜可以给人体补充铁元素
②青少年缺碘会患佝偻病和发育不良
C化学与安全
D化学与资源
①霉变的大米煮熟后可以食用
②点燃可燃性气体前需要验纯
①塑料、橡胶都属于合成材料
②可燃冰、风能、核能都属于新能源
A、A B、B C、C D、D12. 类推是学习中常用的思维方法,现在有以下类推结果,其中正确的是( )A、氮肥氯化铵与碱研磨可放出氨气,所以氮肥尿素与碱研磨也能放出氨气 B、金属铝有良好的抗腐蚀性,所以它的化学性质不活泼 C、某物质在氧气中燃烧生成水,所以该物质中一定含有氢元素 D、碱溶液能使紫色石蕊试液变蓝,所以能使石蕊试液变蓝的溶液一定是碱溶液13. 向AgNO3溶液中加入一定量的Mg粉和Fe粉,充分反应后过滤,得到滤渣和浅绿色的滤液.关于该滤渣和滤液有下列四种说法:①向滤渣中加入稀盐酸,一定有气泡产生; ②向滤液中加入稀盐酸一定有沉淀产生;
③滤渣中一定有Ag; ④滤液中一定有Fe(NO3)2、一定不含AgNO3、可能有Mg(NO3)2 .
以上说法中正确的个数为( )
A、1个 B、2 个 C、3个 D、4个14. 下列实验操作中不能达到实验目的的是( )选项
物质
目的
实验方案
A
FeCl3、NaOH、NaNO3三种溶液
鉴别
仅用组内物质鉴别
B
碳粉中混有氧化铜粉末
检验
取样,加入过量稀盐酸,观察现象
C
CaCl2 和 CaCO3的混合物
分离
溶解、过滤、洗涤固体并烘干,蒸发滤液
D
BaCl2 溶液混有 Ba(NO3)2 杂质
除杂
先加入过量 Na2SO4 溶液,过滤、洗涤;再向所得固体中加入适量稀盐酸
A、A B、B C、C D、D15. 下列图像分别与选项中的实验现象及结果相对应,其中正确的是( )A、电解水 B、向等质量的镁粉和铁粉中分别滴加同浓度的稀硫酸至过量
B、向等质量的镁粉和铁粉中分别滴加同浓度的稀硫酸至过量  C、向一定量的二氧化锰中加入过氧化氢溶液
C、向一定量的二氧化锰中加入过氧化氢溶液  D、一定温度时向一定量饱和石灰水中加入氧化钙
D、一定温度时向一定量饱和石灰水中加入氧化钙 
二、填空题(本大题包括2小题,共15分)
-
16. 化学与我们的生活生产息息相关,生活处处有化学。(1)、Ⅰ.化学与生活:
野炊食谱如下:主食:馒头;配菜:红烧肉、豆腐汤、牛肉干。从营养角度来看,你认为食谱中还应添加下列食品中的(填序号)。
A 黄瓜 B 面条 C 炒鸡蛋 D 糖醋鱼
(2)、(填“聚乙烯”或“聚氯乙烯”)薄膜可用于食品的包装。(3)、在引燃细枯枝后,如果迅速往“灶”里塞满枯枝,结果反而燃烧不旺,并产生很多浓烟,说明可燃物充分燃烧需要的条件是。(4)、山药中含有碱性皂角素,皮肤沾上会奇痒难耐。你认为可涂用厨房中的来止痒。(5)、Ⅱ.化学与生产:工业上规模制氮主要有三类。①深冷空气制氮。利用空气各成分的沸点不同,使液态空气中的氧气和氮气分离,液态氧的沸点是-183℃,液态氮的沸点是-196℃,则分离出来某气体后,剩下的主要是。
②变压吸附制氮。利用碳分子筛对氮气进行吸附,可见碳分子筛与一样具有疏松多孔的结构,可用于水的净化。
③膜分离制氮。利用中空纤维膜分离空气制取氮气。中空纤维膜还常用于自来水、地下水除菌除浊净化,使水中的微粒、细菌等不能通过滤膜而被去除。
(6)、Ⅲ.化学与新技术:12C、13C、14C分别表示碳元素的三种原子,可简写成12C、13C、14C。请据图回答:
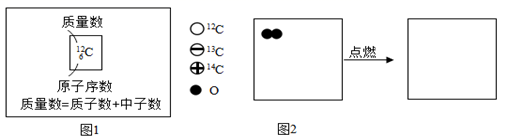
①12C、13C、14C三种原子中,数目不等(填“质子”或“中子”或“电子”)。
②12C与O2反应生成的一氧化碳可表示为12CO。写出13CO在O2中燃烧的化学方程式 , 在图2所示的小方框中,把13CO与O2反应的反应物和生成物微观粒子补画齐全。(画在答题卡上)
17. 钒:元素符号V,被誉为“现代工业的味精”,是发展现代工业、现代国防和现代科学技术不可缺少的重要材料,请回答下列问题:(1)、偏钒酸铵是最普通的钒酸盐,为白色晶体,其化学式为NH4VO3 , 灼烧分解生成V2O5 , 其化学反应方程式为: ,则X的化学式为。(2)、V2O5为黄色晶体、微溶于水、能溶于酸,与沸腾的浓盐酸反应产生氯气,反应方程式为: ,其中钒元素被还原为蓝色的氧钒离子(VO2+),该反应的现象为。(3)、工业上用接触法制硫酸时要用到V2O5 , 450℃时发生V2O5与VO2之间的转化,其反应可表示为: ,该循中V2O5所起的作用是 , 接触法制取硫酸过程中SO2和O2的质量比为(最简质量比)。三、(本大题包括2小题,共20分)
-
18. 根据如图回答问题。

 (1)、仪器a的名称为。(2)、用氯酸钾和二氧化锰制取并收集干燥的氧气,选用A和组合。实验中试管口要略向下倾斜的原因是 , 反应的化学方程式为。(3)、实验室制取CO2时,选A(具支试管换成试管)和组合作为发生装置,可控制反应发生和停止,反应的化学方程式为 , 为检验CO2 , 向一定量的澄清石灰水中不断地通入CO2 , 反应中各物质的质量变化如下面左图,反应进行到M点时,含钙元素的化合物有(写化学式)。
(1)、仪器a的名称为。(2)、用氯酸钾和二氧化锰制取并收集干燥的氧气,选用A和组合。实验中试管口要略向下倾斜的原因是 , 反应的化学方程式为。(3)、实验室制取CO2时,选A(具支试管换成试管)和组合作为发生装置,可控制反应发生和停止,反应的化学方程式为 , 为检验CO2 , 向一定量的澄清石灰水中不断地通入CO2 , 反应中各物质的质量变化如下面左图,反应进行到M点时,含钙元素的化合物有(写化学式)。
 (4)、如图所示的装置(夹持仪器已略去)中,打开K滴入
(4)、如图所示的装置(夹持仪器已略去)中,打开K滴入足量H2O2溶液后,马上关闭K,产生的现象和解释正确的是(填字母)。
A装置①中会产生气泡,黑色固体消失
B装置②中会有气泡冒出
C装置②中热水被压进③中,白磷与氧气接触后燃烧
D装置②中热水被压进③中,水降低了蜡烛的着火点导致蜡烛熄灭
19. “复兴号”化学动车组五节车厢A-E分别代表初中化学教材中五种常见物质,如图所示“→”表示相邻车厢的物质间转化关系(所涉及反应均为初中常见的化学反应)。其中A是用于医疗急救的气体,B是黑色固体,D、E是显碱性的不同类别物质,且D广泛用于玻璃和洗涤剂生产。 (1)、B的化学式为可能有两种分别是;;
(1)、B的化学式为可能有两种分别是;;
C的化学式;E的化学式;(2)、B→C的化学方程式(其中一个)D→E反应的化学方程式为。(3)、图中转化关系中一定没有涉及的基本反应类型是。(4)、只有能与门两边的“车厢”都反应的“旅客”才可从此门上车,则“旅客”盐酸可以从顺利上车(填序号) ①门1 ②门2 ③门3 ④门4四、(本大题包括1小题,共10分)
-
20. 工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
物质
K2CO3
K2SO4
KMnO4
溶解度/g
111
11.1
6.34
(1)、KMnO4中锰元素的化合价为。(2)、操作Ⅰ的名称是。该过程中用到的玻璃棒的作用为:。(3)、“通CO2酸化”,反应的化学方程式为: , 若用稀H2SO4酸化,反应的化学方程式为:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O,工业上不采用稀H2SO4酸化的原因是。(4)、电解法也可以实现由向K2MnO4向KMnO4的转化,反应的化学方程式为:2K2MnO4+2H2O 2KMnO4+2KOH十H2↑与“通CO2酸化”相比,其优点是:。(5)、通过该工艺流程还可以获得副产品K2CO3。某化学兴趣小组在模拟该工艺流程提取K2CO3的过程中,不小心混入了KOH,为检验K2CO3中的KOH:取样,加溶液,再滴加 ,若观察到现象,则有KOH。五、(本大题包括1小题,共10分)
-
21. 实验室制取二氧化硫的化学方程式为 。(1)、用63g亚硫酸钠与过量的浓硫酸反应,试求最多可生成二氧化硫的质量是多少? (请写出计算过程)(2)、测得上述反应完成后的残留混合物中含24.5g H2SO4 , 若用含Ca( OH)2 92.5%的熟石灰(所含杂质不与H2SO4反应)进行中和处理,请在下图坐标系中自行设定纵轴为溶液中某物质(盐或酸)的质量,画出其随熟石灰加入而变化的曲线图(图中标出必要的数据)。
 (3)、实验室也能用铜与浓硫酸在加热条件下反应制备二氧化硫,反应的化学方程式为 。若用50g 98%的浓硫酸与过量的铜充分反应,生成二氧化硫的质量(填“>”、“=”或“<”)16g,原因是。
(3)、实验室也能用铜与浓硫酸在加热条件下反应制备二氧化硫,反应的化学方程式为 。若用50g 98%的浓硫酸与过量的铜充分反应,生成二氧化硫的质量(填“>”、“=”或“<”)16g,原因是。
-