中考二轮专题复习:金属 (优生加练)
试卷更新日期:2021-04-30 类型:二轮复习
一、单选题
-
1. 某溶液含有 Cu(NO3)2 和 AgNO3 , 现向其中加入一定量的锌粉进行处理,并绘制参加反应的锌与溶液中溶质种类的关系图(如图所示),下列说法中不正确的是( )
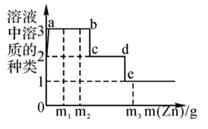 A、Cu 的活动性比 Ag 强,只用盐酸无法探究两者活动性强弱 B、当溶质种类为1种时,金属单质种类可能为2种 C、c~d 间(不含两点)的溶液中金属离子为 Zn2+、Cu2+ D、从 m1 变化到 m2 时,溶液中硝酸铜的质量分数不变2. 下列图像分别与选项中的操作相对应,其中合理的是( )A、 相同质量的镁、锌跟足量的稀硫酸反应制取氢气
A、Cu 的活动性比 Ag 强,只用盐酸无法探究两者活动性强弱 B、当溶质种类为1种时,金属单质种类可能为2种 C、c~d 间(不含两点)的溶液中金属离子为 Zn2+、Cu2+ D、从 m1 变化到 m2 时,溶液中硝酸铜的质量分数不变2. 下列图像分别与选项中的操作相对应,其中合理的是( )A、 相同质量的镁、锌跟足量的稀硫酸反应制取氢气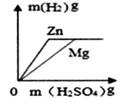 B、 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
B、 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸  C、 在一定质量的稀硫酸中,逐渐加入氢氧化钡溶液
C、 在一定质量的稀硫酸中,逐渐加入氢氧化钡溶液 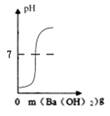 D、向一定温度下的饱和氢氧化钙溶液中加入氧化钙
D、向一定温度下的饱和氢氧化钙溶液中加入氧化钙  3. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是( )
3. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是( )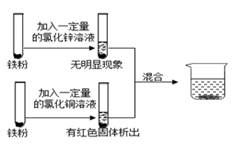 A、由实验可判断出铁、铜、锌的活动性顺序 B、两支试管混合后,固体总质量一定增加 C、滤液中的溶质一定有FeCl2、ZnCl2和CuCl2 D、滤渣中一定有Cu,一定没有Fe和Zn4. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A、由实验可判断出铁、铜、锌的活动性顺序 B、两支试管混合后,固体总质量一定增加 C、滤液中的溶质一定有FeCl2、ZnCl2和CuCl2 D、滤渣中一定有Cu,一定没有Fe和Zn4. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )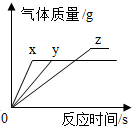 A、图线 Y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大 试题卷 Ⅱ5. 向等质量的锌粉和铁粉中加入过量的稀硫酸,下列图像能正确反映其对应关系的是( )A、
A、图线 Y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大 试题卷 Ⅱ5. 向等质量的锌粉和铁粉中加入过量的稀硫酸,下列图像能正确反映其对应关系的是( )A、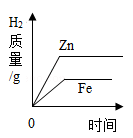 B、
B、 C、
C、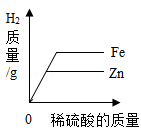 D、
D、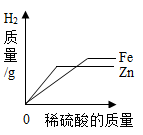 6. 根据金属与酸反应的知识绘制了如下关系图,下列选项正确的是( )A、表示向等浓度、等质量的盐酸中逐渐加入铝粉和铁粉
6. 根据金属与酸反应的知识绘制了如下关系图,下列选项正确的是( )A、表示向等浓度、等质量的盐酸中逐渐加入铝粉和铁粉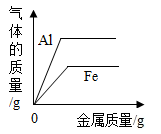 B、表示向等浓度、等质量的盐酸中逐渐加入铝粉和铁粉
B、表示向等浓度、等质量的盐酸中逐渐加入铝粉和铁粉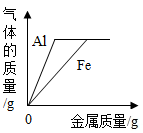 C、表示向等质量的锌粉和铁粉中逐渐加入等浓度的稀盐酸
C、表示向等质量的锌粉和铁粉中逐渐加入等浓度的稀盐酸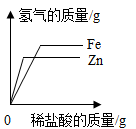 D、表示向等浓度、等质量的盐酸中加入等质量的铁粉和锌粉
D、表示向等浓度、等质量的盐酸中加入等质量的铁粉和锌粉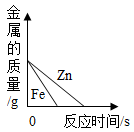 7. 在硝酸铜、硝酸锌和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液。下列结论中正确的是( )A、如果滤渣中有铁粉,则滤液中一定没有硝酸铜、硝酸银 B、如果滤渣中有铜粉,则滤液中一定没有硝酸铜 C、如果滤渣中没有铜粉,则滤液中一定没有硝酸银 D、如果滤渣中没有铁粉,则滤液中一定有硝酸铜、硝酸亚铁、硝酸锌8. 下列图像能正确反映对应变化关系的个数是( )
7. 在硝酸铜、硝酸锌和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液。下列结论中正确的是( )A、如果滤渣中有铁粉,则滤液中一定没有硝酸铜、硝酸银 B、如果滤渣中有铜粉,则滤液中一定没有硝酸铜 C、如果滤渣中没有铜粉,则滤液中一定没有硝酸银 D、如果滤渣中没有铁粉,则滤液中一定有硝酸铜、硝酸亚铁、硝酸锌8. 下列图像能正确反映对应变化关系的个数是( )
①红磷在密闭容器中燃烧
②盐酸和硫酸钠的混合溶液中逐滴加入氢氧化钡溶液
③等质量、等质量分数的稀硫酸中分别加入过量锌粉和铁粉
④一定质量的稀盐酸中,逐滴加入与稀盐酸等质量、等质量分数的氢氧化钠溶液
A、1个 B、2个 C、3个 D、4个9. 在溶质为Cu(NO3)2、AgNO3和Al(NO3)3的溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。下列判断正确的是( )A、向滤渣中加入稀盐酸可能有气泡产生 B、滤渣中一定有Ag,可能有Cu和Zn C、滤液中一定无AgNO3 D、滤液中可能有四种金属离子10. 向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:①向滤渣中加入稀盐酸,一定有气泡产生。②向滤液中加入稀盐酸,一定有沉淀产生。 ③滤渣中一定含有Ag,可能有Fe。 ④滤液中一定含有Fe(NO3)2 , 一定不含AgNO3 , 可能含有Al(NO3)3。以上说法正确的个数为( )
A、0个 B、1个 C、2个 D、3个11. 为了探究金属与盐溶液的反应规律,将一定质量的锌粉和银粉加入Cu(NO3)2溶液中,充分反应,实验过程及实验现象如图所示,则下列判断中正确的是( ) A、滤液中可能含有Ag+ B、滤渣中可能含有单质锌 C、滤液中一定含有Cu2+ D、滤渣中一定含有单质铜12. 向硝酸铜、硝酸银和硝酸铝的混合溶液中加入一定质量的锌粉,充分反应后,过滤,得到滤渣和滤液。以下判断正确的是( )A、若滤液为蓝色,则滤渣中一定有银和铜 B、若向滤液中加入稀盐酸无白色沉淀生成,则滤液中一定没有硝酸铜 C、若向滤渣中加入稀盐酸有气体产生,则滤液中只含有硝酸铝和硝酸锌 D、若反应前加入的锌粉质量和反应后滤渣的质量相等,则滤渣中一定不含锌粉和铝粉13. 甲、乙两烧杯内盛有等质量、等质量分数的盐酸.将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△M,画出△M﹣m曲线oac和obc的示意图,如图所示.根据图中信息,下列说法错误的是( )
A、滤液中可能含有Ag+ B、滤渣中可能含有单质锌 C、滤液中一定含有Cu2+ D、滤渣中一定含有单质铜12. 向硝酸铜、硝酸银和硝酸铝的混合溶液中加入一定质量的锌粉,充分反应后,过滤,得到滤渣和滤液。以下判断正确的是( )A、若滤液为蓝色,则滤渣中一定有银和铜 B、若向滤液中加入稀盐酸无白色沉淀生成,则滤液中一定没有硝酸铜 C、若向滤渣中加入稀盐酸有气体产生,则滤液中只含有硝酸铝和硝酸锌 D、若反应前加入的锌粉质量和反应后滤渣的质量相等,则滤渣中一定不含锌粉和铝粉13. 甲、乙两烧杯内盛有等质量、等质量分数的盐酸.将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△M,画出△M﹣m曲线oac和obc的示意图,如图所示.根据图中信息,下列说法错误的是( ) A、m1:m2=3:7 B、m1﹣△M1<m2﹣△M2 C、曲线oac表示的是甲烧杯中△M与m的变化关系 D、当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种14. 下图表示Fe、Zn、Mg、Al分别跟稀盐酸反应制取氢气的质量(m)与所用的金属质量(M)之间的关系图,其中正确的是( )A、
A、m1:m2=3:7 B、m1﹣△M1<m2﹣△M2 C、曲线oac表示的是甲烧杯中△M与m的变化关系 D、当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种14. 下图表示Fe、Zn、Mg、Al分别跟稀盐酸反应制取氢气的质量(m)与所用的金属质量(M)之间的关系图,其中正确的是( )A、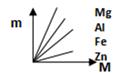 B、
B、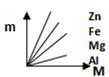 C、
C、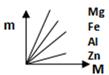 D、
D、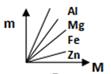 15. 向一定质量的 Mg(NO3)2、AgNO3 和Cu(NO3)2 的混合溶液中加入 mg Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的固体质量为 mg。据此下列说法正确的( )
15. 向一定质量的 Mg(NO3)2、AgNO3 和Cu(NO3)2 的混合溶液中加入 mg Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的固体质量为 mg。据此下列说法正确的( )①滤渣的组成可能有三种情况 ②取反应后的滤液观察,滤液可能呈蓝色 ③取反应后的滤渣,向其 中滴加硝酸银溶液,溶液一定变成蓝色 ④反应前后溶液质量保持不变(忽略过滤等操作的影响) ⑤滤液中一定有硝酸锌和硝酸镁,一定没有硝酸银和硝酸铜 ⑥取反应后的滤渣,向其中滴加稀硫酸, 可能有气泡产生
A、①②③ B、①④⑤ C、③⑤⑥ D、②④⑥16. 将一定量金属 M 加入 ZnSO4 和 CuSO4的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中滴加稀盐酸有气泡产生。下列有关判断正确的是 ( )A、金属活动性:M>Zn>Cu B、滤液中可能只含有一种溶质 C、滤渣中一定含有金属 M D、该过程一定发生了如下反应:M+CuSO4=Cu+MSO417. 相同质量的 Mg、Fe 分别与稀盐酸作用,产生 H2 的质量 m(H2)与加入稀盐酸的体积V(稀盐酸)关系如图所示,其中正确的是 ( )A、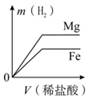 B、
B、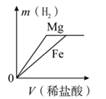 C、
C、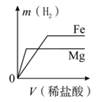 D、
D、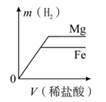 18. 如图在天平两边的烧杯中分别盛有等质量、等质量分数的足量的稀硫酸,然后向左、右两边的烧杯中分别加入X、Y 两种等质量的金属,发现天平的指针先偏向左边,最后偏向右边,则 X、Y 可能是 ( )
18. 如图在天平两边的烧杯中分别盛有等质量、等质量分数的足量的稀硫酸,然后向左、右两边的烧杯中分别加入X、Y 两种等质量的金属,发现天平的指针先偏向左边,最后偏向右边,则 X、Y 可能是 ( )
A
B
C
D
X:Mg
X:Fe
X:Cu
X:Mg
Y:Al
Y:Zn
Y:Fe
Y:Fe
A、A B、B C、C D、D19. 将6g不纯锌(含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g.则M、N可能是( )A、M为Mg,N为Cu B、M为Fe,N为Al C、M为Al,N为Na D、N为Cu,N为Zn20. 用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应。产生氢气的质量和反应所用时间的关系如图所示。则下列说法不正确的是( )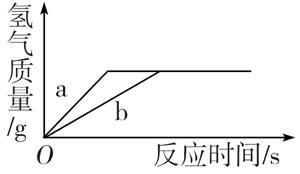 A、曲线a、b分别表示锌、铁的反应情况 B、盐酸均反应完,锌、铁可能均有剩余 C、盐酸均反应完,锌可能恰好完全反应,铁有剩余 D、锌、铁都反应完,盐酸有剩余
A、曲线a、b分别表示锌、铁的反应情况 B、盐酸均反应完,锌、铁可能均有剩余 C、盐酸均反应完,锌可能恰好完全反应,铁有剩余 D、锌、铁都反应完,盐酸有剩余二、填空题
-
21. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入6.5克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为6.5克。取反应后的滤液观察,滤液 (填“一定”、“一定不”或“可能”)呈蓝色,滤渣中的物质一定有。22. 铜、铁、铝是生活中常见的金属,请回答:(1)、黄铜是铜锌合金,其硬度比纯铜(选填“大”或“小”)。(2)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的 。(3)、用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 。(选填字母代号)
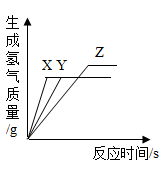 A、曲线 X、Y、Z分别表示锌、铁、镁的反应情况 B、反应后一定有剩余的金属是镁 C、反应后可能没有剩余的金属是锌和铁23. 小柯进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定质量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。(1)、若反应后所得滤液呈无色,则滤渣中一定含有。(2)、反应后所得溶液与原硝酸银溶液的质量相比,质量(填“变大”,“变小”,“无法确定”)(3)、非金属单质也具有类似金属与盐溶液之间反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来。如在溶液中可发生下列反应: Cl2+2NaBr=2NaCl+Br2 , I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2。由此可以判断非金属单质S、Cl2、I2、Br2活动性由强到弱顺序是。24. 质量相等的四种物质①H2O2、②KMnO4、③KClO3、④H2O,完全分解后所制得氧气的质量由大到小的顺序为(填序号,下同);四种金属①Zn、②Mg、③Al、④Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,则投入金属的质量由小到大的顺序为。25. 铁、锌、镁是生活中常见的金属,请回答:(1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的水蒸气和氧气,生成氢氧化亚铁等物质,该过程主要发生了变化。(2)、三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是。
A、曲线 X、Y、Z分别表示锌、铁、镁的反应情况 B、反应后一定有剩余的金属是镁 C、反应后可能没有剩余的金属是锌和铁23. 小柯进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定质量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。(1)、若反应后所得滤液呈无色,则滤渣中一定含有。(2)、反应后所得溶液与原硝酸银溶液的质量相比,质量(填“变大”,“变小”,“无法确定”)(3)、非金属单质也具有类似金属与盐溶液之间反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来。如在溶液中可发生下列反应: Cl2+2NaBr=2NaCl+Br2 , I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2。由此可以判断非金属单质S、Cl2、I2、Br2活动性由强到弱顺序是。24. 质量相等的四种物质①H2O2、②KMnO4、③KClO3、④H2O,完全分解后所制得氧气的质量由大到小的顺序为(填序号,下同);四种金属①Zn、②Mg、③Al、④Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,则投入金属的质量由小到大的顺序为。25. 铁、锌、镁是生活中常见的金属,请回答:(1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的水蒸气和氧气,生成氢氧化亚铁等物质,该过程主要发生了变化。(2)、三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是。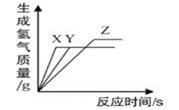
A .曲线X、Y、Z分别表示镁、锌、铁的反应情况
B .三份稀盐酸可能都被完全反应
C .三种金属的质量关系一定是m镁<m锌<m铁
D .反应结束后锌和镁一定都没有剩余,铁可能有剩余
26. 甲、乙两烧杯内盛有等质量、等质量分数的盐酸.小金同学将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△m,画出△M-m曲线oac和obc的示意图,如图所示.根据图中信息,曲线oac表示的是烧杯中△M与m的变化关系(填“甲”或“乙”),当乙烧杯内加入铁的质量为m1时,溶液中溶质还有。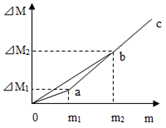 27. 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动。杠杆两端分别悬挂100 g等体积的Mg金属球和Fe金属球,此时杠杆平衡。再将两球同时分别浸没到100 g质量分数为9.8%的稀硫酸中,反应过程中金属球排开液体的体积及杯内液体密度变化忽略不计。则可观察到:
27. 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动。杠杆两端分别悬挂100 g等体积的Mg金属球和Fe金属球,此时杠杆平衡。再将两球同时分别浸没到100 g质量分数为9.8%的稀硫酸中,反应过程中金属球排开液体的体积及杯内液体密度变化忽略不计。则可观察到: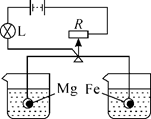 (1)、反应过程中溶液变色的是(填“左边”或“右边”)的烧杯。(2)、从反应开始到结束,灯泡L的亮暗情况为。28. 向盛有一定质量AgNO3和Cu(NO3)2混合溶液的试管中加入Zn,溶液质量与加入Zn的质量关系如图所示,试回答:
(1)、反应过程中溶液变色的是(填“左边”或“右边”)的烧杯。(2)、从反应开始到结束,灯泡L的亮暗情况为。28. 向盛有一定质量AgNO3和Cu(NO3)2混合溶液的试管中加入Zn,溶液质量与加入Zn的质量关系如图所示,试回答: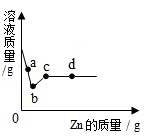 (1)、试写出ab段反应的化学方程式;(2)、若整个过程分为ab段、bc段和cd段,则试管中哪两段相应物质在加入稀盐酸时分别会有白色沉淀、气泡产生的是(选填);
(1)、试写出ab段反应的化学方程式;(2)、若整个过程分为ab段、bc段和cd段,则试管中哪两段相应物质在加入稀盐酸时分别会有白色沉淀、气泡产生的是(选填);①ab、bc ②bc、cd ③ab、cd
29. 将足量的稀盐酸加入一定量的锌、铜混合物中,写出其中反应的化学方程式。下图是实验过程生成气体或剩余固体的质量随反应时间的变化关系图,其中表示正确的是(填选项)。A.
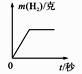 B.
B. 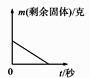 C.
C.  30. 已知氯气的氧化性很强,与金属发生反应一般生成高价态的金属氯化物。现有铜、铝、镁、铁、锌五种金属中的两种组成的混合物,取该混合物4g与足量的氯气反应后,固体质量增加7.1g;等质量的该金属混合物投入足量的盐酸中,产生氢气0.2g。金属混合物的组成情况可能有种,分别为。
30. 已知氯气的氧化性很强,与金属发生反应一般生成高价态的金属氯化物。现有铜、铝、镁、铁、锌五种金属中的两种组成的混合物,取该混合物4g与足量的氯气反应后,固体质量增加7.1g;等质量的该金属混合物投入足量的盐酸中,产生氢气0.2g。金属混合物的组成情况可能有种,分别为。三、解答题
-
31.(1)、向等质量,等浓度的稀硫酸中分别逐渐加入过量的锌粉和铁粉,请大致画出氢气质量(纵坐标)与加入金属的质量(横坐标)的图,并简要说明理由。
 (2)、如上右图所示,用同一个动滑轮先后提升同一物体、使物体以相同的速度匀速上升相同的高度,所用的力分别是F甲和F乙 , 拉力做功的功率分别是P甲和P乙。若不计摩擦、动滑轮重和绳重,则P甲与P乙之间的大小关系是 , 并简要说明理由。
(2)、如上右图所示,用同一个动滑轮先后提升同一物体、使物体以相同的速度匀速上升相同的高度,所用的力分别是F甲和F乙 , 拉力做功的功率分别是P甲和P乙。若不计摩擦、动滑轮重和绳重,则P甲与P乙之间的大小关系是 , 并简要说明理由。A.P甲=P乙
B.P甲>P乙
D.P甲<P乙
(3)、龟兔赛跑新传:龟兔赛跑结束后,返回途中捡到半个大西瓜(如图),都想独吃,互不相让。争论的结果是:谁的体重大谁吃。可没有弹簧测力计怎么办?这时来了一只老山羊,知道情况后便说:“这好办,你们两个各蹲在西瓜的一边,就可以看出哪个重些”。于是兔、龟分别蹲到西瓜的一边,结果西瓜还在水平位置平衡。老山羊又说:“ 你们各自向中间移动相等的距离看看”,结果乌龟那边上翘了。兔子很高兴,说:“怎么样,还是我重吧!西瓜归我。”老山羊说:“不对,应该给乌龟。”请你用所学的杠杆知识分析,老山羊的话有道理吗?这个西瓜到底归谁呢?请用公式推导说出你的理由。(西瓜的质量不计。提示:设兔子重为G1 , 乌龟重G2 , 刚开始蹲在西瓜的一边时,兔子重力的力臂为L1 , 乌龟重力的力臂为L2 , 后来两者分别向中间移动距离为△L) 32. 在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实验室,进行了如下实验和分析。(相关反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑)
32. 在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实验室,进行了如下实验和分析。(相关反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑) (1)、取少量“银粉”于试管中,滴加适量盐酸,观察到有产生,说明“银粉”一定不是银。(2)、为了进一步确定“银粉”是铝还是锌,学习小组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。在绘制锌的图像时,a点所对应的锌的质量m为多少?(通过计算回答)(3)、取1.8g“银粉”(杂质忽略不计)加入到50g稀硫酸中,恰好完全反应,生成氢气0.2g。根据图可知,“银粉”是 ▲ 。计算实验中所用稀硫酸的溶质质量分数。(4)、上述稀硫酸若用密度为1.84g/cm3 , 浓度为98%的浓硫酸稀释,则需要多少毫升这样的浓硫酸?33. Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
(1)、取少量“银粉”于试管中,滴加适量盐酸,观察到有产生,说明“银粉”一定不是银。(2)、为了进一步确定“银粉”是铝还是锌,学习小组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。在绘制锌的图像时,a点所对应的锌的质量m为多少?(通过计算回答)(3)、取1.8g“银粉”(杂质忽略不计)加入到50g稀硫酸中,恰好完全反应,生成氢气0.2g。根据图可知,“银粉”是 ▲ 。计算实验中所用稀硫酸的溶质质量分数。(4)、上述稀硫酸若用密度为1.84g/cm3 , 浓度为98%的浓硫酸稀释,则需要多少毫升这样的浓硫酸?33. Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:实验编号
①
②
③
④
NaOH溶液质量/g
10.0
20.0
30.0
40.0
Mg(OH)2质量/g
0.232
0.522
0.580
0.580
 (1)、实验(填实验编号)中硫酸镁完全反应。(2)、计算100克混合溶液中含MgSO4的质量(写出计算过程)。(3)、分析实验数据,在图中,画出加入4% NaOH溶液质量0﹣30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。(不需要写出计算过程)34. 往80g含有硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,加入的镁粉的量与溶液质量变化如图所示。试分析计算:
(1)、实验(填实验编号)中硫酸镁完全反应。(2)、计算100克混合溶液中含MgSO4的质量(写出计算过程)。(3)、分析实验数据,在图中,画出加入4% NaOH溶液质量0﹣30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。(不需要写出计算过程)34. 往80g含有硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,加入的镁粉的量与溶液质量变化如图所示。试分析计算: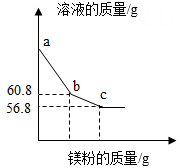 (1)、a→b段表示镁粉与混合溶液中的反应。(填化学式)(2)、原混合溶液中硝酸铜的质量分数是多少?(写出计算过程,精确到0.1%)35. 科学兴趣小组探究金属的性质时,将24g相同表面积的镁铜合金,均分成两等份,分别滴加体积相同、溶质质量分数不同的稀盐酸,在一定条件下反应,测得气压变化如图甲所示。
(1)、a→b段表示镁粉与混合溶液中的反应。(填化学式)(2)、原混合溶液中硝酸铜的质量分数是多少?(写出计算过程,精确到0.1%)35. 科学兴趣小组探究金属的性质时,将24g相同表面积的镁铜合金,均分成两等份,分别滴加体积相同、溶质质量分数不同的稀盐酸,在一定条件下反应,测得气压变化如图甲所示。 (1)、对比图甲中a、b曲线,引起a曲线压强增大速度明显快于b的因素可能是。(列举一点即可)(2)、其中有一组实验是滴加7.3%稀盐酸,产生氢气的质量随加入盐酸的质量变化情况如图乙所示。①图乙中当刚好生成0.4g氢气时,所得溶液中溶质的质量分数为多少?(计算结果保留至 0.1%)②将图乙中C点对应的溶液过滤,向滤液中逐滴加入过量氢氧化钠溶液。在图丙中标出生氢氧化镁沉淀质量随滴加氢氧化钠质量的大致变化曲线。(图中不需注明具体相关质量)
(1)、对比图甲中a、b曲线,引起a曲线压强增大速度明显快于b的因素可能是。(列举一点即可)(2)、其中有一组实验是滴加7.3%稀盐酸,产生氢气的质量随加入盐酸的质量变化情况如图乙所示。①图乙中当刚好生成0.4g氢气时,所得溶液中溶质的质量分数为多少?(计算结果保留至 0.1%)②将图乙中C点对应的溶液过滤,向滤液中逐滴加入过量氢氧化钠溶液。在图丙中标出生氢氧化镁沉淀质量随滴加氢氧化钠质量的大致变化曲线。(图中不需注明具体相关质量)四、实验探究题
-
36. 某兴趣小组为探究锡纸中的金属成分(锡纸中以一种金属为主,其它成分对实验无干扰),开展了以下探究活动。
【提出问题】锡纸中的金属是什么?
【建立猜想】根据锡纸有银白色金属光泽,并结合金属活动性、价格等因素,猜想其中的金属可能是锌、铁、铝、锡中的一种。
(1)、【探究过程】步骤 活动内容 收集证据 分析并得出结论 步骤一 ①查阅资料:金属锌在室温下很脆
②取锡纸反复折叠锡纸未破损 锡纸中金属不是锌 步骤二 用磁铁靠近锡纸 锡纸没有被磁铁吸引 锡纸中金属不是
步骤三 ①取锡纸条放入浓度为20%的盐酸中除去可能存在的氧化膜。当观察到现象时,取出锡纸条并用蒸馏水清洗。
②将处理过的锡纸条放入试管中,加入饱和硫酸锌溶液,静置观察。②中锡纸条表面无明显现象 说明锡纸中的金属活动性比锌弱,则锡纸中金属不是铝,而是锡 (2)、【交流评价】小科对实验结论提出质疑:“无明显现象”并不代表没有发生反应,因为铝与硫酸锌反应[2Al+3ZnSO4=3Zn+Al2(SO4)3]生成的金属锌为银白色,与铝颜色相同,因此无法得出结论。请在不改变化学反应的前提下增加定量实验完善实验方案,并根据预期结果得出相应结论:。37. 金属材料广泛应用于生产生活中。(1)、常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是。(2)、铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为。(3)、向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质:(写化学式)。(4)、铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式:。
②冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是t(结果精确到0.1)。
(5)、含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为g。38. 古往今来,金属材料和制品在我们的社会生活中一直起着非常重要的作用。(1)、考古工作者发现铁质的出土文物往往锈蚀严重,铁生锈的条件是。在实验室常用稀盐酸清除铁锈,化学方程式为。(2)、近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有的优越性能(要求只答一条)。(3)、某同学在实验室进行了两个有关金属性质的实验:实验Ⅰ:硫酸铝溶液和铁粉混合;
实验Ⅱ:硫酸铜溶液与铁粉混合。
在上述两个实验结束后,该同学将实验Ⅰ和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多,原因是(用文字说明)。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。那么,滤液中所含金属离子的情况可能是 (填序号)。
①Al3+②Al3+、Fe2+③Al3+、Fe3+
④Fe2+、Cu2+⑤Al3+、Fe2+、Cu2+
39. 为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如图)。他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反应。在相同条件下测定不同时间内收集 到的气体体积,实验记录如下表:反应时间(秒)
20
40
60
80
100
120
140
收集到的气体体积(毫升)
甲金属
25
60
95
130
160
170
170
乙金属
30
75
120
150
150
150
150
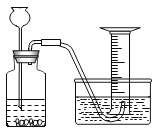 (1)、由实验结果可知:金属活动性较强的是。(2)、为使得到的实验数据准确,小吴开始收集气体的时间点应该是________。A、导管口一有气泡冒出时 B、冒出气泡连续且均匀时 C、检验产生的气体纯净时(3)、根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道_______。A、参加反应的硫酸质量 B、生成物中金属元素的化合价40. 小李同学为探究影响金属与酸反应剧烈程度的因素时,进行了如下实验: 步骤 1:调节天平平衡;
(1)、由实验结果可知:金属活动性较强的是。(2)、为使得到的实验数据准确,小吴开始收集气体的时间点应该是________。A、导管口一有气泡冒出时 B、冒出气泡连续且均匀时 C、检验产生的气体纯净时(3)、根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道_______。A、参加反应的硫酸质量 B、生成物中金属元素的化合价40. 小李同学为探究影响金属与酸反应剧烈程度的因素时,进行了如下实验: 步骤 1:调节天平平衡;步骤 2:将等质量,质量分数都为 10%的稀盐酸倒入烧杯内,分别放在天平的左右两盘; 步骤 3:将等质量的锌粉和铁粉分别放入左,右烧杯内,观察天平的平衡情况;
步骤 4:根据观察到的现象,得出结论。
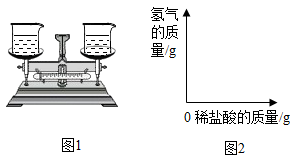 (1)、根据实验,我们会观察到,天平开始会向倾斜。由此可以得出什么结论。(2)、利用天平,我们还可以计算出,金属与酸反应产生的氢气的质量,从而建立相应的坐标关系。如图2是小李做出的等质量的铁和锌与稀盐酸反应的坐标图,请帮他补充完整。
(1)、根据实验,我们会观察到,天平开始会向倾斜。由此可以得出什么结论。(2)、利用天平,我们还可以计算出,金属与酸反应产生的氢气的质量,从而建立相应的坐标关系。如图2是小李做出的等质量的铁和锌与稀盐酸反应的坐标图,请帮他补充完整。