中考二轮专题复习:金属 (中等难度)
试卷更新日期:2021-04-30 类型:二轮复习
一、单选题
-
1. 下列图像分别对应四个变化过程的一种趋势,其中正确的图像个数有 ( )

①图甲,在一定量Fe(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入铁粉
②图乙,向等质量的锌粉和铁粉中,分别加入足量且相同质量分数的稀盐酸
③图丙,在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
④图丁,向质量和质量分数都相等的稀盐酸中分别加入足量的锌粉和铁粉
A、1 个 B、2 个 C、3 个 D、4 个2. XSO4可溶于水,金属x在金属活动顺序表中的位置如图所示。则下列化学方程式错误的是( ) A、X+H2SO4=XSO4+H2↑ B、Mg+XSO4=MgSO4+X C、Fe+XSO4=FeSO4+X D、X+CuSO4=XSO4+Cu3. 钯、镍、铜在电子工业中有广泛应用。小明想比较这三种金属的活动性强弱,做了如图所示实验,只有实验④有明显的现象。则这三种金属的活动性顺序排序正确的是( )
A、X+H2SO4=XSO4+H2↑ B、Mg+XSO4=MgSO4+X C、Fe+XSO4=FeSO4+X D、X+CuSO4=XSO4+Cu3. 钯、镍、铜在电子工业中有广泛应用。小明想比较这三种金属的活动性强弱,做了如图所示实验,只有实验④有明显的现象。则这三种金属的活动性顺序排序正确的是( ) A、铜>镍>钯 B、铜>钯>镍 C、镍>钯>铜 D、镍>铜>钯4. 下列实验操作能达到实验目的是( )
A、铜>镍>钯 B、铜>钯>镍 C、镍>钯>铜 D、镍>铜>钯4. 下列实验操作能达到实验目的是( )选项
实验目的
实验操作
A
区别稀盐酸和稀硫酸
滴加硝酸银溶液
B
除去二氧化碳中的一氧化碳杂质
通入氧气并点燃
C
回收氯酸钾制氧气后的二氧化锰
溶解、过滤、洗涤、干燥
D
比较Fe、Cu、Ag的金属活动性强弱
将两根铁丝分别浸入CuSO4溶液和AgNO3溶液
A、A B、B C、C D、D5. 科技人员成功研制出新型催化剂,可将二氧化碳转化成液体燃料,反应的微示意图如图。有关该反应的说法正确的是( )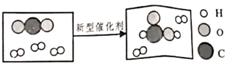 A、反应前后分子的种类和数目都不变 B、反应前碳元素的化合价为+2价 C、该反应的基本类型为置换反应 D、反应物与生成物的粒子个数比为1:1:16. 人类用于制造触屏材料的铟,相关信息如图,下列说法中正确的是( )
A、反应前后分子的种类和数目都不变 B、反应前碳元素的化合价为+2价 C、该反应的基本类型为置换反应 D、反应物与生成物的粒子个数比为1:1:16. 人类用于制造触屏材料的铟,相关信息如图,下列说法中正确的是( ) A、铟是一种非金属元素 B、原子的核电荷数为49 C、与其他元素根本区别是中子数不同 D、相对原子质量是114.8g7. 在稀硫酸除铁锈的实验中,发现生锈的铁钉表面有一些气泡产生。小明猜想气泡是硫酸与铁反应生成的,为了验证猜想,他应选择以下哪几个实验进行验证( )
A、铟是一种非金属元素 B、原子的核电荷数为49 C、与其他元素根本区别是中子数不同 D、相对原子质量是114.8g7. 在稀硫酸除铁锈的实验中,发现生锈的铁钉表面有一些气泡产生。小明猜想气泡是硫酸与铁反应生成的,为了验证猜想,他应选择以下哪几个实验进行验证( )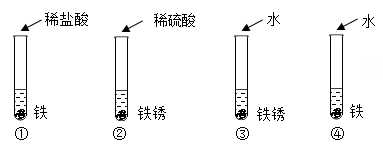 A、①② B、①②③ C、①②④ D、①②③④8. 下列实验操作中,现象与对应结论均正确的是( )
A、①② B、①②③ C、①②④ D、①②③④8. 下列实验操作中,现象与对应结论均正确的是( )选项
操作
现象
结论
A
向某无色溶液中滴加酚酞试液
溶液变红
该溶液为碱溶液
B
向某白色粉末中滴加稀盐酸
有气泡产生
该溶液中一定含有CO32-
C
在久置烧碱样品中滴加少量稀盐酸
无明显现象
样品没有变质
D
将铁片插入硫酸铜溶液
铁片表面有红色固体析出
Fe的活动性强于Cu
A、A B、B C、C D、D9. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤液中加入少量铁粉,无明显现象,下列说法不正确的是( )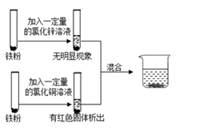 A、由此实验可知金属的活动性顺序:Zn>Fe>Cu B、滤液中的溶质一定有FeCl2、ZnCl2 , 一定没有CuCl2 C、滤渣中一定有铜,可能有铁 D、两支试管混合后,固体总质量一定增加10. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、
A、由此实验可知金属的活动性顺序:Zn>Fe>Cu B、滤液中的溶质一定有FeCl2、ZnCl2 , 一定没有CuCl2 C、滤渣中一定有铜,可能有铁 D、两支试管混合后,固体总质量一定增加10. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、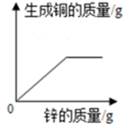 B、
B、 C、
C、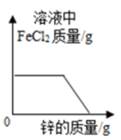 D、
D、 11. 生活中有很多“禁忌”,即不能做的事情。下列“禁忌”与相关的科学解释对应的是( )
11. 生活中有很多“禁忌”,即不能做的事情。下列“禁忌”与相关的科学解释对应的是( )选项
禁忌
原理解释
A
用锡壶装醋酸
活动性顺序:Sn<H
B
煤气泄漏时,开灯检查
电火花会点燃混合气体,气体爆炸
C
用稀HCl除铁锈时,浸泡太久
6HCl+2Fe=2FeCl3+3H2↑
D
浓硫酸洒在手上,直接用水冲洗
浓硫酸具有吸水性
A、A B、B C、C D、D12. 材料在人类生产、生活中有着重要的作用。下列有关材料的说法中正确的是( )A、棉花和羊毛的主要成分都是蛋白质 B、日常生活中纯金属使用比合金更广泛 C、日常生活中使用的涤纶、腈纶、蚕丝等都属于合成纤维 D、塑料是常见的有机合成材料,具有密度小、耐腐蚀、易加工等优点13. 甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现如图中箭头所示的转化。不符合上述要求的一组物质是( )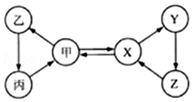
选项
甲
X
A
O2
H2O
B
CO2
CaCO3
C
Fe
Fe3O4
D
NaOH
NaNO3
A、A B、B C、C D、D14. 下列图像分别表示四个实验过程中的某些变化情况,其中不正确的是( )A、往不饱和溶液中加氯化钠固体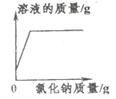 B、往澄清石灰水中通入足量CO2
B、往澄清石灰水中通入足量CO2 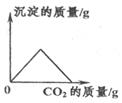 C、常温下向NaOH溶液中加水稀释
C、常温下向NaOH溶液中加水稀释 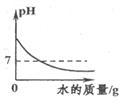 D、用少量锌粒与稀硫酸制取氢气
D、用少量锌粒与稀硫酸制取氢气 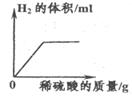 15. 下列说法中正确的是( )A、碱的组成中一定含有氢、氧两种元素 B、金属都可以与盐酸反应生成盐和氢气 C、铁与氧气反应一定生成四氧化三铁 D、含有金属元素和氧元素的化合物一定是金属氧化物16. 把足量的铁粉分别投入到各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是( )A、Na2SO4和CuSO4 B、H2SO4 和 CuSO4 C、HCl 和H2SO4 D、CuCl2 和 Cu(NO3)217. 如图是小凡用手势OK表示初中化学反应中生成水的不同方法,要求手指上的物质分别通过某种基本类型的反应能直接生成H2O,则物质X一定不是下列物质中的( )
15. 下列说法中正确的是( )A、碱的组成中一定含有氢、氧两种元素 B、金属都可以与盐酸反应生成盐和氢气 C、铁与氧气反应一定生成四氧化三铁 D、含有金属元素和氧元素的化合物一定是金属氧化物16. 把足量的铁粉分别投入到各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是( )A、Na2SO4和CuSO4 B、H2SO4 和 CuSO4 C、HCl 和H2SO4 D、CuCl2 和 Cu(NO3)217. 如图是小凡用手势OK表示初中化学反应中生成水的不同方法,要求手指上的物质分别通过某种基本类型的反应能直接生成H2O,则物质X一定不是下列物质中的( ) A、H2 B、H2CO3 C、KOH D、CH418. 线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如上图所示实验,探究铁生锈的条件。下列说法错误的是( )
A、H2 B、H2CO3 C、KOH D、CH418. 线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如上图所示实验,探究铁生锈的条件。下列说法错误的是( )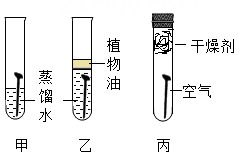 A、乙试管中植物油的作用是隔绝空气 B、只有甲试管中的铁钉有明显锈迹 C、乙丙两支试管的实验现象说明铁生锈需要水 D、实验表明铁生锈是铁与空气和水共同作用的结果19. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是( )A、
A、乙试管中植物油的作用是隔绝空气 B、只有甲试管中的铁钉有明显锈迹 C、乙丙两支试管的实验现象说明铁生锈需要水 D、实验表明铁生锈是铁与空气和水共同作用的结果19. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是( )A、 B、
B、 C、
C、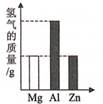 D、
D、 20. 将等质量的镁、铁、锌,分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H2质量与反应时间的关系如图所示。根据图中的信息,作出的判断不正确的是( )
20. 将等质量的镁、铁、锌,分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H2质量与反应时间的关系如图所示。根据图中的信息,作出的判断不正确的是( )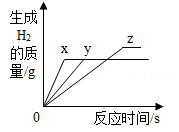 A、图线x表示镁的反应情况 B、铁消耗的稀盐酸质量最大 C、镁、锌一定过量,铁可能反应完 D、镁一定过量,锌、铁可能反应完
A、图线x表示镁的反应情况 B、铁消耗的稀盐酸质量最大 C、镁、锌一定过量,铁可能反应完 D、镁一定过量,锌、铁可能反应完二、填空题
-
21. 学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
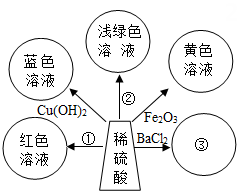 (1)、若想实现①,需要加入的试剂是。(2)、②的化学方程式为Fe+H2SO4=FeSO4+H2↑,其基本反应类型是 。(3)、写出③的实验现象。22. 铁、锌、镁是生活中常见的金属,请回答:
(1)、若想实现①,需要加入的试剂是。(2)、②的化学方程式为Fe+H2SO4=FeSO4+H2↑,其基本反应类型是 。(3)、写出③的实验现象。22. 铁、锌、镁是生活中常见的金属,请回答: (1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中 的水蒸气和氧气,生成氢氧化亚铁等物质。该过程主要发生了变化。(2)、三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中不正确的是 。A、曲线 X、Y、Z 分别表示镁、锌、铁的反应情况 B、三份稀盐酸可能都被完全反应 C、三种金属的质量关系一定是 m 镁<m 锌<m 铁 D、反应结束后铁、锌和镁一定都没有剩余23. 归纳总结是学习科学的重要方法,下面是某同学对有关知识的总结,请你填写空格:
(1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中 的水蒸气和氧气,生成氢氧化亚铁等物质。该过程主要发生了变化。(2)、三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中不正确的是 。A、曲线 X、Y、Z 分别表示镁、锌、铁的反应情况 B、三份稀盐酸可能都被完全反应 C、三种金属的质量关系一定是 m 镁<m 锌<m 铁 D、反应结束后铁、锌和镁一定都没有剩余23. 归纳总结是学习科学的重要方法,下面是某同学对有关知识的总结,请你填写空格: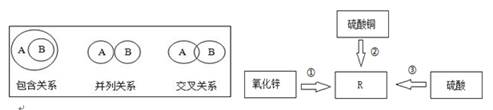 (1)、逻辑关系:物质类属间存在着如下关系,其中酸和碱属于关系。(2)、转化关系:右图表示几种化合物能通过一步反应转化为含锌化合物R.。图中物质R属于(选填“氧化物”、“酸”、“碱”或“盐”);其中转化②涉及的反应属于化学反应基本类型中的。24. 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni) ,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。(1)、铸造以上硬币用到的材料都是(填“合成材料”或“金属材料”)。(2)、选择铸造硬币的材料不需要考虑的因素是 (填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
(1)、逻辑关系:物质类属间存在着如下关系,其中酸和碱属于关系。(2)、转化关系:右图表示几种化合物能通过一步反应转化为含锌化合物R.。图中物质R属于(选填“氧化物”、“酸”、“碱”或“盐”);其中转化②涉及的反应属于化学反应基本类型中的。24. 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni) ,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。(1)、铸造以上硬币用到的材料都是(填“合成材料”或“金属材料”)。(2)、选择铸造硬币的材料不需要考虑的因素是 (填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:Ni+H2SO4=NiSO4+H2↑ Fe+NiCl2=Ni+FeCl2
四种金属活动性由强到弱的顺序为(用元素符号表示)。
25. 我国古代劳动人民在认识、改造和应用物质方面有着很多实践。(1)、战国《吕氏春秋》中记载;“金柔锡柔,合两柔则刚”(“金”指铜单质,“锡”指锡,单质,“刚”指坚硬)。这句话说明铜锡合金具有的特性是。(2)、战国《周礼》中记载:“煤饼烧砺房成灰”(“砺房”即牡砺壳,主要成分是碳酸钙)。古代劳动人民将此“灰”溶于水制得碱液,写出该反应的化学方程式。26. 为了探究Fe、Cu、Ag、R(R为未知金属)四种金属的金属活动性顺序,进行如下实验:如图甲所示,将四根金属丝同时插入烧杯中的溶液里,只观察到①中铁丝表面出现气泡,②中铁丝表面有紫红色物质:如图乙所示,一段时间后,将烧杯中铁丝替换为R丝进行实验,观察到①中R丝表面出现气泡,②中R丝表面无明显现象。 为相应金属丝插入烧杯前,烧杯中溶液里存在的阳离子。
为相应金属丝插入烧杯前,烧杯中溶液里存在的阳离子。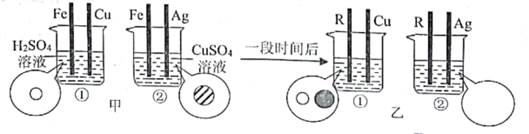 (1)、图乙所示的②中存在的阳离子是(从“
(1)、图乙所示的②中存在的阳离子是(从“ ”"
”" 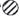 ”或“
”或“  ”中选填)。 (2)、Fe、Cu、Ag、R四种金属的金属活动性顺序由强到弱依次为。27. 日常生活、工农业生产中的许多问题都与化学知识密切相关。(1)、在家里,常可以选用厨房用品中的(选填“黄酒”、“苏打”或“食醋”)来除去铁制品表面的锈迹。(2)、为了保证安全,点燃甲烷气体前要检验气体的。(3)、为适应火车提速,一些铁路线上原有的短轨需要连接为超长轨。工人常用2Al+Fe2O3=Al2O3+2Fe (条件高温)这一反应来焊接钢轨,该反应属于化学基本反应类型中的。28. 人类的生产和生活都离不开金属。
”中选填)。 (2)、Fe、Cu、Ag、R四种金属的金属活动性顺序由强到弱依次为。27. 日常生活、工农业生产中的许多问题都与化学知识密切相关。(1)、在家里,常可以选用厨房用品中的(选填“黄酒”、“苏打”或“食醋”)来除去铁制品表面的锈迹。(2)、为了保证安全,点燃甲烷气体前要检验气体的。(3)、为适应火车提速,一些铁路线上原有的短轨需要连接为超长轨。工人常用2Al+Fe2O3=Al2O3+2Fe (条件高温)这一反应来焊接钢轨,该反应属于化学基本反应类型中的。28. 人类的生产和生活都离不开金属。 (1)、将蜡分别粘在金属匙和塑料匙的上端(如图所示),同时放入沸水中,粘在金属匙上的蜡熔化更快,是因为金属的比塑料好。(2)、赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热可得铜,请将反应的化学方程式补充完整2 Cu2O+Cu2S 6Cu+↑。29. 我国古代劳动人民在认识、改造和应用物质方面有着很多实践。(1)、战国《吕氏春秋》中记载:“金柔锡柔,合两柔则刚”(“金”指铜单质,“锡”指锡单质,“刚”指坚硬)。这句话说明铜锡合金具有的特性是。(2)、战国《周礼》中记载;“煤饼烧砺房成灰”(“砺房”即牡砺壳,主要成分是碳酸钙)。古代劳动人民将此“灰”溶于水可制得碱液。写出该反应的化学方程式。30. 为了探究Fe、Cu、Ag、R(R为未知金属)四种金属的金属活动性顺序,进行如下实验:如图甲所示,将四根金属丝同时插入烧杯中的溶液里,只观察到①中铁丝表面出现气泡,②中铁丝表面有紫红色物质;如图乙所示,一段时间后,将烧杯中铁丝替换为R丝进行实验,观察到①中R丝表面出现气泡,②中R丝表面无明显现象。
(1)、将蜡分别粘在金属匙和塑料匙的上端(如图所示),同时放入沸水中,粘在金属匙上的蜡熔化更快,是因为金属的比塑料好。(2)、赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热可得铜,请将反应的化学方程式补充完整2 Cu2O+Cu2S 6Cu+↑。29. 我国古代劳动人民在认识、改造和应用物质方面有着很多实践。(1)、战国《吕氏春秋》中记载:“金柔锡柔,合两柔则刚”(“金”指铜单质,“锡”指锡单质,“刚”指坚硬)。这句话说明铜锡合金具有的特性是。(2)、战国《周礼》中记载;“煤饼烧砺房成灰”(“砺房”即牡砺壳,主要成分是碳酸钙)。古代劳动人民将此“灰”溶于水可制得碱液。写出该反应的化学方程式。30. 为了探究Fe、Cu、Ag、R(R为未知金属)四种金属的金属活动性顺序,进行如下实验:如图甲所示,将四根金属丝同时插入烧杯中的溶液里,只观察到①中铁丝表面出现气泡,②中铁丝表面有紫红色物质;如图乙所示,一段时间后,将烧杯中铁丝替换为R丝进行实验,观察到①中R丝表面出现气泡,②中R丝表面无明显现象。 为相应金属丝插入烧杯前,烧杯中溶液里存在的阳离子。
为相应金属丝插入烧杯前,烧杯中溶液里存在的阳离子。 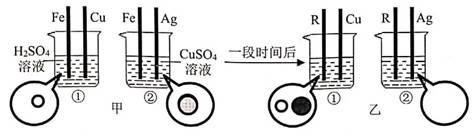 (1)、图乙所示的②中存在的阳离子是(从
(1)、图乙所示的②中存在的阳离子是(从 中选填) (2)、Fe、Cu、Ag、R四种金属的金属活动性顺序由强到弱依次为。
中选填) (2)、Fe、Cu、Ag、R四种金属的金属活动性顺序由强到弱依次为。三、解答题
-
31. 科学课上老师演示了锌与稀硫酸反应的实验,同学们观察实验现象并对实验后的溶液进行了探究,请回答下列问题。(1)、实验中观察到产生气泡的速度先变快后变慢,可能的原因是。(2)、同学们先用pH试纸测反应后的溶液,发现pH试纸变红;再向该溶液中逐滴滴入氢氧化钡溶液,立即产生白色沉淀。某同学认为刚开始产生的沉淀不可能是氢氧化锌,其理由是。32. “垃圾是放错地方的资源”,人们正逐渐将生活垃圾分类回收,通常绿色垃圾箱用来装可回收再利用的垃圾,黄色垃圾箱用来装不可回收的垃圾。(1)、作为有素养的中学生,要爱护学校的一草一木,不乱扔东西。现从垃圾房中清理出如下物品:
A.废作业本 B.烂苹果 C.易拉罐 D.霉变了的饼干 E.生锈的铁钉
①你认为应放入“可回收垃圾箱”的是(填序号,下同)
②在以上物品中,因长期放置而发生了化学变化是
(2)、农村生活垃圾分类处理是能源再利用和减少土壤污染的重要方法。①垃圾焚烧发电是一种有效处理方法,它是利用了储存在垃圾中的能。
②小敏家两次电能表显示如图所示,他家这30天的用电量为千瓦时。绍兴某垃圾发电厂3条焚烧线每天能处理2250吨生活垃圾,日发电80万千瓦时,它最多可供万户类似小敏家庭的日用电。(结果保留一位小数)
 (3)、尾气达标排放,避免二次污染是改善空气质量的有效措施。焚烧温度低于800℃时,含氯垃圾不完全燃烧,极易生成有毒物质二噁英(C12H4O2Cl4)。为降低尾气中二噁英的排放量,垃圾发电厂可以采取的措施是 。A、减少通入类烧炉内的空气量 B、焚烧过程中要不断搅动垃圾 C、减少垃圾在焚烧炉内的停留时间 D、升高垃圾焚烧炉内的温度33. 某同学利用如图所示的杠杆完成探究实验(杠杆已调至平衡)。
(3)、尾气达标排放,避免二次污染是改善空气质量的有效措施。焚烧温度低于800℃时,含氯垃圾不完全燃烧,极易生成有毒物质二噁英(C12H4O2Cl4)。为降低尾气中二噁英的排放量,垃圾发电厂可以采取的措施是 。A、减少通入类烧炉内的空气量 B、焚烧过程中要不断搅动垃圾 C、减少垃圾在焚烧炉内的停留时间 D、升高垃圾焚烧炉内的温度33. 某同学利用如图所示的杠杆完成探究实验(杠杆已调至平衡)。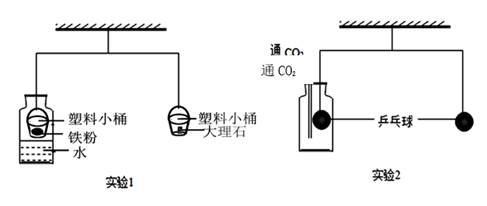 (1)、实验1中,较长时间后,杠杆左边下降,是因为铁粉与发生了反应。将铁粉换成下列物质中的 , 杠杆也会出现相似现象。
(1)、实验1中,较长时间后,杠杆左边下降,是因为铁粉与发生了反应。将铁粉换成下列物质中的 , 杠杆也会出现相似现象。A.氯化钠固体 B.氢氧化钠固体 C.生石灰 D.碳酸钠晶体
(2)、实验2中,先往广口瓶中通入CO2一段时间,左边乒乓球上升;再往广口瓶中滴入足量的NaOH溶液,杠杆重新平衡。请解释出现上述现象的原因。34. 某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败。某课外兴趣小组在实验室发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应。测得部分数据如表,请根据有关信息回答问题实验次数
1
3
4
5
6
取样品质量(g)
31.0
31.0
31.0
31.0
31.0
取稀硫酸质量(g)
30.0
90.0
120.0
150.0
180.0
产生气体质量(g)
0
a
0.3
0.5
0.6
(1)、“双吸剂”的原理是(2)、a的数值为(3)、计算该稀硫酸的溶质质量分数?35. 随机取一定量的镁粉和铜粉的混合物于烧杯中,再向其中分4次缓慢加入等质量的同一稀硫酸。实验过程中有关物质的用量及质量测定记录如下表:第一次
第二次
第三次
第四次
加入稀硫酸的质量
70g
70g
70g
70g
剩余固体的质量
8.6g
6.2g
3.8g
2.6g
请回答下列问题:
(1)、实验结束后的溶液中所含溶质的化学式为;(2)、所用稀硫酸溶质的质量分数为多少?(写出过程) ;(3)、在图中标出必要数据,并画出加入的硫酸溶液质量与剩余固体质量的关系图。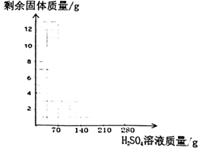
四、实验探究题
-
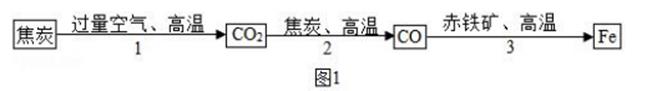
36. 人类文明进步与金属材料发展关系十分密切。(1)、炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如图 1:步骤2反应中体现出焦炭的性。(选填“氧化”或“还原”)
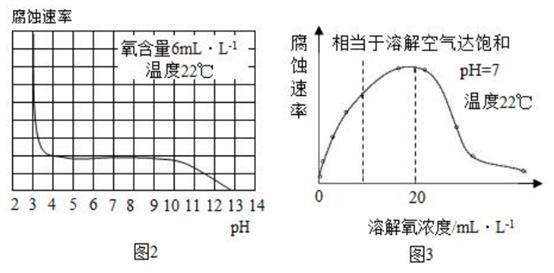
 (2)、研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到图 2、图 3 资料。
(2)、研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到图 2、图 3 资料。①图2表示水样温度22℃、氧含量6mL/L时,钢铁腐蚀速率与水样pH的关系。当pH<4时,随pH值减小,钢铁腐蚀速率明显增大的原因是。
②图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超20mL/L时,钢铁腐蚀速率明显下降的原因可能是。
 37. 为了探究铁生锈的条件,某实验小组的同学用下列装置进行实验。
37. 为了探究铁生锈的条件,某实验小组的同学用下列装置进行实验。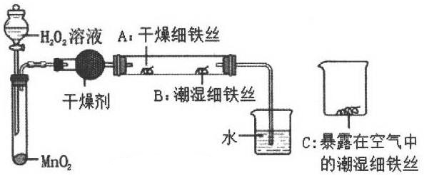 (1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,微热试管,说明气密性良好的现象是;(2)、加入药品,4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。A、B处实验现象对比说明铁生锈主要与有关;B、C处实验现象对比说明铁生锈的快慢与有关;(3)、写出一种防止铁生锈的方法。38. 某化学小组向一定量的AgNO3和Cu(NO3)2的混合溶液中加入锌粉,充分反应后过滤,得到滤液A和滤渣B。
(1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,微热试管,说明气密性良好的现象是;(2)、加入药品,4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。A、B处实验现象对比说明铁生锈主要与有关;B、C处实验现象对比说明铁生锈的快慢与有关;(3)、写出一种防止铁生锈的方法。38. 某化学小组向一定量的AgNO3和Cu(NO3)2的混合溶液中加入锌粉,充分反应后过滤,得到滤液A和滤渣B。【提出问题】滤渣B的成分是什么?
【做出猜想】滤渣B可能是:①银、铜和锌;②银和铜;③。
【实验探究】⑴取少量滤渣B加入适量稀盐酸,若无气体产生,则滤渣B不可能是猜想(选填①、②或③)。
⑵该小组继续实验,使用不同种方法确定滤渣B是银和铜,请写出该小组使用的一种方法。
39. “一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素”,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na +2H2O=2Na0H+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如下表所示。
实验编号
钠块大小
硫酸铜溶液
实验中产生沉淀的现象
①
绿豆大小
稀溶液10mL
产生蓝绿色沉淀
②
绿豆大小
浓溶液10mL
产生蓝色絮状沉淀
③
豌豆大小
稀溶液10mL
产生蓝色絮状沉淀
④
豌豆大小
浓溶液10mL
产生蓝色絮状沉淀,并出现黑色固体
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(1)、【实验结论】⑴上述实验中均未观察到色固体生成,由此判断猜想一错误;⑵实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
(2)、⑴【实验反思】实验中生成氢氧化铜沉淀的原理是。⑵由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有.
40. 铬(Cr)是一种重要的金属材料,具有良好的抗腐蚀性,常用来镀在其他金属的表面上达到防锈的目的。小明想利用实验室的药品和器材来比较铝和铬的金属活动性强弱。【实验器材及药品】厚度相同的铝片和铬片(表面打磨过)、质量分数为 10%的稀盐酸、剪刀、秒表、注射器若干、具支试管若干、橡胶塞若干、相同气球若干。
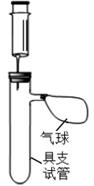
( ( 温馨提示:在金属活动性强弱差别不大时,产生气泡的快慢 难以区分) )。
(1)、实验中使用的铝片和铬片表面均用砂纸事先打磨过,其目的是。(2)、小明利用相关实验器材搭建了如右图所示装置,请你帮助他设计实验步骤。建议:①每组实验中取用稀盐酸 10mL;②每组实验取用金属片 2 片;。