中考二轮专题复习:金属 (基础巩固)
试卷更新日期:2021-04-30 类型:二轮复习
一、单选题
-
1. “中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:C+2NiO 2Ni+CO2↑,该反应属于基本反应类型中的( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应2. 高纯度的硅是制作电脑芯片的重要原料,目前广泛采用石英砂(主要成分是SiO2)为原料制取,其中一步反应为:SiO2+2C Si+2CO↑,该反应的类型是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应.3. 如图是包含物质a、b、c、d和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生化学反应。单质a不可能是( )
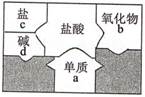 A、Mg B、Fe C、Ag D、Zn4. 铁在海水中容易被锈蚀,通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是( )A、金 B、锌 C、铜 D、银5. 工业冶炼金属钛的反应原理是TiCl4+2Mg Ti+2MgCl2 , 该反应类型属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应6. 东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于( )
A、Mg B、Fe C、Ag D、Zn4. 铁在海水中容易被锈蚀,通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是( )A、金 B、锌 C、铜 D、银5. 工业冶炼金属钛的反应原理是TiCl4+2Mg Ti+2MgCl2 , 该反应类型属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应6. 东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于( ) A、合成材料 B、天然材料 C、金属材料 D、复合材料7. 金属材料在人类活动中已得到越来越广泛的应用,下列性质属于金属共性的是( )A、导电性、导热性好 B、是银白色的固体 C、硬度很大、熔点很高 D、能与酸反应产生氢气8. 某学生将沾有清水的细铁丝放在如图的装置中,经过几天后能观察到的现象是( )
A、合成材料 B、天然材料 C、金属材料 D、复合材料7. 金属材料在人类活动中已得到越来越广泛的应用,下列性质属于金属共性的是( )A、导电性、导热性好 B、是银白色的固体 C、硬度很大、熔点很高 D、能与酸反应产生氢气8. 某学生将沾有清水的细铁丝放在如图的装置中,经过几天后能观察到的现象是( )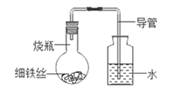 A、铁丝不变,导管中水面上升 B、铁丝不变,导管中水面不变 C、铁丝生锈,导管中水面上升 D、铁丝生锈,导管中水面不变9. 光亮的铁钉在下列几种情况下(如图所示),最不容易生锈的是( )A、
A、铁丝不变,导管中水面上升 B、铁丝不变,导管中水面不变 C、铁丝生锈,导管中水面上升 D、铁丝生锈,导管中水面不变9. 光亮的铁钉在下列几种情况下(如图所示),最不容易生锈的是( )A、 B、
B、 C、
C、 D、
D、 10. 金属材料在人类活动中已得到越来越广泛的应用。下列性质属于金属共性的是( )A、硬度很大、熔点很高 B、有良好的导电性、导热性 C、是银白色的固体 D、易锈蚀11. 科学家发现一种新金属。根据表中信息推测其用途错误的是( )
10. 金属材料在人类活动中已得到越来越广泛的应用。下列性质属于金属共性的是( )A、硬度很大、熔点很高 B、有良好的导电性、导热性 C、是银白色的固体 D、易锈蚀11. 科学家发现一种新金属。根据表中信息推测其用途错误的是( )熔点
密度
强度
导电性
导热性
抗腐蚀性
2500℃
3g/cm3
与钢相似
良好
良好
优异
A、用于焊接金属 B、制造航天飞机 C、制外科手术刀 D、用于通讯设备12. 唐太宗曾说:“以铜为镜,可以正衣冠;以史为镜,可以知兴替;以人为镜,可以明得失。”铜之所以能为镜是因为( )A、铜有金属光泽 B、铜能导热 C、铜能做工艺品 D、铜不会生锈13. 金属钛有银白色金属光泽,密度为4.5g/cm3 , 熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是( )A、保险丝 B、医疗器械 C、潜艇外壳 D、眼镜架14. 钨用来制造灯丝,因为钨具有导电性且( )A、密度大 B、熔点高 C、硬度大 D、延展性较好15. 芯片是智能家电的核心部件,它是用高纯度硅制成的,工业上通过以下反应将自然界的二氧化硅(SiO2)转化为硅:SiO2+2C=Si+2CO↑,该反应的类型属于( )A、分解反应 B、化合反应 C、置换反应 D、复分解反应16. 以下四种物品属于垃圾分类中的可回收物,其中主要成分属于金属材料的是( )A、塑料盒 B、一次性纸杯 C、玻璃瓶 D、易拉罐17. “垃圾是放错了位置的资源”,应分类回收。生活中废弃的铁锅、铝质易拉罐、铜导线等可归为一类加以回收,它们属于( )A、金属或合金 B、氧化物 C、有机物 D、盐18. 下列物质能通过金属和稀盐酸一步反应制得的是( )A、氯化铝 B、氯化铁 C、氯化铜 D、氯化银19. 下列物质中,含有金属元素的是()A、P2O5 B、CO2 C、CuSO4 D、CH420. 诺贝尔化学奖得主德国化学家Gerhard Ertl对CO在催化剂Pt/Al2O3/Ba表面进行的研究,催生了汽车尾气净化装置。如图为该反应过程的模型,判断下列说法中不正确的是( )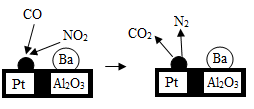 A、该反应遵循质量守恒定律 B、CO2、NO2属于非金属氧化物 C、该反应为置换反应 D、该装置的最大贡献是将有毒气体处理为无污染气体
A、该反应遵循质量守恒定律 B、CO2、NO2属于非金属氧化物 C、该反应为置换反应 D、该装置的最大贡献是将有毒气体处理为无污染气体二、填空题
-
21. 为了提高原料的利用率,现从含有金属镁、铁、铜的粉末中分离和提取出重要化工原料MgSO4和有关金属, 实验过程如下:
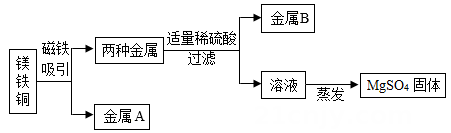 (1)、金属B是。(2)、写出上述实验过程中发生反应的化学方程式。22. 如图是一种照明用的台灯。
(1)、金属B是。(2)、写出上述实验过程中发生反应的化学方程式。22. 如图是一种照明用的台灯。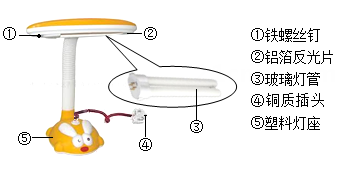 (1)、图中标示的各部件中,用金属材料制成的是(填序号);(2)、灯管后面的反光片为铝箔,铝块能制成铝箔是利用了铝的性(3)、灯座材料是聚苯乙烯,化学式:(C8H8)n,这一类含碳化合物属于化合物。23. 共享单车作为代步工具,既轻便灵活,又环保。右图是一款自行车的图片。为防止车架生锈,可以采取的防锈措施是 , 铝合金与纯铝相比,其硬度更 (填“大”或“小”),熔点更(填“高”或“低”)。
(1)、图中标示的各部件中,用金属材料制成的是(填序号);(2)、灯管后面的反光片为铝箔,铝块能制成铝箔是利用了铝的性(3)、灯座材料是聚苯乙烯,化学式:(C8H8)n,这一类含碳化合物属于化合物。23. 共享单车作为代步工具,既轻便灵活,又环保。右图是一款自行车的图片。为防止车架生锈,可以采取的防锈措施是 , 铝合金与纯铝相比,其硬度更 (填“大”或“小”),熔点更(填“高”或“低”)。 24. 小毛对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”(1)、小毛认为的“铁”,是指(选填“铁元素”或“铁单质”)。(2)、通过 可把铁矿石中的铁元素转变成铁单质,此反应利用了CO的性。25. 化学就在你我身边:家庭炒菜用的铁锅手柄是用(选填“热固性”或“热塑性”)塑料做的;用来吸收氧气和水分,以防止食品腐败的“双吸剂”是。26. 我国最早人工冶炼铁的制品是甘肃灵台出土的秦国铜柄钢剑,这说明在春秋战国时期我国已掌握了冶炼铁的技术。经分析测试该钢剑属于铁的合金,铁的合金主要有生铁和钢,生铁含碳量在以上;钢是含碳量在之间的铁合金,钢的含碳量越高,钢的硬度越(选填“大”或“小”)。27. 金属用品已进入人们生活的方方面面,人们称铁为“”,铝为“”,预计将跃居为“第三金属”。28. 请用化学式填空:(1)、地壳中含量最高的金属元素是;(2)、导热、导电性最好的金属是;(3)、温度计中的金属是;(4)、密度最小的金属是;(5)、到目前为止,冶炼产量最高的金属是;(6)、熔点最高的金属是;(7)、最早被人类广泛利用的金属是。29. 科学与生活息息相关,如图是某电子产品拆解图片。
24. 小毛对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”(1)、小毛认为的“铁”,是指(选填“铁元素”或“铁单质”)。(2)、通过 可把铁矿石中的铁元素转变成铁单质,此反应利用了CO的性。25. 化学就在你我身边:家庭炒菜用的铁锅手柄是用(选填“热固性”或“热塑性”)塑料做的;用来吸收氧气和水分,以防止食品腐败的“双吸剂”是。26. 我国最早人工冶炼铁的制品是甘肃灵台出土的秦国铜柄钢剑,这说明在春秋战国时期我国已掌握了冶炼铁的技术。经分析测试该钢剑属于铁的合金,铁的合金主要有生铁和钢,生铁含碳量在以上;钢是含碳量在之间的铁合金,钢的含碳量越高,钢的硬度越(选填“大”或“小”)。27. 金属用品已进入人们生活的方方面面,人们称铁为“”,铝为“”,预计将跃居为“第三金属”。28. 请用化学式填空:(1)、地壳中含量最高的金属元素是;(2)、导热、导电性最好的金属是;(3)、温度计中的金属是;(4)、密度最小的金属是;(5)、到目前为止,冶炼产量最高的金属是;(6)、熔点最高的金属是;(7)、最早被人类广泛利用的金属是。29. 科学与生活息息相关,如图是某电子产品拆解图片。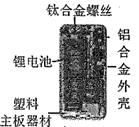 (1)、图中标示的材料属于有机合成材料的是。(2)、制造电子芯片的主要材料是硅。工业上制取硅的主要化学反应为SiO2+2C Si+2CO↑,该反应的基本类型属于反应。30. 诗词、谚语、成语都是中华民族的文化瑰宝。(1)、“只要功夫深,铁杵磨成针”。铁杵的组成元素除了Fe以外,还有等;(2)、“春蚕到死丝方尽,蜡炬成灰泪始干”,蚕丝的主要成分是。
(1)、图中标示的材料属于有机合成材料的是。(2)、制造电子芯片的主要材料是硅。工业上制取硅的主要化学反应为SiO2+2C Si+2CO↑,该反应的基本类型属于反应。30. 诗词、谚语、成语都是中华民族的文化瑰宝。(1)、“只要功夫深,铁杵磨成针”。铁杵的组成元素除了Fe以外,还有等;(2)、“春蚕到死丝方尽,蜡炬成灰泪始干”,蚕丝的主要成分是。三、解答题
-
31. 人类的生产生活离不开金属。(1)、下列铜制品的用途中,利用金属导电性的是 。A、铜火锅
 B、铜导线
B、铜导线  C、铜钟
C、铜钟  D、铜钱
D、铜钱  (2)、某兴趣小组为了测定铜钱(铜锌合金)中铜的质量分数,取多枚铜钱放入烧杯中,另取
(2)、某兴趣小组为了测定铜钱(铜锌合金)中铜的质量分数,取多枚铜钱放入烧杯中,另取80克稀硫酸,分四次等质量加入,每次均充分反应,实验数据记录如下表。
实验次数
1
2
3
4
稀硫酸的用量/克
20
20
20
20
剩余固体的质量/克
20.0
17.4
14.8
13.8
分析上述数据,请回答下列问题:
①第4次实验结束后溶液的pH ▲ 7(填“>”、“=”或“<”)。
②计算铜钱中铜的质量分数(计算结果精确到0.1%)。
③计算参加反应的稀硫酸中的溶质质量(计算结果保留一位小数)。
32. 通常将24K的黄金称作纯金。现有一位顾客购买了一件18K的黄金首饰,则这件首饰中黄金的含量百分比约为多少?33. 2017年5月5日,国产大型客机C919在上海油东机场首飞成功,标志着我固在航空制造领设迈出关键步伐。如图为C919的主视图和侧视图(两图缩放比例相同),回答问题: (1)、C919航行时,机翼获得升力的原理与下列动物飞行原理最接近的是(选填序号)。
(1)、C919航行时,机翼获得升力的原理与下列动物飞行原理最接近的是(选填序号)。①.鹰的飞翔

②.蝴蝶扇动翅膀
 (2)、C919可谓内外兼修,在飞机的机体主结构上大量使用了铝锂合金材料,合金属于(选填“单质”“化合物”或“混合物”),合金比纯金属具有的优势看(写出一点);在飞机的发动机上采用压气机将高密度空气(高压压缩后的空气)压入燃烧室,促进航空煤油的燃烧,使燃油消耗减少16%,解释高密度空气能使航空煤油燃烧更充分的原因是。
(2)、C919可谓内外兼修,在飞机的机体主结构上大量使用了铝锂合金材料,合金属于(选填“单质”“化合物”或“混合物”),合金比纯金属具有的优势看(写出一点);在飞机的发动机上采用压气机将高密度空气(高压压缩后的空气)压入燃烧室,促进航空煤油的燃烧,使燃油消耗减少16%,解释高密度空气能使航空煤油燃烧更充分的原因是。
34. 某初中科技活动举行了一次有趣的比赛:“谁的小车一次运行的距离最远”。九年级二班的科学兴趣小组制作了如图所示的一辆小车,他们往试管中加入两种试剂,塞紧塞子,通过产生的。气体喷出时的反冲力,使小车向前运动。(可选择的试剂:①锌粉,②铜粉,③10%的稀盐酸,④10%的稀硫酸)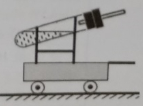 (1)、要想实验能成功,二班科学兴趣小组选择的固体药品是。(填序号)(2)、理论上,在加入的两种试剂总质量相同的条件下,二班科学兴趣小组选择的最符合比赛要求的试剂应是(填序号)。(3)、三班科学兴趣小组根据同样的推进原理,但不进行化学反应,也能使小车运动。他们向盛有水的试管中加入的物质可以是(填物质名称)。35.
(1)、要想实验能成功,二班科学兴趣小组选择的固体药品是。(填序号)(2)、理论上,在加入的两种试剂总质量相同的条件下,二班科学兴趣小组选择的最符合比赛要求的试剂应是(填序号)。(3)、三班科学兴趣小组根据同样的推进原理,但不进行化学反应,也能使小车运动。他们向盛有水的试管中加入的物质可以是(填物质名称)。35.如图为家庭和工厂中常用的钳子,观察它的构造,它是由哪些材料构成的,分别利用了这些材料的什么物理属性?
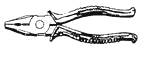
四、实验探究题
-
36.
连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一.它的产品除了纯碱外,还有氧化钙和碳酸氢钠.该厂生产纯碱的工艺流程可简单表示如图1:

其生产过程中涉及到的主要化学反应有:
①NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓ ②2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O请回答:
(1)、①“碳化”过程中需要的CO2 , 可由石灰石高温煅烧得到,该反应的化学方程式为 .②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是 ;干燥CO2气体,可用的干燥剂是 (填字母).
A.浓硫酸 B.固体氢氧化钠 C.生石灰
(2)、①该厂“过滤”所得的NH4Cl可作化肥中的 肥,它也可与Ca(OH)2在加热时发生反应生成产品CaCl2 , 同时还有NH3和H2O生成,写出该反应的化学方程式: .该厂的另一种产品碳酸氢钠俗称 ,它的重要用途有 (只写一种).②实验室进行“过滤”操作时,下列说法正确的有 (填字母) .
A.使用的漏斗叫长颈漏斗 B.液面应低于滤纸边缘
C.玻璃棒应不停搅拌 D.漏斗下端的管口要紧靠烧杯内壁
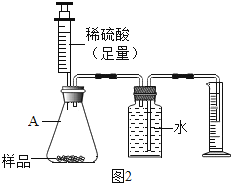
(3)、某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),试剂了如下两种实验方案:方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
(4)、方案二:用图2所示的装置,通过准确测量排出水的体积,也可计算样品的纯度.该装置中仪器A的名称是 ,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是 .(装置气密性良好)
 37.
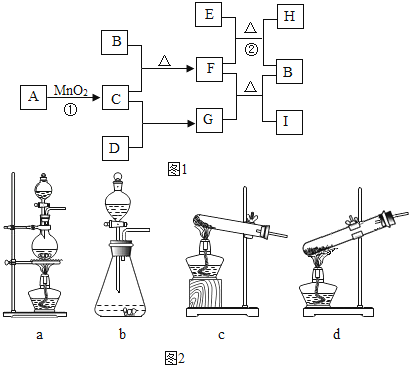
37.A~I为初中化学常见的物质,它们之间的转化关系如图1所示(只略去反应①的部分产物).其中B是紫红色金属,D、F为黑色固体,H是实验室中最常见的无色无味液体.
请回答:
(1)、若A在常温下为固体,则反应①的化学方程式为 , 图2中可用作该反应的发生装置是 (填字母);若A在常温下为液体,则A的化学式为 , 反应①的基本反应类型是 .(2)、在金属活动性顺序中,B位于铁的(填“前面”或“后面”).若要证明,所需试剂有:B的单质、铁的单质和(只填一种).(3)、G的化学式为 ,它不具有的性质有 (填字母).A.酸性 B.还原性 C.毒性 D.助燃性.
38. 请按要求完成下列金属性质的实验:(1)、研究一:金属与酸反应过程中的能量变化.
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应(填“吸热”或“放热”),反应的化学方程式为 .
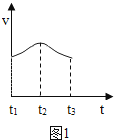
(2)实验测得反应中产生的气体的速率(v)与时间(t)的关系如图1,请根据t1﹣t2时间段反应速率变化,说明化学反应速率受 等因素影响.
 (2)、
(2)、研究二:金属与盐溶液反应过程中的相关变化.
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为 .
(2)在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,图2描述相关变化曲线,一定不正确的是 .
 39.
39.我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到一定温度,可以得到一种外观似金子的锌和铜的合金,不法分子用它来冒充黄金.小晨同学在实验室进行了木炭粉还原氧化亚铜的实验(主要反应:C+Cu2O
 2Cu+CO↑),她观察到反应后的固体不完全是紫红色,于是对该固体的成分进行了实验探究:
2Cu+CO↑),她观察到反应后的固体不完全是紫红色,于是对该固体的成分进行了实验探究:【提出问题】该固体的成分是什么?
【查阅资料】①Cu是紫红色固体
②Cu2O是红色固体
③Cu2O+H2SO4(稀)=CuSO4+Cu+H2O
(1)、【猜想与假设】猜想一:Cu
猜想二:Cu、Cu2O
猜想三:Cu、C
猜想四:Cu、Cu2O、C
小晨同学认为猜想 不正确,因为反应后的固体不完全是紫红色.
(2)、【实验探究】实验操作
实验现象
实验结论
步骤一:取少量固体置于烧杯中,加入足量稀硫酸,观察溶液颜色
溶液呈色
猜想三不正确
步骤二:把步骤一中所得混合物过滤,将滤渣干燥后置于滤纸上,观察固体颜色
固体为紫红色、黑色
猜想正确
(3)、【实验反思】由于受反应物质量比、反应物接触面积和反应温度等因素的影响,固体物质之间的反应可能无法完全进行.【拓展延伸】
(1)从理论上看,碳与氧化亚铜的质量比应为1:12,但实际做实验时却将碳与氧化亚铜的质量比控制在约1:10.这样操作的理由是 .
(2)下列可以用于鉴别真、假黄金的方法是 (填字母).
A.观察颜色 B.加热固体 C.滴加稀硫酸 D.滴加硝酸银溶液.
40.根据下列图示的探究过程,回答下列问题:
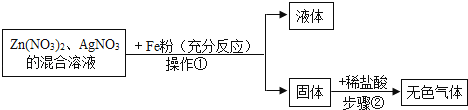 (1)、操作①的名称 .(2)、图中固体中含有的物质(化学式) .(3)、写出步骤②发生反应的化学方程式 .
(1)、操作①的名称 .(2)、图中固体中含有的物质(化学式) .(3)、写出步骤②发生反应的化学方程式 .