高中化学鲁科版(2019)选择性必修2 第2章第3节 离子健、配位键与金属键
试卷更新日期:2021-04-30 类型:同步测试
一、单选题
-
1. 三草酸合铁酸钾( )是制备铁触媒的主要原料。该配合物在光照下发生分解: 。下列说法错误的是( )A、Fe3+的最高能层电子排布式为 3d5 B、 中铁离子的配位数为 6 C、 中 C原子的杂化方式为 sp2 D、CO2 分子中σ键和π键数目比为1:12. 设X、Y、Z代表元素周期表中前20号的三种元素,已知X+和Y-具有相同的电子层结构;Y和Z两种元素可形成含4个原子核、42个电子常见的负一价阴离子。下列说法错误的是( )A、元素Y、Z组成的化合物可能属于离子化合物 B、元素Y的气态氢化物分子中含有18个电子 C、元素Z与元素X可形成化合物X2Z、X2Z2 D、元素Z的氢化物分子中可含有10个电子和18个电子3. 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法正确的是( )
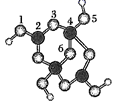 A、m=2 B、在Xm-中,硼原子轨道的杂化类型相同 C、1、2原子间和4、5原子间的化学键可能是配位键 D、Xm-中含离子键和配位键4. 下列各选项所述的两个量,前者一定大于后者的是 ( )
A、m=2 B、在Xm-中,硼原子轨道的杂化类型相同 C、1、2原子间和4、5原子间的化学键可能是配位键 D、Xm-中含离子键和配位键4. 下列各选项所述的两个量,前者一定大于后者的是 ( )①Al原子和N原子的未成对电子数 ②Ag+、Cu2+与NH3形成配合物时的配位数 ③H—F的键能与H—I的键能 ④F元素和O元素的电负性 ⑤N和O元素的第一电离能
A、①④⑤ B、②④ C、②④⑤ D、③④⑤5. 下列有关金属键的叙述中,错误的是( )A、金属键没有饱和性和方向性 B、金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用 C、金属键中的电子属于整块金属 D、金属的性质和金属固体的形成都与金属键有关6. 金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是( )A、Li Na K B、Na Mg Al C、Li Be Mg D、Li Na Mg二、填空题
-
7. 现有下列物质:
①N2②Na2O2③MgF2④NH4Cl⑤Na2CO3⑥NaOH⑦HCl⑧H2O2
(1)、属于离子化合物的物质是。(2)、属于共价化合物的物质是。(3)、只由非极性键构成的物质是。(4)、由离子键和极性键构成的物质是。(5)、由极性键和非极性键构成的物质是。8. 在下列空格中,填上适当的元素符号或微粒符号。(1)、在第3周期中,第一电离能最大的元素是 , 电负性最大的元素是 。(2)、在第4周期元素中,3d轨道半充满的 。(3)、在F2、H2O2、 NH3、 、H2O、 HBr中,含有配位键的微粒有 , 含有非极性键的微粒有; 空间构型是三角锥形的分子。三、综合题
-
9.(1)、I.下列是中学化学中熟悉的物质,请用序号完成下列问题。
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
这些物质中,只含共价键的是。只含离子键的是。既含共价键又含离子键的是。
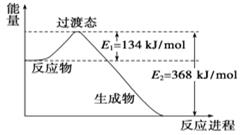
(2)、属于离子化合物的是。(3)、II.20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是(填“吸热”或“放热”)反应,NO2和CO的总能量(填“大于”、“小于”或“等于”)CO2和NO的总能量。
 (4)、已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.10. 根据要求完成下列问题:(1)、某元素原子共有 3 个价电子,其中一个价电子位于第三能层 d 轨道,试回答: 该元素核外价电子排布图为 , 电子排布式为。 该元素的原子序数为 , 该元素是元素(填“金属”或“非金属”),形成的单质为晶体。(2)、指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、。(3)、下列分子中若有手性原子,请用“*”标出其手性碳原子、。
(4)、已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.10. 根据要求完成下列问题:(1)、某元素原子共有 3 个价电子,其中一个价电子位于第三能层 d 轨道,试回答: 该元素核外价电子排布图为 , 电子排布式为。 该元素的原子序数为 , 该元素是元素(填“金属”或“非金属”),形成的单质为晶体。(2)、指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、。(3)、下列分子中若有手性原子,请用“*”标出其手性碳原子、。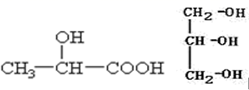 (4)、在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填编号)。(5)、试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4H2SO3;HClO3HClO4;(6)、根据价层电子对互斥理论判断下列问题:H2S 中心原子的杂化方式为杂化,VSEPR 构型为 , 分子的立体构型为。(7)、H2O 的沸点(100℃)比 H2S 的沸点(-61℃)高,这是由于。11. 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:(1)、下列粒子中可能存在配位键的是________A、CO2 B、H3O+ C、CH4 D、[Ag(NH3)2]+(2)、配位化学创始人维尔纳发现,将各为1mol的CoCl3•6NH3(黄色)、CoCl3•5NH3(紫红色)、CoCl3•4NH3(绿色)、CoCl3•4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,生成氯化银沉淀分别为3mol、2mol、1mol、和1mol。已知上述配合物中配离子的配位数均为6。请根据实验事实用配合物的形式写出它们的化学式。
(4)、在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填编号)。(5)、试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4H2SO3;HClO3HClO4;(6)、根据价层电子对互斥理论判断下列问题:H2S 中心原子的杂化方式为杂化,VSEPR 构型为 , 分子的立体构型为。(7)、H2O 的沸点(100℃)比 H2S 的沸点(-61℃)高,这是由于。11. 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:(1)、下列粒子中可能存在配位键的是________A、CO2 B、H3O+ C、CH4 D、[Ag(NH3)2]+(2)、配位化学创始人维尔纳发现,将各为1mol的CoCl3•6NH3(黄色)、CoCl3•5NH3(紫红色)、CoCl3•4NH3(绿色)、CoCl3•4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,生成氯化银沉淀分别为3mol、2mol、1mol、和1mol。已知上述配合物中配离子的配位数均为6。请根据实验事实用配合物的形式写出它们的化学式。①CoCl3•5NH3(紫红色)
②CoCl3•4NH3(紫色)
12. 根据要求完成下列问题:(1)、某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图 , 电子排布式。该元素形成的单质为晶体。(2)、指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、。(3)、在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号) 。(4)、试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):HClO3HClO4;H3PO4H3PO3。
(5)、根据价层电子对互斥理论判断下列问题:①NH3中心原子的杂化方式为杂化,VSEPR构型为 , 分子的立体构型为。
②BF3中心原子的杂化方式为杂化,分子的立体构型为。
(6)、H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于 。13. 金属镍在电池、合金、催化剂等方面应用广泛.(1)、下列关于金属及金属键的说法正确的是 .a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)、Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .(3)、过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= . CO与N2结构相似,CO分子内σ键与π键个数之比为 .(4)、甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 , 甲醇分子内的O﹣C﹣H键角(填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.