高中化学鲁科版(2019)选择性必修2 第2章第2节 共价键与分子的空间结构
试卷更新日期:2021-04-30 类型:同步测试
一、单选题
-
1. 下列物质与水混合后静置,不会出现分层现象的是( )A、汽油 B、苯 C、四氯化碳 D、乙醇2. 下图为N2分子在催化剂作用下发生一系列转化的示意图,下列叙述正确的是( )
 A、若N≡N键能是a kJ·mol-1 , H—H键能是b kJ·mol-1 , H—N键能是c kJ·mol-1 , 则每生成2 mol NH3 , 放出(6c-a-3b)kJ热量 B、NH3分子和H2O分子的中心原子杂化类型不同 C、催化剂a、b表面均发生了极性共价键的断裂 D、在催化剂b作用下发生转化得到的两种生成物,均为直线形分子3. 下列几组微粒互为等电子体的是( )
A、若N≡N键能是a kJ·mol-1 , H—H键能是b kJ·mol-1 , H—N键能是c kJ·mol-1 , 则每生成2 mol NH3 , 放出(6c-a-3b)kJ热量 B、NH3分子和H2O分子的中心原子杂化类型不同 C、催化剂a、b表面均发生了极性共价键的断裂 D、在催化剂b作用下发生转化得到的两种生成物,均为直线形分子3. 下列几组微粒互为等电子体的是( )① 和 ;②NO+和 CN-;③CO2和 CS2;④NO2 和CO2
A、仅①②③ B、仅②④ C、仅①③④ D、①②③④4. 下列中心原子采取sp2杂化且为非极性分子的是( )A、CS2 B、H2S C、SO2 D、SO35. 下列分子中的中心原子杂化轨道的类型相同的是( )A、CO2与SO2 B、CH4与NH3 C、BeCl2与BF3 D、C2H4与C2H26. 邮票背面的粘合剂可用水浸除去,根据“相似相溶”原理,该粘合剂的成分可能是( )A、 B、
B、 C、
C、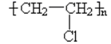 D、
D、 7. 下面有关叙述中,错误的是( )A、CH4中心原子的杂化轨道类型为sp3杂化 B、以非极性键结合起来的双原子分子一定是非极性分子 C、氯化钠晶体中,Na+和Cl-的配位数均为8 D、镍元素基态原子的电子排布式为:1s22s22p63s23p63d84s28. 下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )A、NH4+ B、PH3 C、H3O+ D、OF29. 下列有机物分子中有 3个手性碳原子的是( )A、乳酸CH3-CHOH-COOH B、甘油CH2OH-CHOH-CH2OH C、脱氧核糖CH2OH-CHOH-CHOH-CH2-CHO D、核糖CH2OH-CHOH-CHOH-CHOH-CHO10. 根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
7. 下面有关叙述中,错误的是( )A、CH4中心原子的杂化轨道类型为sp3杂化 B、以非极性键结合起来的双原子分子一定是非极性分子 C、氯化钠晶体中,Na+和Cl-的配位数均为8 D、镍元素基态原子的电子排布式为:1s22s22p63s23p63d84s28. 下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )A、NH4+ B、PH3 C、H3O+ D、OF29. 下列有机物分子中有 3个手性碳原子的是( )A、乳酸CH3-CHOH-COOH B、甘油CH2OH-CHOH-CH2OH C、脱氧核糖CH2OH-CHOH-CHOH-CH2-CHO D、核糖CH2OH-CHOH-CHOH-CHOH-CHO10. 根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )选项
分子式
中心原子杂化方式
价层电子对互斥模型
分子或离子的立体构型
A
SO2
sp
直线形
直线形
B
H2O
sp2
平面三角形
V形
C
NH3
sp2
三角锥形
三角锥形
D
CH4
sp3
正四面体形
正四面体形
A、A B、B C、C D、D二、填空题
-
11. 下列物质易溶于水的是 , 易溶于CCl4的是 (均填序号).
①NH3②CH4③
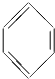 ④HCl ⑤C2H4⑥Br2⑦HNO3⑧SO2 . 12. 将下列粒子的序号填入相应空格内:①O2②CO2③H2O ④H2O2⑤(NH4)2SO4⑥SiCl4
④HCl ⑤C2H4⑥Br2⑦HNO3⑧SO2 . 12. 将下列粒子的序号填入相应空格内:①O2②CO2③H2O ④H2O2⑤(NH4)2SO4⑥SiCl4⑦C2H2⑧NH3⑨P4
只含有非极性键的非极性分子为;含极性键的非极性分子为;
同时含有共价键、配位键、离子键的物质为;正四面体分子为
含极性键的极性分子为;既含极性键,又含非极性键的极性分子为 .
13. 试用VSEPR理论判断下列分子或离子的立体构型,并判断中心原子的杂化类型:(1)、H2O形,杂化类型;(2)、CO32-形,杂化类型;(3)、SO32-形,杂化类型;三、综合题
-
14. 钛及其化合物在人们的生活中起着十分重要的作用。尤其是二氧化钛、四氯化钛、钛酸钡等应用极广,回答下列问题:(1)、基态钛原子的价电子排布式为 , 该基态原子中含 对电子对。(2)、二氧化钛是世界上最白的东西,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态 中的核外电子占据的原子轨道数为。(3)、四氯化钛是种有趣的液体,在湿空气中水解成白色的二氯化钛的水凝胶,在军事上利用四氧化钛的这股怪脾气,作为人造烟雾剂。四氯化钛水解反应的化学方程式为 。(4)、 是一种储氢材料,可由 和 反应制得。
①LiBH4由 和 构成, 的空间构型是 , B原子的杂化轨道类型是 , 写出一种与该阴离子互为等电子体的微粒是 。 中各元素的电负性大小顺序为。
②某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如表所示。M是 填元素符号 ,判断理由为。
738
1451
7733
10540
13630
15. A、B、C、D四种常见元素的结构信息如下表。试根据信息回答有关问题。元素
A
B
C
D
性质结构信息
最常见氢化物X为三角锥分子且能与 HCl发生化合反应生成盐
原子的 M 层上电子数比L层电子数少2个
ds区元素,N 层上有一个电子
原子的s电子数是p电子数的2倍
(1)、写出基态B原子的电子排布式:。(2)、向CSO4的溶液中逐滴加入过量X的水溶液,可生成的配合物的化学式为 , 该物质中不存在的作用类型为(填字母)。a.离子键 b.配位键 c.极性键 d.氢键
(3)、下列几种氢化物分子:① AH3 ②D2H2③H2B ④DH4
中心原子采用sp3杂化形成化学键的是 (填序号);在②的分子中有 个σ键,该分子中电子运动状态共有 种。
16. 现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B元素原子的核外p电子数与s电子数相等
C基态原子的价电子排布为nsn-1npn+1
D的能层数与C相同,且电负性比C大
E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大
F是前四周期中电负性最小的元素
G在周期表的第五列
(1)、C基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形,C简单离子核外有种运动状态不同的电子。(2)、A2B2难溶于CS2 , 简要说明理由:。(3)、G位于族区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为;F晶体的空间堆积方式为。(4)、ED3分子的VSEPR模型名称为 , 其中E原子的杂化轨道类型为。