高中化学鲁科版(2019)选择性必修2 第2章第1节 共价键模型
试卷更新日期:2021-04-30 类型:同步测试
一、单选题
-
1. 下列物质属于共价化合物的是( )A、NaCl B、CO2 C、CaCl2 D、NH4Cl2. 下列各组物质均既有离子键又有共价键的是( )A、KOH、H2SO4、NH4Cl B、CaO、Na2CO3、NH4HCO3 C、HClO、Al2O3、MgCl2 D、K2O2、NaOH、K2SO43. 下列叙述正确的是( )
①两种原子构成的分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有共价键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A、只有①⑦ B、只有②⑦ C、只有⑦ D、只有①⑤⑦4. 乙烯与氢气在Ni催化作用下加热可发生加成反应得到乙烷:C2H4(g)+H2(g)=C2H6(g) △H=-137.0 kJ/mol,已知: H-H键的键能为436 kJ/mol,C-H键的键能为413kJ/mol,则碳碳双键的键能与碳碳单键的键能之差为( )A、160 kJ/mol B、506 kJ/mol C、255 kJ/mol D、253 kJ/mol5. ①PH3的分子构型为三角锥形,②BeCl2的分子构型为直线形,③CH4分子的构型为正四面体形,④CO2为直线形分子,⑤BF3分子构型为平面正三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是( )A、①⑥为极性分子,②③④⑤为非极性分子 B、只有④为非极性分子,其余为极性分子 C、只有②⑤是极性分子,其余为非极性分子 D、只有①③是非极性分子,其余是极性分子6. 下列事实不能用键能的大小来解释的是 ( )A、N元素的电负性较大,但N2的化学性质很稳定 B、稀有气体一般难发生化学反应 C、HF、HCl、HBr、HI的稳定性逐渐减弱 D、F2比O2更容易与H2反应7. 下列各组物质含有的化学键类型完全相同的是:( )A、NaOH、CaCl2、CaO B、Na2O、Na2O2、Na2S C、NaCl、HCl、H2O D、HBr、CO2、NH38. 原子轨道在两核间以“肩并肩”方式重叠的键是( )A、σ键 B、π键 C、氢键 D、离子键二、填空题
-
9. 有下列七种物质:A、干冰 B、氧化镁 C、氯化铵 D、固态碘 E、烧碱 F、冰 G、过氧化钾(1)、熔化时需要破坏共价键和离子键的是(填序号,下同);(2)、既有离子键又有共价键的是;(3)、只含有极性键的是;(4)、含非极性键的是。10.(1)、用电子式表示H2O和MgBr2的形成过程:、。(2)、H2O以键结合,MgBr2以键结合。(填极性键、非极性键、离子键)11. 25 ℃和101 kPa下,H2(g)+Cl2(g) =2HCl(g) 能量变化如图,根据图示回答下列问题:
 (1)、结合图示,说明431kJ·mol-1表示的含义是。(2)、H2(g)+Cl2(g) = 2HCl(g) 的焓变ΔH =。
(1)、结合图示,说明431kJ·mol-1表示的含义是。(2)、H2(g)+Cl2(g) = 2HCl(g) 的焓变ΔH =。三、综合题
-
12. 氮原子可以形成σ键、π键、大π键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:(1)、1mol配合物K4[Fe(CN)6]中含σ键的数目为 , 基态氮原子价电子排布图不是
 ,是因为该排布方式违背了。 (2)、肼(N2H4)的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是。(3)、正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
,是因为该排布方式违背了。 (2)、肼(N2H4)的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是。(3)、正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。①Na3NO4阴离子的空间构型为 , 其中心原子杂化方式为。
②分别写出一种与Na3NO4的阴离子互为等电子体的阴离子和分子、(填化学式)。
(4)、冰的晶体结构模型如图a,它的晶胞与金刚石相似如图b,水分子之间以氢键相连接,一个水分子平均形成个氢键,若晶胞参数为d nm,则晶体密度计算式为g·cm-3 (用NA表示阿伏加德罗常数的值,不用化简)。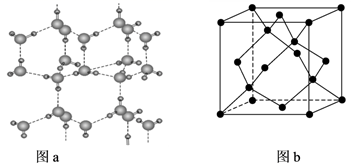 13. A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
13. A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:元素
有关性质或结构信息
A
其一种单质可吸收紫外线,是地球的保护伞
B
B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的
C
C与B同周期,且是所在周期中原子半径最大的(稀有气体除外)
D
D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味
E
E与D同周期,且在该周期中原子半径最小
F
F的氢化物和最高价氧化物的水化物反应生成一种离子化合物
G
G是形成化合物种类最多的元素
(1)、B元素符号为 , G的元素名称为 , 它的一种同位素可测定文物年代,这种同位素的符号是。(2)、A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为(填“离子化合物”或“共价化合物”),包含的化学键有(填“离子键”、“极性共价键”或“非极性共价键”)。(3)、F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为和 , 并用电子式表示出其最简单气态氢化物的形成过程。(4)、D在元素周期表中的位置 , D与E相比非金属性较强的是 (填元素名称),请从原子结构的角度解释原因:。(5)、KClO3可用于实验室制O2 , 若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:。