重庆市渝中区2021年中考化学模拟试卷
试卷更新日期:2021-04-29 类型:中考模拟
一、单选题
-
1. 为验证Fe、Cu、Ag 3种金属的活动性顺序,某小组同学设计了如图所示的4种实验方案(不做其他实验).其中不能达到目的是( )A、
 B、
B、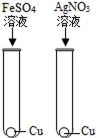 C、
C、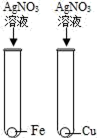 D、
D、 2. 物质加入水中能形成溶液的是( )A、植物油 B、水 C、白酒 D、大理石3. 小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )A、CO(NH2)2 B、KCl C、Ca3(PO4)2 D、KNO34. 下列各选项中,是考试用纸所具有的化学性质的为()A、白色 B、柔软 C、可燃 D、易撕碎5. 在氯化钡溶液中滴入某种溶液,生成白色沉淀,有关说法错误的是( )A、滴入的可能是硝酸银溶液 B、反应后溶液可能呈酸性 C、白色沉淀可能溶于盐酸 D、该反应是置换反应6. 根据你的生活经验,下列做法正确的是( )A、用水经常冲洗自行车以防生锈 B、用烧碱降低土壤酸性,改良土壤结构 C、用燃着的火柴检验石油液化气是否泄漏 D、用食醋除去热水瓶中的水垢(主要成分是碳酸钙和氢氧化镁)7. 近段时间,猪肉价格的不断上涨对国民的生活带来了一定的影响。猪肉的新鲜度可以通过测试pH来判断。由表可知:新鲜肉在变质过程中酸性强弱的变化为( )
2. 物质加入水中能形成溶液的是( )A、植物油 B、水 C、白酒 D、大理石3. 小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )A、CO(NH2)2 B、KCl C、Ca3(PO4)2 D、KNO34. 下列各选项中,是考试用纸所具有的化学性质的为()A、白色 B、柔软 C、可燃 D、易撕碎5. 在氯化钡溶液中滴入某种溶液,生成白色沉淀,有关说法错误的是( )A、滴入的可能是硝酸银溶液 B、反应后溶液可能呈酸性 C、白色沉淀可能溶于盐酸 D、该反应是置换反应6. 根据你的生活经验,下列做法正确的是( )A、用水经常冲洗自行车以防生锈 B、用烧碱降低土壤酸性,改良土壤结构 C、用燃着的火柴检验石油液化气是否泄漏 D、用食醋除去热水瓶中的水垢(主要成分是碳酸钙和氢氧化镁)7. 近段时间,猪肉价格的不断上涨对国民的生活带来了一定的影响。猪肉的新鲜度可以通过测试pH来判断。由表可知:新鲜肉在变质过程中酸性强弱的变化为( )名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.7
A、变强 B、变弱 C、不变 D、无法确定8. 以下物质的化学式书写符合题意,且属于氧化物的是( )A、氢氧化镁Mg(OH)2 B、碳酸钡Ba2CO3 C、五氧化二氮N2O5 D、氧化铁FeO9. 金属及其合金在生产生活中应用广泛。下列关于金属及其合金的说法中错误的是( )A、铁是地壳中含量最丰富的金属元素 B、不锈钢的抗腐蚀性好,可用于制造医疗器械 C、焊锡熔点较低,可以用来焊接金属 D、合金中至少含有一种金属10. 甲化工厂排放的酸性污水和乙化工厂排放的污水,共含有以下6种离子中的各3种:K+、OH-、 、Ba2+、H+、 ,则乙化工厂排放的污水中所含有的3种离子是( )A、K+、OH﹣、H+ B、K+、OH﹣、 C、Ba2+、OH﹣、 D、OH﹣、K+、Ba2+11. 有一种“即食即热型”快餐,适合外出旅行用。其内层用铝箔包裹食品,外层则是分别包裹的两种化学物质,使用时拉动预留在外的开关,使两种化学物质发生化学反应,此时便可以对食物进行加热。这两种化学物质最适合的选择是( )A、浓硫酸与水 B、熟石灰与水 C、生石灰与水 D、氯化钠与水12. 颜料的制作常常用到铬酸钠(化学式Na2CrO4),铬酸钠中铬元素(Cr)的化合价为( )A、+2 B、+3 C、+5 D、+613. 实验室中的下列物质对密封保存要求不严格的是( )A、浓硫酸 B、氢氧化钠 C、浓盐酸 D、木炭粉14. 除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )选 项
物质(括号内为杂质)
试 剂
操作方法
A
CaO(CaCO3)
水
溶解、过滤、结晶
B
CO2(CO)
足量的O2
点燃
C
HCl(H2SO4)
适量的氯化钡溶液
过滤
D
NaCl(NaOH)
适量的硫酸
蒸发结晶
A、A B、B C、C D、D15. 甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( ) A、t2℃时,在相同质量的水中达到饱和状态时,甲比乙溶解的溶质多 B、t1℃时,向100g水中加入80g甲可得160g饱和溶液 C、t1℃时,甲、乙饱和溶液的溶质量分数相等,但溶液质量不一定相等 D、t2℃时,将等质量的甲、乙两种饱和溶液分别降温到t1℃,所得溶液的溶质质量分数一定不相等16. 下列图象不能正确反映对应变化关系的是( )A、向等质量的铝、锌中分别加入足量的等溶质质量分数的稀盐酸
A、t2℃时,在相同质量的水中达到饱和状态时,甲比乙溶解的溶质多 B、t1℃时,向100g水中加入80g甲可得160g饱和溶液 C、t1℃时,甲、乙饱和溶液的溶质量分数相等,但溶液质量不一定相等 D、t2℃时,将等质量的甲、乙两种饱和溶液分别降温到t1℃,所得溶液的溶质质量分数一定不相等16. 下列图象不能正确反映对应变化关系的是( )A、向等质量的铝、锌中分别加入足量的等溶质质量分数的稀盐酸 B、向盐酸溶液中加入少量AgNO3固体
B、向盐酸溶液中加入少量AgNO3固体  C、一定量的镁在过量的氧气中充分燃烧
C、一定量的镁在过量的氧气中充分燃烧  D、加热KClO3和MnO2固体混合物制取O2
D、加热KClO3和MnO2固体混合物制取O2 
二、填空题
-
17. 请用化学用语填空。(1)、氖气。(2)、钙原子。(3)、两个氢氧根。(4)、氯酸钾。18. 元素周期表是学习和研究化学的重要工具,其内容十分丰富。下表是元素周期表的部分内容,请解答下列问题:
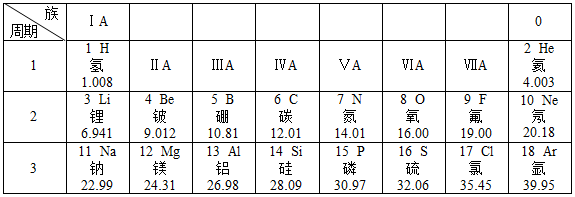 (1)、从表中查出硅(Si)元素的相对原子质量为 , 其原子序数为10的元素符号为。(2)、硫元素在第周期,在化学反应中易电子(填“得到”或“失去”)。(3)、表中不同种元素最本质的区别是(填序号)。
(1)、从表中查出硅(Si)元素的相对原子质量为 , 其原子序数为10的元素符号为。(2)、硫元素在第周期,在化学反应中易电子(填“得到”或“失去”)。(3)、表中不同种元素最本质的区别是(填序号)。A 中子数不同 B 质子数不同 C 相对原子质量不同 D 核外电子数
(4)、从上表中我们还可以探究出以下规律:①原子序数与原子核电荷数在数值上相等;
②每一周期的元素具有相同的;
③等。
三、简答题
-
19. 小松观察了课堂“灭火器原理”实验后,决定用500 mL 左右的饮料瓶代替原实验装置的吸滤瓶来完成,他用大头针在瓶子上端打 6~7 个小孔并标记,向瓶内装 250 mL 左右的碳酸钠溶液及少量洗涤剂,小试管装满盐酸并用一根比饮料瓶高度略小的玻璃棒插入试管(顶住试管),拧紧瓶盖,将饮料瓶倒置,可观察到液体和泡沫喷出,如图所示。
 (1)、根据实验可以得出水基型灭火器具有的优点是(写一点)。(2)、水基型灭火器的灭火原理有; 家用电器着火一般选用(选填“水基型灭火器”或“干粉灭火器”)。(3)、有学生观看该实验后很兴奋,并提出“要是我换个大点的饮料瓶,加足料就可以做家庭灭火器了”。你觉得他的观点如果实施的话,存在什么安全隐患?。
(1)、根据实验可以得出水基型灭火器具有的优点是(写一点)。(2)、水基型灭火器的灭火原理有; 家用电器着火一般选用(选填“水基型灭火器”或“干粉灭火器”)。(3)、有学生观看该实验后很兴奋,并提出“要是我换个大点的饮料瓶,加足料就可以做家庭灭火器了”。你觉得他的观点如果实施的话,存在什么安全隐患?。四、科学探究题
-
20. 某同学用氢氧化钾与稀硫酸做中和反应实验时,用pH传感器测得溶液的pH变化如图所示,回答下列问题。
 (1)、写出对应的化学方程式。(2)、本反应是的操作是。(3)、取A点溶液少量于试管中滴加紫色石蕊溶液的现象是。(4)、曲线上点表示酸和碱恰好完全反应。(5)、C点溶液呈性,溶液中含有溶质的名称是。21. 老师在实验室将浸泡了硫酸铜溶液的蓝色滤纸在酒精灯火焰上加热,观察到滤纸变白色,由湿润变干燥后燃烧起来;在燃烧后的灰烬中有少量红色固体。同学们很好奇,对红色固体的成分进行了下列探究。
(1)、写出对应的化学方程式。(2)、本反应是的操作是。(3)、取A点溶液少量于试管中滴加紫色石蕊溶液的现象是。(4)、曲线上点表示酸和碱恰好完全反应。(5)、C点溶液呈性,溶液中含有溶质的名称是。21. 老师在实验室将浸泡了硫酸铜溶液的蓝色滤纸在酒精灯火焰上加热,观察到滤纸变白色,由湿润变干燥后燃烧起来;在燃烧后的灰烬中有少量红色固体。同学们很好奇,对红色固体的成分进行了下列探究。(提出问题)红色固体是什么物质?
(查阅资料)①硫酸铜晶体或硫酸铜溶液为蓝色;无水硫酸铜是一种白色固体;温度达到200 ℃时,CuSO4开始分解生成CuO和另一种氧化物,反应过程中元素的化合价不变;
②温度超过1 000 ℃时,CuO分解生成红色的Cu2O;Cu2O难溶于水,但能与稀硫酸发生反应,生成Cu2+和Cu。
(1)、(猜想与假设)猜想1:红色固体是Cu;猜想2:红色固体是Cu2O;
猜想3:红色固体是;
猜想4:红色固体是Fe2O3。
(2)、(进行实验)将红色固体加入足量的稀硫酸中,无明显现象,说明猜想成立。(3)、(交流讨论)通过讨论,同学们一致认为猜想4不成立,理由是。
(4)、加热时,浸有硫酸铜溶液的滤纸刚开始不燃烧,原因是。(5)、实验中,CuSO4受热分解生成CuO和(填化学式)。(6)、滤纸的组成元素是C、H、O,实验中产生铜的原因可能是滤纸在燃烧过程中产生的碳与分解产生的氧化铜发生了反应;同时该实验还说明滤纸的着火点低于1 000 ℃,理由是。
五、流程题
-
22. 氧化镁在医药、建筑等行业应用广泛。以菱镁矿(主要成分为MgCO3 , 含少量FeCO3 , 其他杂质不溶于酸)为原料制备高纯氧化镁的实验流程如下:
 (1)、酸溶之前要将矿石粉碎的目的是 。稀硫酸需要过量的目的是 。酸溶步骤中碳酸镁溶解的反应方程式为 。(2)、已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如下表:
(1)、酸溶之前要将矿石粉碎的目的是 。稀硫酸需要过量的目的是 。酸溶步骤中碳酸镁溶解的反应方程式为 。(2)、已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如下表:Mg2+
Fe2+
Fe3+
开始沉淀
9.4
7.9
2.7
沉淀完全
12.4
9.6
3.7
流程“氧化”一步中H2O2的作用是将溶液中的Fe2+转化成Fe3+ , 不能直接沉淀Fe2+的原因是 。
(3)、加氨水调节溶液的pH范围为 。(4)、滤渣2的化学式是 。六、实验题
-
23. 实验员王老师要配制80克质量分数为10%的NaCl溶液供同学们使用,如图表示了他的实验操作过程。

回答下列问题:
(1)、写出标号①-④各仪器的名称。①②③④(2)、B操作中应称NaCl的质量是g,称量时若指针偏右,应进行的操作是;(3)、D操作中仪器③的规格应是(选填“50mL”或“100mL”),读数时应使视线与;(4)、E操作中④的作用是;(5)、下列不正确操作可能导致溶质的质量分数偏小的是(填序号);①B操作中砝码与NaCl放颠倒了 ②D操作中仰视凹液面最低处读数;
③D操作中有少量水溅出 ④F操作中溶液洒落。
(6)、配制该溶液的正确步骤应是(填序号)。七、计算题
-
24. 称取NaCl和BaCl2的固体混合物32、5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:(提示:BaCl2+Na2SO4═BaSO4↓+2NaCl)
 (1)、完全反应后生成BaSO4沉淀g.(2)、恰好完全反应时消耗Na2SO4溶液的质量是克?(3)、恰好完全反应时所得溶液中溶质的质量分数是?(精确到0.1%)
(1)、完全反应后生成BaSO4沉淀g.(2)、恰好完全反应时消耗Na2SO4溶液的质量是克?(3)、恰好完全反应时所得溶液中溶质的质量分数是?(精确到0.1%)
-
-
-