山东省济南市高新区2021年中考化学一模试卷
试卷更新日期:2021-04-29 类型:中考模拟
一、单选题
-
1. 化学在不断推动着人类社会向前发展。下列过程中,没有发生化学变化的是( )A、火箭发射
 B、煤气燃烧
B、煤气燃烧  C、矿石粉碎
C、矿石粉碎  D、葡萄酿酒
D、葡萄酿酒  2. “改环境质量,建设美丽泉城”是济南市民共同的责任,下列选项中,不利于生态环境保护的是( )A、植树造林种花种草爱护泉池 B、生活中提倡垃圾分类回收 C、家离学校近的同学徒步上学 D、购物多用塑料袋盛放物品3. “民以食为天。食以安为先”,要保好人民群众“舌尖上的安全”,下列做法中,符合食品安全要求的是( )A、霉变的食物经蒸煮后可以食用 B、种植韭菜为防生虫用剧毒农药 C、烹调食物时使用适量食盐调味 D、用甲醛溶液浸泡海产品来防腐4. 严谨的实验态度是实验取得成功的保证,下列实验操作中,正确的是( )A、制取气体时,先检查装置的气密性 B、将pH试纸伸入碳酸钠溶液中测pH C、用燃着的酒精灯点燃另一盏酒精灯 D、实验结束后把剩余的药品放回原瓶5. 某粒子结构示意图如图所示,下列对该粒子的判断中,错误的是( )
2. “改环境质量,建设美丽泉城”是济南市民共同的责任,下列选项中,不利于生态环境保护的是( )A、植树造林种花种草爱护泉池 B、生活中提倡垃圾分类回收 C、家离学校近的同学徒步上学 D、购物多用塑料袋盛放物品3. “民以食为天。食以安为先”,要保好人民群众“舌尖上的安全”,下列做法中,符合食品安全要求的是( )A、霉变的食物经蒸煮后可以食用 B、种植韭菜为防生虫用剧毒农药 C、烹调食物时使用适量食盐调味 D、用甲醛溶液浸泡海产品来防腐4. 严谨的实验态度是实验取得成功的保证,下列实验操作中,正确的是( )A、制取气体时,先检查装置的气密性 B、将pH试纸伸入碳酸钠溶液中测pH C、用燃着的酒精灯点燃另一盏酒精灯 D、实验结束后把剩余的药品放回原瓶5. 某粒子结构示意图如图所示,下列对该粒子的判断中,错误的是( ) A、该粒子属于金属元素 B、该粒子原子核内有11个中子 C、该元素的一个离子中含有10个电子 D、在发生化学变化时易变成阳离子6. “生命高于一切”。下列有关安全问题的做法中,正确的是( )A、冬季用煤炉取暖时,注意门窗通风 B、在窖井等有沼气的井盖口燃放鞭炮 C、高楼着火,乘坐电梯离开火场 D、家用电器着火时,立即用水扑灭7. 一些食物的近似pH如下:葡萄汁3.5~4.5;苹果汁2.9~3.3;牛奶6.3~6.6;鸡蛋清7.6~8.0,则下列说法中,错误的是( )A、胃酸过多的人应少饮葡萄汁 B、苹果汁能使石蕊试液变红色 C、鸡蛋清为碱性食品 D、牛奶比苹果汁的酸性强8. 下列有关分子的说法中,错误的是( )A、分子是构成物质的一种基本粒子 B、水变成水蒸气,说明分子之间存在间隔 C、分子的质量和体积一定比原子的质量和体积大 D、在化学变化中,分子可以再分而原子不能再分9. 金属铝可与氢氧化钠溶液发生如下反应:2Al+2NaOH+2H2O=2NaAlO2+3X↑,关于此反应的叙述错误的是( )A、X 的化学式为 H2 B、反应前后有元素的化合价发生改变 C、该反应前后溶液的质量减小 D、由此说明铝锅不宜长时间盛放碱性食品10. 下列说法中,错误的是( )A、海水晒盐是通过蒸发结晶实现的 B、生成盐和水的反应一定是中和反应 C、消毒用的碘酒中碘是溶质、酒精是溶剂 D、饱和溶液与不饱和溶液在一定条件下可以相互转化11. 宏观与微观相结合是化学学科的思维特点。某化学反应的微观过程如图,下列有关说法中,错误的是( )
A、该粒子属于金属元素 B、该粒子原子核内有11个中子 C、该元素的一个离子中含有10个电子 D、在发生化学变化时易变成阳离子6. “生命高于一切”。下列有关安全问题的做法中,正确的是( )A、冬季用煤炉取暖时,注意门窗通风 B、在窖井等有沼气的井盖口燃放鞭炮 C、高楼着火,乘坐电梯离开火场 D、家用电器着火时,立即用水扑灭7. 一些食物的近似pH如下:葡萄汁3.5~4.5;苹果汁2.9~3.3;牛奶6.3~6.6;鸡蛋清7.6~8.0,则下列说法中,错误的是( )A、胃酸过多的人应少饮葡萄汁 B、苹果汁能使石蕊试液变红色 C、鸡蛋清为碱性食品 D、牛奶比苹果汁的酸性强8. 下列有关分子的说法中,错误的是( )A、分子是构成物质的一种基本粒子 B、水变成水蒸气,说明分子之间存在间隔 C、分子的质量和体积一定比原子的质量和体积大 D、在化学变化中,分子可以再分而原子不能再分9. 金属铝可与氢氧化钠溶液发生如下反应:2Al+2NaOH+2H2O=2NaAlO2+3X↑,关于此反应的叙述错误的是( )A、X 的化学式为 H2 B、反应前后有元素的化合价发生改变 C、该反应前后溶液的质量减小 D、由此说明铝锅不宜长时间盛放碱性食品10. 下列说法中,错误的是( )A、海水晒盐是通过蒸发结晶实现的 B、生成盐和水的反应一定是中和反应 C、消毒用的碘酒中碘是溶质、酒精是溶剂 D、饱和溶液与不饱和溶液在一定条件下可以相互转化11. 宏观与微观相结合是化学学科的思维特点。某化学反应的微观过程如图,下列有关说法中,错误的是( ) A、该反应不属于置换反应 B、物质甲的化学式为C2H2 C、该反应生成的两种物质均为氧化物 D、参加反应的甲、乙两物质的质量比是2:512. 除去下列物质中含有的少量杂质,所用试剂和方法中,正确的是( )
A、该反应不属于置换反应 B、物质甲的化学式为C2H2 C、该反应生成的两种物质均为氧化物 D、参加反应的甲、乙两物质的质量比是2:512. 除去下列物质中含有的少量杂质,所用试剂和方法中,正确的是( )选项
物质
杂质
除杂质所用试剂和方法
A
Cu(NO3)2溶液
AgNO3溶液
加入过量的铜粉,过滤
B
CaO固体
CaCO3
加水,溶解,过滤
C
NaOH溶液
Na2CO3溶液
加入适量稀盐酸至不再产生气泡
D
CO2
HCl
将混合气体通入足量NaOH溶液,干燥
A、A B、B C、C D、D13. 向一定质量的FeCl2和CuCl2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得滤液M和滤渣N。向滤渣N中加入稀盐酸,有无色气体产生,根据实验现象分析判断下列说法中,正确的是( )A、滤液M的颜色一定为无色 B、滤液M中一定含有Zn2+和Fe2+ C、滤渣N的质量一定小于加入锌粉的质量 D、滤渣N中一定含有Zn、Fe和Cu二、多选题
-
14. 某同学想用实验证明CuSO4溶液显蓝色是由Cu2+造成的,而不是 离子造成的,他设计的下列实验操作中,无意义的是( )A、在酒精灯的火焰上加热铜丝,铜丝由红色变为黑色,且质量增加 B、对比不同浓度的CuSO4溶液的颜色差异,浓度小的溶液颜色较浅 C、向CuSO4溶液中滴加足量氯化钡溶液,充分反应后,溶液颜色未消失 D、观察Na2SO4溶液,溶液没有颜色15. 知: 。将16gCu2O和Cu的混合物放入100g溶质质量分数为12%的的稀硫酸中,搅拌使之充分反应,过滤、洗涤、干燥得8g固体,下列有关说法中,正确的是( )A、反应后溶液中溶质的质量为16g B、原混合物中含12.8g的铜元素 C、原混合物中Cu2O与Cu的质量之比为9:1 D、向反应后的溶液中加入一定量的铁粉有气泡产生
三、填空题
-
16.(1)、按要求从氧化镁、氯化银、甲烷、硫酸中诜择合适的物质,将其化学式填写在下列横线上。
①一种可燃性的气体。
②一种金属氧化物。
③一种不易挥发的酸。
④一种难溶性的盐。
(2)、茶是世界三大饮品之一。“国际茶日”于2019年第74届联合国大会宣布设立,时间为每年5月21日,以赞美茶叫对经济、社会和文化的价值,是以中国为主的产茶国家首次成功推动设立的农业领域国际性节日。今年5月21日,是第二个“国际茶日”。
①茶又称“茗”,茶文化是中华文化宝库中的一朵奇葩。在泡茶过程中,会闻到茶特有的香气,这是因为。茶壶中的茶漏依据了的原理将茶叶和茶水分离。
②茶叶中含有咖啡因(分了式为 C8H10O2N4),咖啡因属于(填“混合物”“有机物”“无机物”之一),它的一个分子中含有个原子。
③咖啡因是众所周知的兴奋剂,但人们饮茶时往往感到放松、平静、心情舒畅,现已证实这主要是茶氨酸的作用。茶氨酸(C7H14N2O3)是茶树特有的一种氨基酸。茶氨酸中氮元素与氧元素的质量比为(填最简整数比)。
④目前常用聚乙烯包装茶叶,聚乙烯属于材料中的(填选项序号之一)。
A天然材料B合成材料 C复合材料 D金属材料
17.(1)、3月12日1时51分,我国在文昌航大发射场成功完成长征七号改遥二运载火箭发射,本次发射的试验九号卫星主要用于空间环境监测等新技术在轨验证试验。这次任务是长征系列运载火箭的第362次飞行。①卫星上的太阳能电池是将能转化为电能的装置。
②火箭的姿控系统使用耐辐照石英攻璃作为光学材料,其主要成分为二氧化硅,其中硅元素的化合价为。
③航天工程中需要大量的金属材料。西汉《淮南万毕术》中记载“曾青得铁则化为铜”,说明在汉代我国已掌握了用铁置换铜的湿法炼铜方法,写出用铁和硫酸铜为原料进行湿法炼铜的化学方程式: , 上述反应说明了单质铜的金属活动性比单质铁(填“强”“弱”之一)。
(2)、我围化学家侯德榜创立了侯氏制碱法,开创了世界制碱工业的新纪元,“制碱”生产过程涉及到Na2CO3、NaHCO3、NH4Cl等多种物质,其中NaHCO3和NH4Cl两物质的溶解度曲线如图所示。试回答下列问题:
①t1℃时, NaHCO3的溶解度NH4Cl的溶解度(填“大于”“等于”“小于”之一)。
②在t1℃时,向60g水中加入20gNH4Cl充分溶解,所得溶液是该温度下NH4Cl的溶液(填“饱和”“不饱和”之一)。
③将t2℃时 NaHCO3的饱和溶液降温至t1℃,此时溶液的溶质质量分数将(填“增大”“减小”“不变”之一)。
18.(1)、实验室有失去标签的三瓶无色溶液,已知分别是盐酸、氯化钠溶液和碳酸钠溶液中的一种,要求只用无色酚酞一种试剂鉴别它们。请完成如下实验:①取少量三种溶液分别加入到A、B、C三支试管中,各滴加2滴无色酚酞试液,观察A试管中的溶液呈红色,B、C两支试管中溶液仍为无色。
②任取剩下的两种溶液中的一种,滴入上述实验后的A试管中,若观察到A试管中 , 则滴入的是溶液(写化学式)。
(2)、已知在某化肥KNO3样品中可能混入了NH4Cl、(NH4)2SO4、Fe2O3三种物质中的一种或多种,为推测混入的物质种类,现按如图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。
试根据实验过程和发生的现象填写以下空白:
①产生的气体B是(写化学式)。
②溶液E中,一定存在的酸根离子是(写离子符号)。
③在化肥样品中,上述三种物质中肯定不存在的物质是(写化学式)。
④写出实验过程④中发生反应的化学方程式。
19.(1)、家庭厨房实际上是一个化学世界。①厨房中常用的食材有大米、面粉、食用油、鸡蛋、青菜等,其中富含维生素的食材是。
②平衡膳食是健康饮食的重要保证。牛肉和鸡蛋中富含的营养素是。
③常用洗洁精清洗餐具上的油污,这是因为洗洁精具有(填“溶解”“乳化”之一)作用。
④放置的铁锅出现锈蚀,主要是铁与空气中的(写化学式)发生化学反应的结果。
(2)、称取15.6gNa2CO3和NaOH的混合物放入烧杯中,向烧杯中加入100g水,固体全部溶解。向所得溶液中滴加Ba(OH)2溶液,生成沉淀的质量与滴加Ba(OH)2溶液的质量关系曲线如图所示。试回答: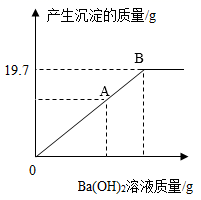
①当滴入Ba(OH)2溶液至图中A点时,烧杯中溶液里含有的溶质是(写化学式)。
②当滴加Ba(OH)2溶液至图中B点时,溶液中溶质的量为多少?(写出计算过程)
四、实验题
-
20. 如图所示为常见气体制备、干燥和性质实验的部分仪器。试根据题目要求,回答下列问题:

 (1)、以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求连接仪器,并检验装置的气密性。(提示:盐酸中挥发出的少量氯化氢气体可用饱和碳酸氢钠溶液吸收)。
(1)、以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求连接仪器,并检验装置的气密性。(提示:盐酸中挥发出的少量氯化氢气体可用饱和碳酸氢钠溶液吸收)。①所选装置的连接顺序为(从左至右填写仪器序号字母)。
②装置A中,发生反应的化学方程式为。
③实验室制取二氧化碳后的剩余废液中,常含有少量盐酸,欲检验盐酸的存在,可选择下列试剂中的进行验证(填选项序号之一)。
A硝酸银溶液 B酚酞试液 C碳酸钠溶液 D澄清石灰水
(2)、欲用一氧化碳气体测定某10g不纯氧化铁样品的纯度(杂质不反应),并验证反应中气体生成物的性质(假设发生的化学反应都充分反应)。所选装置的连接顺序为:CO气体→D→C。①装置C的作用是。
②通过测量反应前、后D处大玻璃管的质量变化,来计算氧化铁样品的纯度,测得D中硬质玻璃管内固体质量减少2.4g,则氧化铁样品中氧化铁的质量分数为。