山东省临沂市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 材料是人类生存和发展的物质基础。下列说法错误的是( )A、“山东舰”上的拦阻索是一种特种钢缆,属于新型无机非金属材料 B、“玉兔二号”月球车的帆板太阳能电池的材料是硅 C、天然橡胶是难降解材料,主要成分是聚异戊二烯 D、铝锂合金,强度大,密度小,用于制造飞机可减轻机身重量2. 从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
A
B
C
D




海带灼烧成灰
过滤得含I-溶液
放出碘的苯溶液
分离碘并回收苯
A、A B、B C、C D、D3. 下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )A、 和 B、 和
C、乙炔和苯
D、葡萄糖和果糖
4. 代表阿伏加德罗常数的值,下列有关叙述正确的是( )A、 苯中所含碳碳双键数为 B、标准状况下, 含有分子数为 C、常温常压下, 与 的混合气体中所含氢原子数为 D、含有 个 胶粒的氢氧化铁胶体中,铁元素的质量为5. 下列有关化学用语表示正确的是( )A、 的结构示意图:
B、 和
C、乙炔和苯
D、葡萄糖和果糖
4. 代表阿伏加德罗常数的值,下列有关叙述正确的是( )A、 苯中所含碳碳双键数为 B、标准状况下, 含有分子数为 C、常温常压下, 与 的混合气体中所含氢原子数为 D、含有 个 胶粒的氢氧化铁胶体中,铁元素的质量为5. 下列有关化学用语表示正确的是( )A、 的结构示意图: B、乙烯的空间充填模型:
B、乙烯的空间充填模型:  C、质子数为53、中子数为78的碘原子:
D、 的电子式:
6. 关于钠元素的单质及其化合物的叙述错误的是( )A、钠是银白色金属,质软,熔点相对较低,密度比水小 B、 与 反应, 作还原剂 C、 和 都能由金属钠和氧气化合生成,但 和 中O的价态不同 D、用洁净的铂丝蘸取待测液,置于火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,则该溶液中一定含有钾离子,可能含有钠离子7. 糖类、油脂、蛋白质是基本的营养物质。下列说法正确的是( )A、淀粉和纤维素互为同分异构体 B、可以用 的 溶液鉴别动物油和植物油 C、醋酸铅溶液、乙醇、 溶液、甲醛等化学试剂会使蛋白质失去生理活性 D、糖类、油脂、蛋白质一定条件下都能水解8. 下列离子在指定溶液中能大量共存的是( )A、 溶液中: 、 、 、 B、某无色透明溶液中: 、 、 、 C、能使酚酞变红的溶液中: 、 、 、 D、 溶液中: 、 、 、9. 下列实验设计及其对应的离子方程式均正确的是( )A、用氨水和硫酸铝溶液制备 : B、 与 反应制备 : C、将氯气溶于水制备次氯酸: D、用小苏打治疗胃酸过多:10. 将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: 。可以判断该分解反应已经达到平衡的是
C、质子数为53、中子数为78的碘原子:
D、 的电子式:
6. 关于钠元素的单质及其化合物的叙述错误的是( )A、钠是银白色金属,质软,熔点相对较低,密度比水小 B、 与 反应, 作还原剂 C、 和 都能由金属钠和氧气化合生成,但 和 中O的价态不同 D、用洁净的铂丝蘸取待测液,置于火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色,则该溶液中一定含有钾离子,可能含有钠离子7. 糖类、油脂、蛋白质是基本的营养物质。下列说法正确的是( )A、淀粉和纤维素互为同分异构体 B、可以用 的 溶液鉴别动物油和植物油 C、醋酸铅溶液、乙醇、 溶液、甲醛等化学试剂会使蛋白质失去生理活性 D、糖类、油脂、蛋白质一定条件下都能水解8. 下列离子在指定溶液中能大量共存的是( )A、 溶液中: 、 、 、 B、某无色透明溶液中: 、 、 、 C、能使酚酞变红的溶液中: 、 、 、 D、 溶液中: 、 、 、9. 下列实验设计及其对应的离子方程式均正确的是( )A、用氨水和硫酸铝溶液制备 : B、 与 反应制备 : C、将氯气溶于水制备次氯酸: D、用小苏打治疗胃酸过多:10. 将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: 。可以判断该分解反应已经达到平衡的是① ②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中氨气的体积分数不变( )
A、①② B、②③ C、③④ D、①④11. 下列图示箭头方向表示与某种常见试剂在通常条件下发生转化,其中6步转化均能一步实现的一组物质是( )选项
W
X
Y
Z

A
B
C
D
S
A、A B、B C、C D、D12. 短周期主族元素X、Y、Z、W的原子序数依次增大。Y是地壳中含量最高的元素,X、Y原子的最外层电子数之比为2:3,Z是短周期中金属性最强的元素,W原子与X原子的最外层电子数相同。下列说法正确的是( )A、Z位于元素周期表中第2周期ⅠA族 B、X的非金属性比Y的强 C、W的简单气态氢化物的热稳定性比X的强 D、原子半径:r(Y) < r(X) < r(W) < r(Z)13. 中国化学家研究出一种新型复合光催化剂( ),能利用太阳光高效分解水,原理如图所示。
下列说法错误的是( )
A、通过该催化反应,实现了太阳能向化学能的转化 B、反应Ⅰ中涉及到非极性键的断裂和极性键的形成 C、反应Ⅱ为: 2H2O2 H2O+O2↑ D、该过程中催化剂降低了反应的活化能14. 根据下列实验操作,预测的实验现象和实验结论或解释正确的是( )实验操作
预测的实验现象
实验结论或解释
A
向饱和碳酸钠溶液中滴加少量稀盐酸
立即有气体逸出
B
将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口
品红试纸褪色
具有漂白性
C
将点燃的镁条置于盛有 的集气瓶中
瓶内壁有黑色固体生成
镁与 发生置换反应
D
向淀粉的酸性水解液中滴入少量新制 悬浊液并加热
有砖红色沉淀生成
葡萄糖具有还原性
A、A B、B C、C D、D15. 下表为某有机物与各种试剂反应的现象,则这种有机物可能是( )试剂
钠
溴水
溶液
现象
放出气体
褪色
有气体放出
A、 B、 C、 D、16. LED产品的使用为城市增添色彩,如图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( ) A、a处通入氧气,b处通氢气 B、通入 的电极发生反应: C、电池放电后, 的物质的量浓度减小 D、该装置将化学能最终转化为电能
A、a处通入氧气,b处通氢气 B、通入 的电极发生反应: C、电池放电后, 的物质的量浓度减小 D、该装置将化学能最终转化为电能二、综合题
-
17. 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、 ”元素的代言人。回答下列问题:(1)、汞的原子结构示意图
 ,汞在周期表中位于第周期。 (2)、 、 、 分别为氮、氧、硫3种元素对应的氢化物,其中最稳定的是。(3)、下列有关性质的比较能用元素周期律解释的是。
,汞在周期表中位于第周期。 (2)、 、 、 分别为氮、氧、硫3种元素对应的氢化物,其中最稳定的是。(3)、下列有关性质的比较能用元素周期律解释的是。a.酸性:
b.非金属性:
c.碱性:
d.热稳定性:
(4)、硒( )与硫位于同一主族,均是生命必需元素。下列推断正确的是。a.硒元素的最低负化合价为 价
b.二氧化硒( )具有还原性
c.硒的氧化物对应的水化物属于强酸
(5)、科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
①Y的元素符号为。
②X的氢化物的电子式。
18. 研究化学反应中的能量变化,能更好地利用化学反应为生产和生活服务。(1)、反应 的能量变化如图所示。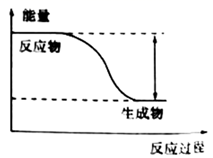
①该反应为(填“吸热”或“放热”)反应。
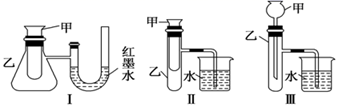
②如图三个装置中,不能证明“铁与稀硫酸反应是吸热反应还是放热反应”的是。
 (2)、现有纯铁片、纯铜片、 的硫酸溶液、导线和 量筒设计实验,证明形成原电池可以改变反应速率所用装置如图所示,装置气密性良好,且 量筒中已充满了水。
(2)、现有纯铁片、纯铜片、 的硫酸溶液、导线和 量筒设计实验,证明形成原电池可以改变反应速率所用装置如图所示,装置气密性良好,且 量筒中已充满了水。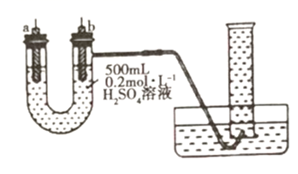
①若a、b极不用导线相连,则b极材料为(填“纯铁片”或“纯铜片”)。当收集到 (已折算为标准状况,且溶液体积不变)气体时,用时 ,则用 表示的平均反应速率为 。
②将a、b极(a极为“纯铁片”,b极为“纯铜片”)用导线相连,则电子在导线上的流动方向为从到(填“a极”或“b极”,下同);此时a极的电极反应式为 , 当收集到 (已折算为标准状况)气体时,用时 。
③根据上述实验所得结论为。
19. 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。(1)、Ⅰ.电子工业常用30%的 溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出 溶液与铜发生反应的离子方程式。(2)、某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
回答下列问题:
①试剂a是(用化学式表示);操作Ⅰ用到的玻璃仪器有烧杯、玻璃棒和。
②上述流程中操作Ⅲ包括蒸发浓缩、、过滤、洗涤。
(3)、Ⅱ.市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有 ,设计方案进行验证。
方案
试剂X
方案ⅰ
酸性 溶液
方案ⅱ
依次加入5滴 溶液、 氯水
方案ⅰ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有 ,猜想理由是。
(4)、方案ⅱ中预期现象是;若方案ⅱ实际操作中自始至终无明显现象,说明符合方案ⅰ猜想理由。为验证猜想,在方案ⅱ的基础上可进行操作: , 即可得到预期的现象。20. A、B、E为生活中常见的有机化合物,A与酸性高锰酸钾溶液反应可生成B,D是石油化工发展水平的标志,E是一种常见的高分子材料。根据如图转化关系回答下列问题: (1)、G的名称是;高分子材料E的链节是;产物B的官能团名称为;操作⑦的名称为。(2)、反应①~⑥中属于取代反应的是。(填序号)(3)、写出反应④的化学方程式:。(4)、用A、B制备物质C时,除去C中含有的杂质,选择的试剂及操作分别为 , 。21. 近几年来关于氮污染的治理倍受关注。(1)、三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是。
(1)、G的名称是;高分子材料E的链节是;产物B的官能团名称为;操作⑦的名称为。(2)、反应①~⑥中属于取代反应的是。(填序号)(3)、写出反应④的化学方程式:。(4)、用A、B制备物质C时,除去C中含有的杂质,选择的试剂及操作分别为 , 。21. 近几年来关于氮污染的治理倍受关注。(1)、三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是。
a.在转化过程中,氮元素均被还原
b.依据图示判断催化剂不参与储存和还原过程
c.还原过程中生成 ,转移电子数为
d.三效催化剂能有效实现汽车尾气中 、 、 三种成分的净化
(2)、利用 氧化氮氧化物反应过程如下: 。反应Ⅰ的化学方程式是 ,反应Ⅱ的离子方程式是。(3)、加入过量次氯酸钠可使废水中 完全转化为 ,而本身被还原为 。①检验废水中是否存在 的方法是。
②若处理废水产生了 (标准状况),则需消耗浓度为 的次氯酸钠的体积为L。