山东省德州市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、 等微粒已被发现。下列有关说法中正确的是( )A、H3是氢元素的一种核素 B、O2与O4属于同素异形体 C、C60的质量数为720 D、 中含有36个电子2. 下列化学用语表示正确的是( )A、次氯酸的电子式:
 B、S2-的结构示意图:
B、S2-的结构示意图:  C、原子核内有8个中子的碳原子: C
D、甲烷分子的球棍模型:
C、原子核内有8个中子的碳原子: C
D、甲烷分子的球棍模型:  3. 新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,怕酒精,不耐高温。下列说法正确的是( )A、病毒由碳、氢、氧三种元素组成 B、新冠病毒扩散到空气中不可能形成胶体 C、医用酒精能用于消毒是因为它有强氧化性 D、高温可使蛋白质发生变性4. 下列叙述中正确的是( )A、元素原子的核外电子层数等于该元素所在的周期数 B、第三周期气态氢化物HCl、H2S、PH3的稳定依次增强 C、元素周期表中副族共10个纵列,都属于金属元素 D、在金属元素与非金属元素的分界线附近可以寻找制备催化剂材料的元素5. 下列过程不涉及化学变化的是( )A、通过煤的气化、液化获得清洁燃料 B、用食醋除去暖瓶内的水垢 C、含氯消毒剂用于环境消毒 D、鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀6. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1mol苯所含的化学单键数目为12NA B、4.6g乙醇中含有C—H的数目为0.6NA C、标准状况下2.24LCl2与足量铁完全反应转移电子数为0.2NA D、0.1mo1·L-1AlCl3溶液含有Cl-离子数为0.3NA7. 下列有关化学反应速率的说法正确的是( )A、常温下用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 B、锌和稀硫酸反应时加入少量CuSO4溶液,可加快反应速率 C、升高温度、增大压强和使用催化剂,反应速率一定加快 D、等质量的铁片分别与同物质的量浓度的稀盐酸和稀硫酸反应,反应速率相等8. 下列关于化学反应与能量的说法错误的是( )A、乙醇的燃烧是放热反应 B、Mg与盐酸的反应是吸热反应 C、反应物化学键的断裂要吸收能量 D、化学反应伴随有能量的变化9. 下列有关化学反应的叙述正确的是( )A、常温下铜在浓硝酸中发生钝化 B、氯气和烧碱反应可制取漂白粉 C、碳酸氢钠固体受热分解可得到纯碱 D、铁和高温水蒸气反应生成铁红10. 下列有关化学键的叙述正确的是( )A、单质分子中均存在化学键 B、离子化合物中一定含有离子键 C、非金属元素之间只能形成共价键 D、含有共价键的化合物一定是共价化合物11. 根据表中部分短周期元素的信息,下列叙述正确的是( )
3. 新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,怕酒精,不耐高温。下列说法正确的是( )A、病毒由碳、氢、氧三种元素组成 B、新冠病毒扩散到空气中不可能形成胶体 C、医用酒精能用于消毒是因为它有强氧化性 D、高温可使蛋白质发生变性4. 下列叙述中正确的是( )A、元素原子的核外电子层数等于该元素所在的周期数 B、第三周期气态氢化物HCl、H2S、PH3的稳定依次增强 C、元素周期表中副族共10个纵列,都属于金属元素 D、在金属元素与非金属元素的分界线附近可以寻找制备催化剂材料的元素5. 下列过程不涉及化学变化的是( )A、通过煤的气化、液化获得清洁燃料 B、用食醋除去暖瓶内的水垢 C、含氯消毒剂用于环境消毒 D、鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀6. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1mol苯所含的化学单键数目为12NA B、4.6g乙醇中含有C—H的数目为0.6NA C、标准状况下2.24LCl2与足量铁完全反应转移电子数为0.2NA D、0.1mo1·L-1AlCl3溶液含有Cl-离子数为0.3NA7. 下列有关化学反应速率的说法正确的是( )A、常温下用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 B、锌和稀硫酸反应时加入少量CuSO4溶液,可加快反应速率 C、升高温度、增大压强和使用催化剂,反应速率一定加快 D、等质量的铁片分别与同物质的量浓度的稀盐酸和稀硫酸反应,反应速率相等8. 下列关于化学反应与能量的说法错误的是( )A、乙醇的燃烧是放热反应 B、Mg与盐酸的反应是吸热反应 C、反应物化学键的断裂要吸收能量 D、化学反应伴随有能量的变化9. 下列有关化学反应的叙述正确的是( )A、常温下铜在浓硝酸中发生钝化 B、氯气和烧碱反应可制取漂白粉 C、碳酸氢钠固体受热分解可得到纯碱 D、铁和高温水蒸气反应生成铁红10. 下列有关化学键的叙述正确的是( )A、单质分子中均存在化学键 B、离子化合物中一定含有离子键 C、非金属元素之间只能形成共价键 D、含有共价键的化合物一定是共价化合物11. 根据表中部分短周期元素的信息,下列叙述正确的是( )元素代号
L
M
Q
R
X
T
原子半径/nm
0.160
0.143
0.112
0.104
0.099
0.066
最高化合价或最低化合价
+2
+3
+2
+6
-1
-2
A、相同条件下单质与稀盐酸反应速率为L<Q B、氢化物的稳定性为H2T<H2R C、M3+与T2-的具有相同的核外电子排布 D、X元素无最高正价,非金属性最强12. 某实验兴趣小组以Zn和Cu为电极,稀硫酸为电解质溶液组成原电池,并对实验进行了拓展研究,以下实验记录错误的是( )A、铜片上有气泡产生,锌片逐渐溶解 B、电流在导线中从Zn电极流向Cu电极 C、把Cu换成Mg,电流计指针发生逆向偏转 D、把稀硫酸换成硫酸铜溶液,电流计指针依然偏转13. 下列由实验现象得出的结论正确的是( )操作及现象
结论
A
向苯中滴入少量浓溴水,振荡,静置分层,上层呈橙红色,下层几乎无色
溴水与苯发生取代反应而褪色
B
向NaI溶液中滴入少量氯水和四氯化碳,振荡静置,下层呈紫色
I-还原性强于Cl-
C
湿润的淀粉KI试纸伸入某红棕色气体中,试纸变蓝
该气体一定为NO2
D
在无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体
乙醇是弱电解质
A、A B、B C、C D、D二、多选题
-
14. Atropic酸是某些具有消炎、镇痛作用药物的中间体。其结构简式如图所示,关于Atropic酸的叙述错误的是( )
 A、Atropic酸的分子式为C9H9O2 B、能使酸性KMnO4溶液褪色 C、1mol Atropic酸与足量的Na反应能生成11.2LH2 D、能与乙醇发生酯化反应15. 某实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:①蒸馏时各组分的沸点差异越大,分离效果越好;②可能用到的装置和数据如下:
A、Atropic酸的分子式为C9H9O2 B、能使酸性KMnO4溶液褪色 C、1mol Atropic酸与足量的Na反应能生成11.2LH2 D、能与乙醇发生酯化反应15. 某实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:①蒸馏时各组分的沸点差异越大,分离效果越好;②可能用到的装置和数据如下:物质
Br2
CCl4
乙苯
密度(g/cm3)
3.12
1.60
0.87
沸点(℃)
58.8
76.8
136.2
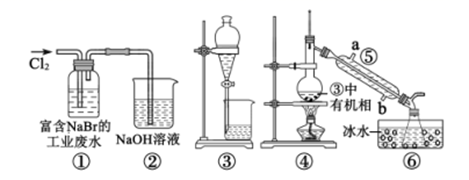
下列说法错误的是( )
A、②的作用是吸收多余Cl2 , 防止空气污染 B、用③进行萃取时,选择CCl4比乙苯更合理 C、乙苯和CCl4萃取Br2时现象都是分层,上层无色,下层橙色 D、仪器⑤的名称为冷凝管,其中b为进水口,a为出水口三、综合题
-
16. 下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
Ⅶ
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
⑩
(1)、在这些元素中,化学性质最不活泼的元素的原子结构示意图为 , 形成的单质是半导体的是(填元素名称)。(2)、气态氢化物最稳定的是(填化学式,下同),最高价氧化物对应的水化物中,碱性最强的是 , 呈两性的是 , 二者发生反应的离子方程式为。(3)、②、③、⑧的原子半径由小到大的顺序为(用元素符号表示),⑥与⑨形成的化合物的电子式为 , ④与⑧形成的化合物属于(填“离子”或“共价”)化合物。17. 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:实验序号
锌的质量/g
锌的状态
c(H2SO4)/mo1·L-1
V(H2SO4)/mL
反应前溶液的温度/℃
1
0.65
粒状
0.5
50
20
2
0.65
粉末
0.5
50
20
3
0.65
粉末
0.8
50
20
4
0.65
粉末
0.8
50
35
(1)、在此4组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定进行判断,其速率最快的实验是(填实验序号)。(2)、对锌和稀硫酸反应,实验1和2表明,对反应速率有影响;实验2和3表明,对反应速率有影响。(3)、进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。
①在OA、AB、BC三段中反应速率最快的是 , 原因是。
②2~4分钟内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)=。
18. 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知:

 +H2O
+H2O密度(g/cm3)
熔点(℃)
沸点(℃)
溶解性
环己醇
0.96
25
161
能溶于水
环己烯
0.81
-103
83
难溶于水
(1)、制备粗品。将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是。
(2)、制备精品。①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填“上”、“下”),分液后用洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,仪器a的名称为。收集产品时,控制的温度应在左右。
 (3)、以下区分环己烯精品和粗品的方法,合理的是。
(3)、以下区分环己烯精品和粗品的方法,合理的是。a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
19. A、B、D、E、F、M是重要的有机化工原料。它们之间的转化关系如图。 (1)、下列说法正确的是_____。A、淀粉和纤维素都属于天然高分子化合物 B、M可与新制氢氧化铜悬浊液在加热条件下生成砖红色沉淀 C、淀粉和纤维素的化学式均为(C6H10O5)n , 二者互为同分异构体 D、用饱和碳酸钠溶液可以鉴别B、E和F(2)、A为最简单的烯轻,则其结构简式是。反应③属于(填反应类型)。(3)、反应④的化学方程式是。(4)、反应⑥的化学方程式是 , 该反应是可逆反应,下列能说明该反应已达到化学平衡状态的是(填序号)
(1)、下列说法正确的是_____。A、淀粉和纤维素都属于天然高分子化合物 B、M可与新制氢氧化铜悬浊液在加热条件下生成砖红色沉淀 C、淀粉和纤维素的化学式均为(C6H10O5)n , 二者互为同分异构体 D、用饱和碳酸钠溶液可以鉴别B、E和F(2)、A为最简单的烯轻,则其结构简式是。反应③属于(填反应类型)。(3)、反应④的化学方程式是。(4)、反应⑥的化学方程式是 , 该反应是可逆反应,下列能说明该反应已达到化学平衡状态的是(填序号)A.混合物中各物质的物质的量相等
B.单位时间内,生成1molF,同时生成1molE
C.单位时间内,消耗1molB,同时消耗1molE
D.正反应的速率与逆反应的速率相等
20. 如图的坐标系是部分含硫化合物的转化关系图。 (1)、X的名称为 , Z的化学式为。(2)、用图中物质之间的反应,证明SO2有氧化性的反应的化学方程式为。(3)、若X能与Na2O2的反应生成Y,则该反应的化学方程式为。(4)、已知: +I2+H2O= +2I-+2H+。某溶液中可能含有大量的Na+、 、Fe2+、K+、I-、 、 。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有;肯定不能含有。(5)、向50mL浓硫酸中加入铜片,加热,反应一段时间,共收集到2.24L(标准状况)的SO2 , 将反应后的混合物加水稀释,再加入足量锌粉放出15.68L(标准状况)的H2 , 则原浓硫酸的物质的量浓度为 , 整个过程消耗锌粉的质量为。
(1)、X的名称为 , Z的化学式为。(2)、用图中物质之间的反应,证明SO2有氧化性的反应的化学方程式为。(3)、若X能与Na2O2的反应生成Y,则该反应的化学方程式为。(4)、已知: +I2+H2O= +2I-+2H+。某溶液中可能含有大量的Na+、 、Fe2+、K+、I-、 、 。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有;肯定不能含有。(5)、向50mL浓硫酸中加入铜片,加热,反应一段时间,共收集到2.24L(标准状况)的SO2 , 将反应后的混合物加水稀释,再加入足量锌粉放出15.68L(标准状况)的H2 , 则原浓硫酸的物质的量浓度为 , 整个过程消耗锌粉的质量为。