河南省郑州市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 科学家利用回旋加速器进行实验,成功制成115号元素的原子。该原子在生成数秒后衰变成113号元素,115号元素的一种核素为 。下列有关叙述中正确的是( )A、核素 的中子数为174 B、115号与113号元素互为同位素 C、113号元素的原子的质量数为113 D、115号元素衰变成113号元素是化学变化2. 人类的生产和生活离不开化学,下列有关说法正确的是( )A、石油的裂化和裂解属于化学变化而煤的干馏属于物理变化 B、玻璃钢是一种以玻璃纤维做增强体、合成树脂做基体的复合材料 C、传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 D、汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O3. 下列有关化学用语表示错误的是( )A、葡萄糖的最简式:CH2O B、次氯酸的结构式:H-O-Cl C、
 可以表示32S2- ,也可以表示34S2-
D、
可以表示32S2- ,也可以表示34S2-
D、 可以表示甲烷分子,也可以表示四氯化碳分子
4. 化学与生活、社会发展息息相关,下列有关说法错误的是( )A、大力推广新能源汽车,减少碳排放 B、为防止污染环境可将废电池回收后深埋 C、在元素周期表的金属元素和非金属元素交界处寻找半导体材料 D、元素周期表在研究物质的结构、发现新元素、合成新物质等方面具有指导意义5. 下列选项中物质类别和所含化学键类型均正确的是( )
可以表示甲烷分子,也可以表示四氯化碳分子
4. 化学与生活、社会发展息息相关,下列有关说法错误的是( )A、大力推广新能源汽车,减少碳排放 B、为防止污染环境可将废电池回收后深埋 C、在元素周期表的金属元素和非金属元素交界处寻找半导体材料 D、元素周期表在研究物质的结构、发现新元素、合成新物质等方面具有指导意义5. 下列选项中物质类别和所含化学键类型均正确的是( )A
B
C
D
离子化合物
HNO3
NH4Cl
NaOH
Na2O2
共价化合物
CO2
MgCl2
H2O
NH3
所含化学键类型
前者有离子键
后者有共价键
两者均含有离子键
两者均含有共价键
前者只有离子键
后者只有共价键
A、A B、B C、C D、D6. 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )

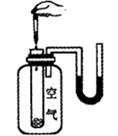

反应开始后,针简活塞向右移动
反应物总能量大于生成物总能量
反应开始后,U形管的液面左低右高
温度计的水银柱不断上升
A
B
C
D
A、A B、B C、C D、D7. 下列有关元素周期律和元素周期表的叙述正确的是( )A、IA元素的单质都是金属 B、元素周期表中从IIIB到IIB共有10 个纵列 C、同周期元素中,VIIA族元素的原子半径最大 D、VA族元素的原子,其半径越大,越容易得到电子8. 如下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) A、离子半径:Y>Z>X B、气态氢化物的稳定性:R<W C、WX3和水反应形成的化合物是离子化合物 D、Y和Z两者最高价氧化物对应的水化物能相互反应9. 下列关于元素金属性和非金属性强弱比较的说法错误的是( )A、将稀盐酸滴入大理石中,能产生CO2气体,说明非金属性:Cl>C B、Si与H2化合所需温度远高于S与H2化合的温度,说明非金属性:S>Si C、Na与冷水剧烈反应,而Mg与冷水反应缓慢,说明金属性:Na>Mg D、Mg(OH)2是中强碱,而Al(OH)3为两性氢氧化物,说明金属性:Mg>Al10. 某化学兴趣小组为研究化学能与电能的转化,设计下图装置。下列叙述错误的是( )
A、离子半径:Y>Z>X B、气态氢化物的稳定性:R<W C、WX3和水反应形成的化合物是离子化合物 D、Y和Z两者最高价氧化物对应的水化物能相互反应9. 下列关于元素金属性和非金属性强弱比较的说法错误的是( )A、将稀盐酸滴入大理石中,能产生CO2气体,说明非金属性:Cl>C B、Si与H2化合所需温度远高于S与H2化合的温度,说明非金属性:S>Si C、Na与冷水剧烈反应,而Mg与冷水反应缓慢,说明金属性:Na>Mg D、Mg(OH)2是中强碱,而Al(OH)3为两性氢氧化物,说明金属性:Mg>Al10. 某化学兴趣小组为研究化学能与电能的转化,设计下图装置。下列叙述错误的是( ) A、a和b不连接时,铁片上会有气泡产生 B、无论a和b是否连接,铁片均发生氧化反应 C、a和b用导线连接时,溶液中H+向铁片移动 D、a和b用导线连接时,铜片上发生的反应为2H++2e-= H2↑11. 在恒温恒容的密闭容器中发生反应H2(g)+I2(g)⇋2Hl(g),下列说法正确的是( )A、达到平衡时,正、逆反应速率相等且等于零 B、达到平衡时,H2(g)和I2(g)浓度不再变化 C、若充入稀有气体,体系压强增大,反应速率变大 D、H2(g)的消耗速率与HI(g)的生成速率之比为2: 112. 下列离子方程式书写正确的是( )A、SiO2和NaOH溶液反应:SiO2 +2OH-= SiO + H2O B、AlCl3溶液中加入足量的氨水:Al3++ 3OH-= Al(OH)3↓ C、Al2O3投入到NaOH溶液中:Al2O3 + 2OH-+ H2O= 2[Al(OH)4]- D、向Na[Al(OH)4]溶液中通入少量CO2 :[Al(OH)4]-+CO2=Al(OH)3↓十HCO13. 某物质在酸性条件下水解生成两种物质甲和乙,且甲和乙的相对分子质量相等,该物质可能是( )A、淀粉 B、蛋白质 C、甲酸乙酯 D、乙酸乙酯14. 下列实验装置或操作能达到实验目的的是 ( )A、
A、a和b不连接时,铁片上会有气泡产生 B、无论a和b是否连接,铁片均发生氧化反应 C、a和b用导线连接时,溶液中H+向铁片移动 D、a和b用导线连接时,铜片上发生的反应为2H++2e-= H2↑11. 在恒温恒容的密闭容器中发生反应H2(g)+I2(g)⇋2Hl(g),下列说法正确的是( )A、达到平衡时,正、逆反应速率相等且等于零 B、达到平衡时,H2(g)和I2(g)浓度不再变化 C、若充入稀有气体,体系压强增大,反应速率变大 D、H2(g)的消耗速率与HI(g)的生成速率之比为2: 112. 下列离子方程式书写正确的是( )A、SiO2和NaOH溶液反应:SiO2 +2OH-= SiO + H2O B、AlCl3溶液中加入足量的氨水:Al3++ 3OH-= Al(OH)3↓ C、Al2O3投入到NaOH溶液中:Al2O3 + 2OH-+ H2O= 2[Al(OH)4]- D、向Na[Al(OH)4]溶液中通入少量CO2 :[Al(OH)4]-+CO2=Al(OH)3↓十HCO13. 某物质在酸性条件下水解生成两种物质甲和乙,且甲和乙的相对分子质量相等,该物质可能是( )A、淀粉 B、蛋白质 C、甲酸乙酯 D、乙酸乙酯14. 下列实验装置或操作能达到实验目的的是 ( )A、 分离乙醇和乙酸
B、
分离乙醇和乙酸
B、 制取乙酸乙酯
C、
制取乙酸乙酯
C、 石油的蒸馏
D、
石油的蒸馏
D、 甲烷与氯气反应
15. 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )A、920 kJ B、557 kJ C、188 kJ D、436 kJ16. 两种气态烃组成的混合气体,完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,下列对混合烃的判断正确的是( )
甲烷与氯气反应
15. 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )A、920 kJ B、557 kJ C、188 kJ D、436 kJ16. 两种气态烃组成的混合气体,完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,下列对混合烃的判断正确的是( )
①一定有乙烯②一定有甲烷③可能有乙炔(C2H2)④一定没有乙烷
A、①② B、①④ C、②③ D、②④二、填空题
-
17. 下表是A、B、C三种有机物的相关信息:
A
①能使溴的四氯化碳溶液褪色;②填充模型为:

B
①可以从煤干馏生成的煤焦油中提取;②填充模型为:

C
工业生产中可通过A与H2O加成获得;②相对分子质量为46
请结合上述信息,回答下列问题:
(1)、有机物A的结构式为(2)、B与浓硝酸在一定条件下发生反应的化学方程式为(3)、有机物C的结构简式为。(4)、①C与乙酸反应的化学方程式为②C在铜催化和加热条件下,与O2反应的化学方程式为。
18. 下表是元素周期表短周期的一部分,请参照元素①~⑨在表中的位置,回答下列问题。 (1)、元素②在周期表中的位置是。(2)、元素⑤和⑨形成的化合物的电子式为。(3)、元素④、⑤、⑥形成的简单离子的半径依次(填“增大”“减小”或“不变”)。(4)、表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是(填化学式)。(5)、元素⑥形成的单质可与⑤的最高价氧化物对应的水化物发生反应,其反应的离子方程式为(6)、在一定条件下,①与③可形成一种化合物X,其相对分子质量与O2相同,且X可在纯氧中燃烧,所得产物对环境均无污染,则X燃烧的化学方程式为19. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。根据图中数据填空:
(1)、元素②在周期表中的位置是。(2)、元素⑤和⑨形成的化合物的电子式为。(3)、元素④、⑤、⑥形成的简单离子的半径依次(填“增大”“减小”或“不变”)。(4)、表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是(填化学式)。(5)、元素⑥形成的单质可与⑤的最高价氧化物对应的水化物发生反应,其反应的离子方程式为(6)、在一定条件下,①与③可形成一种化合物X,其相对分子质量与O2相同,且X可在纯氧中燃烧,所得产物对环境均无污染,则X燃烧的化学方程式为19. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。根据图中数据填空: (1)、该反应的化学方程式为(2)、反应开始至2min末,以气体X表示的平均反应速率为;反应开始时与反应达平衡状态时的压强之比为(3)、若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 (X)=9mol·L-1·min-1 , 乙中 (Y)=6mol·L-1·min-1 , 则反应更快。(4)、恒温恒容条件下,能说明该反应达到化学平衡状态的标志是________
(1)、该反应的化学方程式为(2)、反应开始至2min末,以气体X表示的平均反应速率为;反应开始时与反应达平衡状态时的压强之比为(3)、若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 (X)=9mol·L-1·min-1 , 乙中 (Y)=6mol·L-1·min-1 , 则反应更快。(4)、恒温恒容条件下,能说明该反应达到化学平衡状态的标志是________①混合气体的压强不再变化 ②混合气体的密度不再变化 ③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化 ⑤ (X) : (Y)=3:1
A、①②⑤ B、①③④ C、②③④ D、③④⑤20. 实验室可用氯气和金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,受热易升华。装置如下: (1)、仪器a的名称是。(2)、A中反应的离子方程式是 , D中反应的化学方程式是。(3)、反应开始时,先点燃处的酒精灯(填“A”或“D”)。(4)、若无B、C两装置,所得产物中可能含有的杂质是(写化学式)。(5)、F中碱石灰的作用是(写2点)。21. 为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:(1)、实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(1)、仪器a的名称是。(2)、A中反应的离子方程式是 , D中反应的化学方程式是。(3)、反应开始时,先点燃处的酒精灯(填“A”或“D”)。(4)、若无B、C两装置,所得产物中可能含有的杂质是(写化学式)。(5)、F中碱石灰的作用是(写2点)。21. 为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:(1)、实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知I2+2S2O ==S4O +2I- ,其中Na2S2O3溶液均足量,且S2O 与S4O 均为无色)
实验序号
体积V/mL
蓝色褪去时间/s
Na2S2O3溶液
淀粉溶液
碘水
水
①
10.0
2.0
4.0
0.0
t1
②
8.0
2.0
4.0
2.0
t2
③
6.0
2.0
4.0
Vx
t3
表中Vx=mL,t1、t2、t3的大小关系是
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)、指导老师指出上述实验①不合理,其原因是 ; 你的改进方案是(简要写出操作、试剂和现象)。(3)、实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是。