河南省洛阳市2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 下列有关化学用语使用正确的是( )A、CH4分子的比例模型:
 B、乙醇的分子式:CH3CH2OH
C、苯的最简式:C6H6
D、乙烯的结构简式:CH2CH2
2. 下列各组物质中,能用银镜反应进行鉴别的是( )A、乙醇、乙酸 B、苯、乙酸 C、苯、己烯 D、乙醛、乙酸3. 下列分子中存在π键的是( )A、H2 B、Cl2 C、N2 D、HCl4. 常温下 ,向氨水中加水稀释的过程中,NH3•H2O的电离平衡常数、电离度、溶液导电性的变化正确的是( )A、增大、增大、减小 B、不变、增大、减小 C、不变、减小、减小 D、减小、减小、增大5. 已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是( )A、
B、乙醇的分子式:CH3CH2OH
C、苯的最简式:C6H6
D、乙烯的结构简式:CH2CH2
2. 下列各组物质中,能用银镜反应进行鉴别的是( )A、乙醇、乙酸 B、苯、乙酸 C、苯、己烯 D、乙醛、乙酸3. 下列分子中存在π键的是( )A、H2 B、Cl2 C、N2 D、HCl4. 常温下 ,向氨水中加水稀释的过程中,NH3•H2O的电离平衡常数、电离度、溶液导电性的变化正确的是( )A、增大、增大、减小 B、不变、增大、减小 C、不变、减小、减小 D、减小、减小、增大5. 已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是( )A、 B、
B、 C、
C、 D、
D、 6. 下列说法中错误的是( )A、油脂水解可得到丙三醇 B、蛋白质、淀粉、纤维素都是高分子化合物 C、蛋白质水解的最终产物均为氨基酸 D、纤维素水解与淀粉水解得到的最终产物不同7. 下列实验装置设计正确的是( )
6. 下列说法中错误的是( )A、油脂水解可得到丙三醇 B、蛋白质、淀粉、纤维素都是高分子化合物 C、蛋白质水解的最终产物均为氨基酸 D、纤维素水解与淀粉水解得到的最终产物不同7. 下列实验装置设计正确的是( )A
B
C
D




测定中和热
稀释浓硫酸
制备乙酸乙酯
测定盐酸浓度
A、A B、B C、C D、D8. 下列化学变化属于取代反应的是( )A、甲烷在空气中完全燃烧 B、在镍做催化剂的条件下,苯与氢气反应 C、乙醇与乙酸反应制备乙酸乙酯 D、乙烯通入溴水中9. 下列说法中正确的是( )A、在二氧化硅晶体中 ,最小的环上的原子个数为 6 B、HCl分子里含有一个s-p σ键 C、3p3 表示 3p 能级有三个轨道 D、SO3与 互为等电子体 ,且它们中心原子都是 sp3 杂化10. 下列关于化学能转化为电能的四种装置的说法正确的是( ) A、电池Ⅰ中锌是正极 B、电池Ⅱ是一次性电池 C、电池Ⅲ工作时,氢气发生还原反应 D、电池Ⅳ工作时,电子由锌通过导线流向碳棒11. 合成氨反应的化学方程式为:N2(g) + 3H2 (g)⇌2NH3(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是( )A、每消耗 1 mol N2的同时,有 2 mol NH3 生成 B、正、逆反应速率相等且都等于零 C、H2、N2、NH3的浓度均不再变化 D、H2、NH3、N2在容器中共存12. 根据
A、电池Ⅰ中锌是正极 B、电池Ⅱ是一次性电池 C、电池Ⅲ工作时,氢气发生还原反应 D、电池Ⅳ工作时,电子由锌通过导线流向碳棒11. 合成氨反应的化学方程式为:N2(g) + 3H2 (g)⇌2NH3(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是( )A、每消耗 1 mol N2的同时,有 2 mol NH3 生成 B、正、逆反应速率相等且都等于零 C、H2、N2、NH3的浓度均不再变化 D、H2、NH3、N2在容器中共存12. 根据 的结构,它不可能发生的反应是( ) A、水解反应 B、使溴的四氯化碳溶液褪色 C、与乙醇在浓硫酸催化下发生酯化反应 D、与碳酸钠溶液反应13. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
的结构,它不可能发生的反应是( ) A、水解反应 B、使溴的四氯化碳溶液褪色 C、与乙醇在浓硫酸催化下发生酯化反应 D、与碳酸钠溶液反应13. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( ) A、加入催化剂,减小了反应的热效应 B、加入催化剂,可提高H2O2的平衡转化率 C、H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0 D、反应物的总能量高于生成物的总能量14. 常温下,稀释 0. 1 mol•L-1 Na2SO3溶液 ,图中的纵坐标可以表示( )
A、加入催化剂,减小了反应的热效应 B、加入催化剂,可提高H2O2的平衡转化率 C、H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0 D、反应物的总能量高于生成物的总能量14. 常温下,稀释 0. 1 mol•L-1 Na2SO3溶液 ,图中的纵坐标可以表示( ) A、 水解的平衡常数 B、溶液的 pH C、溶液中 的数目 D、溶液中的 c( )15. 已知有机物 M 在一定条件下可转化为N。下列说法正确的是( )
A、 水解的平衡常数 B、溶液的 pH C、溶液中 的数目 D、溶液中的 c( )15. 已知有机物 M 在一定条件下可转化为N。下列说法正确的是( ) A、该反应类型为取代反应 B、N 分子中所有碳原子共平面 C、M 中苯环上的一氯代物共有 4 种 D、可用溴水鉴别 M 和 N16. 可逆反应:aA(g)+bB(s) cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
A、该反应类型为取代反应 B、N 分子中所有碳原子共平面 C、M 中苯环上的一氯代物共有 4 种 D、可用溴水鉴别 M 和 N16. 可逆反应:aA(g)+bB(s) cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( ) A、T1<T2 ΔH>0 B、T1>T2 ΔH<0 C、P1<P2 a=c+d D、P1<P2 a+b=c+d17. 下图是第3周期11~17号元素某些性质变化趋势的柱形图。下列有关说法中正确的是( )
A、T1<T2 ΔH>0 B、T1>T2 ΔH<0 C、P1<P2 a=c+d D、P1<P2 a+b=c+d17. 下图是第3周期11~17号元素某些性质变化趋势的柱形图。下列有关说法中正确的是( ) A、y轴表示的可能是电离能 B、y轴表示的可能是电负性 C、y轴表示的可能是原子半径 D、y轴表示的可能是形成基态离子转移的电子数18. 下列说法错误的是( )A、 的溶液不一定呈碱性 B、中和pH和体积均相等的氨水、 溶液,所需 的物质的量相同 C、相同温度下,pH相等的盐酸、 溶液中, 相等 D、氨水和盐酸反应后的溶液,若溶液呈中性,则19. 25℃时,用一定浓度NaOH溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,其中b点为恰好反应点。下列说法错误的是( )
A、y轴表示的可能是电离能 B、y轴表示的可能是电负性 C、y轴表示的可能是原子半径 D、y轴表示的可能是形成基态离子转移的电子数18. 下列说法错误的是( )A、 的溶液不一定呈碱性 B、中和pH和体积均相等的氨水、 溶液,所需 的物质的量相同 C、相同温度下,pH相等的盐酸、 溶液中, 相等 D、氨水和盐酸反应后的溶液,若溶液呈中性,则19. 25℃时,用一定浓度NaOH溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,其中b点为恰好反应点。下列说法错误的是( )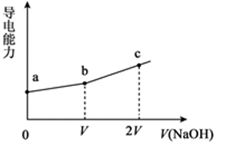 A、b点溶液的pH=7 B、溶液的导电能力与离子种类和浓度有关 C、a→c过程中,n(CH3COO-)不断增大 D、c点的混合溶液中c(Na+)>c(OH-)>c(CH3COO-)20. 摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C Li1-xCoO2+LixC6 , 结构如图所示。下列说法正确的是( )
A、b点溶液的pH=7 B、溶液的导电能力与离子种类和浓度有关 C、a→c过程中,n(CH3COO-)不断增大 D、c点的混合溶液中c(Na+)>c(OH-)>c(CH3COO-)20. 摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C Li1-xCoO2+LixC6 , 结构如图所示。下列说法正确的是( ) A、放电时,正极质量增加 B、充电时,锂离子由右向左移动 C、该锂离子电池工作时,正极锂元素化合价降低 D、充电时,阳极的电极反应式为:Li1-xCoO2+ xLi+ + xe- = LiCoO2
A、放电时,正极质量增加 B、充电时,锂离子由右向左移动 C、该锂离子电池工作时,正极锂元素化合价降低 D、充电时,阳极的电极反应式为:Li1-xCoO2+ xLi+ + xe- = LiCoO2二、综合题
-
21. 已知水在 25℃和100℃时,电离平衡曲线如图所示:
 (1)、25℃时水的电离平衡曲线应为(填“A” 或“B”)。(2)、常温下 ,某溶液中由水电离的 c( H+)=1×10-13mol•L-1 , 该溶液可能是________
(1)、25℃时水的电离平衡曲线应为(填“A” 或“B”)。(2)、常温下 ,某溶液中由水电离的 c( H+)=1×10-13mol•L-1 , 该溶液可能是________①二氧化硫水溶液② 氯化铵水溶液③ 硝酸钠水溶液④氢氧化钠水溶液
A、①④ B、①② C、②③ D、③④(3)、侯氏制碱法广泛用于工业制纯碱(Na2CO3),是我国科学家为人类做出的重大贡献。现有 25℃时,浓度为0. 10 mol• L-1Na2CO3溶液。请回答:①该溶液中c( H+)c( OH-)(填“> ”、“< ”或“=”)。
②用离子方程式解释① 的原因。
(4)、已知在 25℃时,醋酸和亚硫酸的电离平衡常数分别为 :醋酸: K= l. 75×10- 5;亚硫酸:K1= 1. 54 ×10 - 2K2= 1. 02 × 10-7①25℃时,相同浓度的醋酸和亚硫酸溶液的酸性强弱:CH3COOHH 2SO3(填“> ”、“<”或“=”)。
②25℃时,向0.10mol• L-1CH3COOH溶液中加入少量盐酸,若溶液中c( OH-)为1.0 ×10-12mol•L-1 , 则该溶液的 pH =。
③向0.10 mol•L-1的CH3COONa溶液中加入少量水, 比值的变化情况是(填“增大”、“减少” 或“不变”) 。
22. 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列间题:(1)、镍元素基态原子的电子排布式为 , 3d 能级上的未成对电子数为。(2)、硫酸镍溶于氨水形成 [ Ni(NH3 )6] SO4 蓝色溶液 。①[Ni(NH3)6]SO4中 的空间立体构型是 。
②在[Ni(NH3)6]2+中Ni2+与 NH3之间形成的化学键称为。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是 。氨分子中,中心原子的轨道杂化类型为 。
(3)、单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ•mol-1、INi= 1753 kJ•mol-l , ICu > INi的原因是。(4)、某镍白铜合金的立方晶胞结构如图所示。
若合金的密度为dg•cm-3 , 晶胞参数 a =nm 。
23. 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)、工业上一般采用下列两种反应合成甲醇:反应 I:CO ( g) + 2H2(g)⇌CH3OH ( g) ΔH1
反应 II:CO2(g)+ 3H2( g)⇌CH3OH(g) + H2O( g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“II”)
②下表所列数据是反应 I 在不同温度下的化学平衡常数 (K ):
温度
250℃
300℃
350℃
K
2. 041
0. 270
0. 012
由表中数据判断ΔH10 (填“>”、“< ”或“=”)。
③某温度下 ,将 2mol CO 和6 mol H2充入 2 L 的密闭容器中,充分反应,达到平衡后,测得 n (CO)=0.4 mol,则CO的转化率为 ,此时的温度为℃(从上表中选择)。
(2)、已知在常温常压下 :①2CH3OH (l)+ 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1 275.6kJ• mol-1
②2CO (g) + O2(g) = 2CO2(g) ΔH= - 566.0kJ• mol-1
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
(3)、用如图所示的装置电解K2SO4溶液同时制备H2SO4和 KOH 溶液, II 中装入K2SO4溶液( a、b 是离子交换膜),下列有关分析正确的是_________。 A、I 区生成H2SO4 B、a 是阴离子交换膜 C、II 区中的K+进入 I 区 D、III区溶液的 pH 会升高24. 醇酸树脂,附着力强,并具有良好的耐磨性、绝缘性等,在油漆、涂料、船舶等方面有很广泛的应用。如图是一种醇酸树脂 G 的合成路线:
A、I 区生成H2SO4 B、a 是阴离子交换膜 C、II 区中的K+进入 I 区 D、III区溶液的 pH 会升高24. 醇酸树脂,附着力强,并具有良好的耐磨性、绝缘性等,在油漆、涂料、船舶等方面有很广泛的应用。如图是一种醇酸树脂 G 的合成路线:
已知:RCH2CH = CH2
 (1)、A物质的名称为。(2)、反应⑤的反应类型为 。(3)、F的结构简式为。(4)、反应①的化学方程式为 。反应④的化学方程式为 。(5)、写出符合下列条件的 F 的一种同分异构体的结构简式 。
(1)、A物质的名称为。(2)、反应⑤的反应类型为 。(3)、F的结构简式为。(4)、反应①的化学方程式为 。反应④的化学方程式为 。(5)、写出符合下列条件的 F 的一种同分异构体的结构简式 。①1mol该物质与 4 mol 新制 Cu(OH)2悬浊液反应
②遇FeCl3溶液产生显色反应
③核磁共振氢谱有3组峰 ,比值为 1:1:1
(6)、设计由1-溴丙烷( )制备聚丙烯醇的合成路线 (
)制备聚丙烯醇的合成路线 (  ) (用流程图表示,无机试剂任选)。
) (用流程图表示,无机试剂任选)。