辽宁省葫芦岛市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 下列关于药物使用的说法中,正确的是( )A、碘酒能使蛋白质变性,常用于外敷消毒 B、长期大量服用阿司匹林可预防疾病,没有毒副作用 C、使用青霉素可直接静脉注射,不需进行皮肤敏感试验 D、随着平价药房的开设,生病了随时可以到药店自己买药服用2. 随着工业生产和社会发展对材料性能要求的提高,无机非金属材料成为高技术领域必须材料。下列说法错误的是( )A、高纯度的硅可用于制造计算机芯片 B、用氢氟酸可以生产磨砂玻璃 C、工业上利用硅的高熔点可以用物理方法制得高纯度硅 D、碳纳米管表面积大、强度高,可用于生产感应器3. 下列说法中正确的是( )A、制造N95口罩的聚丙烯树脂中含有碳碳双键 B、C6H14有4种同分异构体 C、乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理也相同 D、C2H6完全燃烧生成的CO2和H2O的质量可能是4.4 g和2.7 g4. 下列有关糖类、油脂、蛋白质的说法中,错误的是( )A、灼烧蚕丝织物有烧焦羽毛的气味 B、蔗糖可以水解生成葡萄糖与果糖 C、将碘化钾溶液滴在土豆片上,可观察到蓝色 D、利用油脂在碱性条件下的水解,可以制肥皂5. 关于反应速率、反应限度的下列说法中错误的是( )A、其它条件不变时,升高温度化学反应速率加快 B、其它条件不变时,增大浓度化学反应速率加快 C、化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 D、化学反应达到反应限度时,正反应的速率与逆反应的速率相等6. 下列关于有机物的说法中错误的是( )A、乙烯和甲烷都易发生取代反应 B、乙醇、乙酸、乙酸乙酯都能发生取代反应 C、蛋白质水解的最终产物为氨基酸 D、用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖7. 下列变化中,不属于化学变化的是( )A、从石油中分馏出汽油 B、煤的气化制水煤气 C、煤的干馏制焦炭 D、石油裂解得到乙烯8. 物质类别和核心元素的价态是学习元素及其化合物性质的重要认识视角。如图是某元素的“价类二维图”,其中单质b是黄色固体,f、h均为正盐,且焰色都是黄色。下列说法错误的是( )
 A、a和c反应可以生成b B、用BaCl2溶液可以鉴别f和h的溶液 C、e的浓溶液可用铝槽车运输 D、c能使品红溶液褪色9. 下列有关金属冶炼的说法中,错误的是( )A、金属冶炼的实质是金属阳离子被还原成单质 B、用铝粉还原铁矿石可以获取金属Fe C、通过电解NaCl溶液的方法可以获取金属Na D、冶炼铜的常用方法有火法炼铜和湿法炼铜10. “绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是( )A、工业生产环氧乙烷:
A、a和c反应可以生成b B、用BaCl2溶液可以鉴别f和h的溶液 C、e的浓溶液可用铝槽车运输 D、c能使品红溶液褪色9. 下列有关金属冶炼的说法中,错误的是( )A、金属冶炼的实质是金属阳离子被还原成单质 B、用铝粉还原铁矿石可以获取金属Fe C、通过电解NaCl溶液的方法可以获取金属Na D、冶炼铜的常用方法有火法炼铜和湿法炼铜10. “绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是( )A、工业生产环氧乙烷: B、水煤气合成甲醇:CO + 2H2 CH3OH
C、制取硫酸铜:Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
D、合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OH CH2=C(CH3)COOCH3
11. 研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:( )
B、水煤气合成甲醇:CO + 2H2 CH3OH
C、制取硫酸铜:Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
D、合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OH CH2=C(CH3)COOCH3
11. 研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:( )①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2 , NO2在上述过程中体现了什么样的性质或起了什么作用:①氧化性;②还原性;③催化剂;④酸性
A、①③ B、③④ C、③ D、②④12. 为提纯下列物质(括号内的物质为杂质),所用除杂试剂和分离方法都正确的是( )A.
B.
C.
D.
含杂物质
乙酸乙酯(乙酸)
酒精(水)
乙烯(二氧化硫)
溴苯(溴)
除杂试剂
NaOH溶液
生石灰
酸性KMnO4溶液
四氯化碳
分离方法
分液
蒸馏
洗气
分液
A、A B、B C、C D、D13. 向四个体积相同的密闭容器中分别充入一定量的 SO2 和 O2 , 开始反应时,按反应速率由大到小排列顺序正确的是( )甲:500 ℃,10 mol SO2 和 5 mol O2 的反应
乙:500 ℃,用 V2O5 作催化剂,10 mol SO2 和 5 mol O2 的反应
丙:450 ℃,8 mol SO2 和 5 mol O2 的反应
丁:500 ℃,8 mol SO2 和 5 mol O2 的反应
A、甲>乙>丙>丁 B、乙>甲>丙>丁 C、乙>甲>丁>丙 D、丁>丙>乙>甲14. 一瓶无色气体,可能含有HCl、H2S、SO2、HBr、NO2、CO2中的一种或几种,将其通入氯水中,得无色透明溶液,将该溶液分成两份,一份加盐酸酸化的BaCl2溶液,析出白色沉淀;另一份加硝酸酸化的硝酸银溶液,也有白色沉淀生成。下面结论正确的是( )①原气体中肯定有SO2 ②原气体中可能有SO2 ③原气体中肯定无H2S、HBr、NO2④不能肯定是否含有HCl ⑤原气体中肯定不含CO2 ⑥原气体中肯定含HCl
A、①③④ B、①④⑤ C、①③⑥ D、①③④⑤⑥15. NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是( ) A、NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 B、1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ C、在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2 , 则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min) D、N2(g)分子中化学键键能大于O2(g)分子中化学键键能16. 下列实验的原理、物质的检验及分离方法、现象、结论不合理的是(夹持装置已路去,气密性已检验)。( )
A、NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 B、1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ C、在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2 , 则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min) D、N2(g)分子中化学键键能大于O2(g)分子中化学键键能16. 下列实验的原理、物质的检验及分离方法、现象、结论不合理的是(夹持装置已路去,气密性已检验)。( )


A.制取并检验氨气
B.形成喷泉且瓶内物质的量浓度相等
C.液体分层,下层呈紫色
D.检验产物SO2
A、A B、B C、C D、D二、填空题
-
17. 电能是现代社会应用最广泛的能源之一。(1)、某原电池装置如图所示。

①Zn电极为原电池的极(填“正”或“负”),电极反应式是。
②Cu电极上发生的反应属于(填“氧化”或“还原”)反应,当铜表面析出4.48 L氢气(标准状况)时,导线中通过了mol电子。
③能证明化学能转化为电能的实验现象是:铜片上有气泡产生、。
(2)、下列反应通过原电池装置,可实现化学能直接转化为电能的是(填序号)。A CaO+H2O=Ca(OH)2
B 2H2+O2=2H2O
C 2FeCl3+Cu=CuCl2+2FeCl2
18. 用下列装置验证SO2的某些性质(加热及夹持装置略去)。 (1)、装有浓硫酸的仪器名称是。(2)、铜与浓硫酸反应的化学方程式是。(3)、能验证SO2具有氧化性的实验现象是。(4)、装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是 , 。(5)、写出(4)中SO2显示还原性并生成白色沉淀的总的离子方程式。(6)、NaOH溶液中通入过量的SO2 , 则其总反应的离子反应方程式是。19. 某学生为了探究影响化学反应速率的外界因素,进行以下实验。(1)、向100 mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
(1)、装有浓硫酸的仪器名称是。(2)、铜与浓硫酸反应的化学方程式是。(3)、能验证SO2具有氧化性的实验现象是。(4)、装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是 , 。(5)、写出(4)中SO2显示还原性并生成白色沉淀的总的离子方程式。(6)、NaOH溶液中通入过量的SO2 , 则其总反应的离子反应方程式是。19. 某学生为了探究影响化学反应速率的外界因素,进行以下实验。(1)、向100 mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
①在0~1、1~2、 2~3、3-4、4~-5min各时间段中:
反应速率最大的时间段是 min,主要的原因可能是。
反应速率最小的时间段是 min,主要的原因可能是。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入(填序号)。
a Na2CO3溶液 b NaOH溶液 c 稀HNO3 d 蒸馏水
(2)、进行以下对比实验,并记录实验现象。实验I:

实验II:另取两支试管分别加入5 mL5%H2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡产生。
①双氧水分解的化学方程式是。
②实验I的目的是。
③实验II未观察到预期现象,为了达到该实验的目的,可采取的改进措施是。
20. 海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 • 6H2O的流程如下: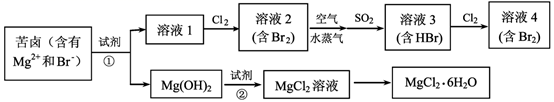 (1)、写出一种海水淡化的方法。(2)、比较溶液中Br2的浓度:溶液2溶液4(填“>”或“<”)。(3)、鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是。(4)、试剂①可以选用 , 加入试剂②后反应的离子方程式是。(5)、从MgCl2溶液获得MgCl2 • 6H2O晶体的主要操作包括。21. 合成乙酸乙酯的路线如下:
(1)、写出一种海水淡化的方法。(2)、比较溶液中Br2的浓度:溶液2溶液4(填“>”或“<”)。(3)、鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是。(4)、试剂①可以选用 , 加入试剂②后反应的离子方程式是。(5)、从MgCl2溶液获得MgCl2 • 6H2O晶体的主要操作包括。21. 合成乙酸乙酯的路线如下:CH2=CH2 C2H5OH CH3CHO CH3COOH CH3COOCH2CH3
请回答列问题:
(1)、乙烯能发生聚合反应,方程式为。(2)、乙醇所含的官能团名称为。(3)、反应①的反应类型。(4)、写出下列反应的化学方程式:反应②:。
反应④:。
(5)、反应④的实验装置如下图所示,试管B中在反应前加入的是 , 作用是。