江苏省镇江市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 在科学史上每一次重大的发现都极大地推进了科学的发展.俄国科学家门捷列夫对化学的突出贡献在于( )A、提出了元素周期律 B、提出了原子结构模型 C、确立了化学原子论 D、开发了合成氨的工艺2. 下列物质的俗名与化学式对应正确的是( )A、石膏—CaCO3 B、尿素— C、小苏打— D、淀粉—3. 下列变化主要不属于化学变化的是( )A、煤的气化、液化 B、石油的分馏 C、氧气转化为臭氧 D、浓硝酸使铁、铝钝化4. 反应 用于工业上制备氯水,下列化学用语表示正确的是( )A、H2O的电子式:
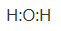 B、 离子结构示意图:
B、 离子结构示意图:  C、HClO的结构式:H—O—Cl
D、上述反应的离子方程式:
5. 用下列装置制取NH3 , 并还原CuO,其原理和装置均正确的是( )A、
C、HClO的结构式:H—O—Cl
D、上述反应的离子方程式:
5. 用下列装置制取NH3 , 并还原CuO,其原理和装置均正确的是( )A、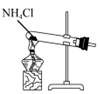 用装置制取NH3
B、
用装置制取NH3
B、 用装置干燥NH3
C、
用装置干燥NH3
C、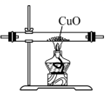 用装置还原CuO
D、
用装置还原CuO
D、 用装置处理尾气
6. 下列物质属于离子化合物且含有共价键的是( )A、MgCl2 B、SiO2 C、CH3Cl D、NH4Cl7. 下列反应符合如图信息的是( )
用装置处理尾气
6. 下列物质属于离子化合物且含有共价键的是( )A、MgCl2 B、SiO2 C、CH3Cl D、NH4Cl7. 下列反应符合如图信息的是( ) A、生石灰加水制熟石灰 B、氢氧化钡晶体与氯化铵晶体混合 C、氢氧化钠溶液中滴加稀盐酸 D、接触室中二氧化硫催化氧化成三氧化硫8. 1 mol H2在O2中完全燃烧生成液态水放出285.8kJ的热量,下列热化学方程式正确的是( )A、 B、 C、 D、9. N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂。下述反应能产生N2O:3CO + 2NO2= 3CO2+ N2O。下列关于该反应的说法正确的是( )A、CO是氧化剂 B、N2O是氧化产物 C、NO2被还原 D、常温常压下,生成6.72LCO2转移0.6mol电子10. 下列性质比较中,错误的是( )A、原子半径大小:Na>S>O B、热稳定性强弱:HF>HCl>H2S C、酸性强弱: D、碱性强弱:11. 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍,下列说法正确的是( )A、X与Y形成的化合物只有一种 B、X和W形成的化合物能与R单质发生置换反应 C、R与X,R与Z形成的化合物,化学键类型相同 D、YR4分子中各原子的最外层电子数不能满足8电子稳定结构12. 下列各组物质晶体类型相同的是( )A、SO2和SiO2 B、CCl4和KCl C、干冰和冰 D、晶体Si和单质Na13. 共价键、离子键和分子间作用力是微粒之间的三种作用力,现有晶体:① ;② ;③ ;④白磷(P4);⑤NaCl;⑥金刚石;⑦石墨。其中含有两种作用力的是( )A、①②④⑥ B、①②③⑥ C、②④⑤⑥ D、①③④⑦14. 下列说法错误的是( )A、 和 互为同位素 B、金刚石和富勒烯互为同素异形体 C、 和 互为同分异构体 D、CH4与CH3CH(CH3)CH3互为同系物15. 用Zn粒与稀硫酸反应制取氢气时,下列措施不能加快氢气生成速率的是( )A、加热 B、不用稀硫酸,改用98%浓硫酸 C、滴加少量CuSO4溶液 D、不用锌粒,改用锌粉16. 一定温度下,2.5 mol A、2.5 mol B和足量W在客积为2L的密闭容器里发生如下反应: ,5s后反应达到平衡,在此5s内C的平均生成速率为0.2 mol·L-1·s-1 , 同时生成1mol D.下列叙述中错误的是( )A、x=4 B、达到平衡状态时,A的物质的量浓度为 C、当混合气体的密度不再改变时,该反应已达到平衡状态 D、当 时,标志着该反应达到平衡状态17. 如图为钢铁生锈的原理示意图,下列有关说法错误的是( )
A、生石灰加水制熟石灰 B、氢氧化钡晶体与氯化铵晶体混合 C、氢氧化钠溶液中滴加稀盐酸 D、接触室中二氧化硫催化氧化成三氧化硫8. 1 mol H2在O2中完全燃烧生成液态水放出285.8kJ的热量,下列热化学方程式正确的是( )A、 B、 C、 D、9. N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂。下述反应能产生N2O:3CO + 2NO2= 3CO2+ N2O。下列关于该反应的说法正确的是( )A、CO是氧化剂 B、N2O是氧化产物 C、NO2被还原 D、常温常压下,生成6.72LCO2转移0.6mol电子10. 下列性质比较中,错误的是( )A、原子半径大小:Na>S>O B、热稳定性强弱:HF>HCl>H2S C、酸性强弱: D、碱性强弱:11. 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍,下列说法正确的是( )A、X与Y形成的化合物只有一种 B、X和W形成的化合物能与R单质发生置换反应 C、R与X,R与Z形成的化合物,化学键类型相同 D、YR4分子中各原子的最外层电子数不能满足8电子稳定结构12. 下列各组物质晶体类型相同的是( )A、SO2和SiO2 B、CCl4和KCl C、干冰和冰 D、晶体Si和单质Na13. 共价键、离子键和分子间作用力是微粒之间的三种作用力,现有晶体:① ;② ;③ ;④白磷(P4);⑤NaCl;⑥金刚石;⑦石墨。其中含有两种作用力的是( )A、①②④⑥ B、①②③⑥ C、②④⑤⑥ D、①③④⑦14. 下列说法错误的是( )A、 和 互为同位素 B、金刚石和富勒烯互为同素异形体 C、 和 互为同分异构体 D、CH4与CH3CH(CH3)CH3互为同系物15. 用Zn粒与稀硫酸反应制取氢气时,下列措施不能加快氢气生成速率的是( )A、加热 B、不用稀硫酸,改用98%浓硫酸 C、滴加少量CuSO4溶液 D、不用锌粒,改用锌粉16. 一定温度下,2.5 mol A、2.5 mol B和足量W在客积为2L的密闭容器里发生如下反应: ,5s后反应达到平衡,在此5s内C的平均生成速率为0.2 mol·L-1·s-1 , 同时生成1mol D.下列叙述中错误的是( )A、x=4 B、达到平衡状态时,A的物质的量浓度为 C、当混合气体的密度不再改变时,该反应已达到平衡状态 D、当 时,标志着该反应达到平衡状态17. 如图为钢铁生锈的原理示意图,下列有关说法错误的是( ) A、转化过程中有化学能转化为电能 B、铁锈的主要成分是 C、正极的电极反应式为: D、发生电化学反应的总反应式为:18. 如图装置可实现电解CuCl2溶液,下列说法正确的是( )
A、转化过程中有化学能转化为电能 B、铁锈的主要成分是 C、正极的电极反应式为: D、发生电化学反应的总反应式为:18. 如图装置可实现电解CuCl2溶液,下列说法正确的是( )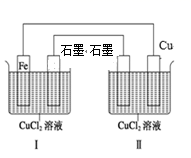 A、Ⅰ为电解池,Ⅱ为原电池 B、两石墨电板上均有铜析出 C、Ⅰ中 向铁电极移动,Ⅱ中 向铜电极移动 D、工作一段时间后,理论上Ⅰ中 不变,Ⅱ中 减小19. 下列装置应用于实验室进行相关实验,能达到实验目的的是( )
A、Ⅰ为电解池,Ⅱ为原电池 B、两石墨电板上均有铜析出 C、Ⅰ中 向铁电极移动,Ⅱ中 向铜电极移动 D、工作一段时间后,理论上Ⅰ中 不变,Ⅱ中 减小19. 下列装置应用于实验室进行相关实验,能达到实验目的的是( ) A、用装置甲在光照条件下验证甲烷与氯气的反应 B、用装置乙除去甲烷中少量的乙烯得纯净甲烷 C、用装置丙分离乙醇和乙酸的混合液 D、用装置丁分馏石油并收集60~150℃馏分20. 下列有机反应方程式书写正确的是( )A、乙烯与溴的加成反应: B、甲苯与Cl2的取代反应:
A、用装置甲在光照条件下验证甲烷与氯气的反应 B、用装置乙除去甲烷中少量的乙烯得纯净甲烷 C、用装置丙分离乙醇和乙酸的混合液 D、用装置丁分馏石油并收集60~150℃馏分20. 下列有机反应方程式书写正确的是( )A、乙烯与溴的加成反应: B、甲苯与Cl2的取代反应: +Cl2
+Cl2  +HCl
C、用苯乙烯合成聚苯乙烯:nC6H5CH=CH2
+HCl
C、用苯乙烯合成聚苯乙烯:nC6H5CH=CH2  D、合成乙酸乙酯:
21. 根据下列实验操作和现象所得到的结论正确的是选项( )
D、合成乙酸乙酯:
21. 根据下列实验操作和现象所得到的结论正确的是选项( )选项
实验操作和现象
实验结论
A
向苯中滴入少量酸性高锰酸钾溶液,振荡后静置,高锰酸钾溶液不褪色
苯分子中不存在碳碳双键
B
用导线把锌片和铜片连接起来同时插入盛有稀硫酸的烧杯里,铜片表面有气泡产生
铜能与稀硫酸反应生成氢气
C
向鸡蛋清的溶液中加入饱和硫酸铵溶液,产生白色沉淀
饱和硫酸铵溶液能使蛋白质变性
D
向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液,未出现银镜
淀粉未水解
A、A B、B C、C D、D22. 甲苯( )与浓酸酸、浓硝酸在一定条件下反应,生成邻硝基甲苯(
)与浓酸酸、浓硝酸在一定条件下反应,生成邻硝基甲苯(  ):
): 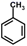 +HNO3
+HNO3  +H2O,下列有关说法错误的是( ) A、邻硝基甲苯分子式是 B、该反应的催化剂是浓 C、
+H2O,下列有关说法错误的是( ) A、邻硝基甲苯分子式是 B、该反应的催化剂是浓 C、 与
与  互为同分异构体
D、该反应的类型是加成反应
23. 某有机物的结构简式为
互为同分异构体
D、该反应的类型是加成反应
23. 某有机物的结构简式为 ,下列关于该有机物的说法错误的是( ) A、1 mol该物质中只含有1mol双键 B、在一定条件下能发生酯化反应 C、能使溴水和酸性高锰酸钾溶液褪色 D、1mol该物质与足量的金属Na反应,能产生1molH224. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、25. 下列指定反应的离子方程式正确的是( )A、醋酸与 溶液的反应: B、向水中通入NO2: C、向稀硝酸中加入铜片: D、向NH4HCO3溶液中加入过量NaOH溶液:26. 废水中氨氮(NH3、 )采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
,下列关于该有机物的说法错误的是( ) A、1 mol该物质中只含有1mol双键 B、在一定条件下能发生酯化反应 C、能使溴水和酸性高锰酸钾溶液褪色 D、1mol该物质与足量的金属Na反应,能产生1molH224. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、25. 下列指定反应的离子方程式正确的是( )A、醋酸与 溶液的反应: B、向水中通入NO2: C、向稀硝酸中加入铜片: D、向NH4HCO3溶液中加入过量NaOH溶液:26. 废水中氨氮(NH3、 )采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:①微生物脱氮法:
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成 沉淀从而去除氨氮。
下列有关说法正确的是( )
A、该废水大量直接排放,对水体的影响不大 B、微生物脱氮时可在高温下进行,以加快脱氮的速率 C、步骤a发生反应: D、化学沉淀法脱氮时,氨氮的去除率随着溶液碱性的增强而上升二、填空题
-
27. 乳酸CH3CH(OH)COOH是人体代谢的中间产物,易溶于水。(1)、乳酸分子中官能团名称为和。(2)、向乳酸溶液中,滴加几滴紫色石蕊试液,溶液会变成色。(3)、写出乳酸和乙醇发生酯化反应的化学方程式。(4)、乳酸在Cu作催化剂、加热条件下被O2氧化,该氧化产物的结构简式为。28. NaN3是一种易溶于水( )的白色固体,可用于有机合成和汽车安全气囊的产气药等,钠法(液氨法)制备NaN3的工艺流程如图:
 (1)、钠元素位于周期表第周期第族。(2)、NH3的电子式为。(3)、反应NH4NO3 N2O↑+2H2O↑中,每生成1molN2O转移电子的物质的量为mol。(4)、销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为( 被氧化为N2)。29. 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
(1)、钠元素位于周期表第周期第族。(2)、NH3的电子式为。(3)、反应NH4NO3 N2O↑+2H2O↑中,每生成1molN2O转移电子的物质的量为mol。(4)、销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为( 被氧化为N2)。29. 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
已知:① ;
②NaNO2是白色固体,易被氧化。
(1)、生产过程中,SO2从底部通入,硝酸从顶部以雾状喷下,其目的是。写出“还原”步骤中生成NO2反应的离子方程式。(2)、若使“吸收”步骤中NO、NO2完全转化为NaNO2 , 则理论上“还原”步中SO2与HNO3的物质的量之比为。(3)、该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:a.称取2.000g样品,将其配成250 mL溶液
b.先向锥形瓶内加入40.00 mL 0.100mol·L-1的 溶液,加热至40~50℃,冷却后再向其中加入20.00 mL0.10 mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次,平均消耗样品溶液50.00 mL。(NaNO2与KMnO4反应的关系式为: )
①测定过程中应迅速操作,不宜耗时过长,否则测定的数值将会偏小,原因是。
②通过计算,该样品中NaNO2的质量分数是 , 可能含有的杂质有 、和。
(4)、该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是。