福建省厦门市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-29 类型:期末考试
一、单选题
-
1. 我国研制的新一代核反应堆以 为燃料。关于 的叙述错误的是( )A、电子数是90 B、质量数是232 C、中子数是142 D、质子数是2322. 煤油可作为燃料。煤油属于( )A、单质 B、纯净物 C、混合物 D、氧化物3. 下列物质属于天然高分子化合物的是( )A、油脂 B、蛋白质 C、腈纶 D、聚氯乙烯4. 人类最早使用的硅酸盐材料是( )A、玻璃 B、水泥 C、陶瓷 D、水晶5. 下列说法错误的是( )A、16O和18O互为同位素 B、金刚石和足球烯互为同素异形体 C、C2H6和C3H6互为同系物 D、C2H5OH和CH3OCH3互为同分异构体6. 下图是某有机物的球棍模型,其中“●”表示碳原子,“O”表示氢原子,该有机物结构简式为( )
 A、CH3CH3 B、CH2=CH2 C、CH3CH2OH D、CH3COOH7. 下列实验操作能达到实验目的的是( )
A、CH3CH3 B、CH2=CH2 C、CH3CH2OH D、CH3COOH7. 下列实验操作能达到实验目的的是( )选项
实验目的
实验操作
A
鉴别苯和四氯化碳
取样,滴加溴水振荡,静置
B
分离乙酸和乙酸乙酯
加氢氧化钠溶液,蒸馏
C
检验乙醇中是否含水
取样,加入一块小钠粒
D
除去乙烷中的少量乙烯
混合气体通过酸性KMnO4溶液
A、A B、B C、C D、D8. 阿托酸( )是一种重要的医药中间体、材料中间体。下列说法错误的是( ) A、分子式为C9H8O2 B、苯环上的一氯代物有5种 C、含有羧基与碳碳双键两种官能团 D、1mol阿托酸能与含1molBr2的水溶液发生加成反应9. 主族元素镓(Ga)的最高价氧化物β–Ga2O3 , 是高性能半导体材料。下列推测错误的是( )A、Ga的最外层有3个电子 B、β-Ga2O3具有很高的熔沸点 C、Ga单质能与酸反应 D、Ga的非金属性比Si强10. NA为阿伏加德罗常数。工业上利用反应3C+3Cl2+Al2O3 2AlCl3+3CO制备AlCl3 , 当获得1molAlCl3时,下列说法正确的是( )A、转移的电子数为2NA B、断裂Cl-Cl的数目为3NA C、生成CO的体积为33.6L D、消耗焦炭的质量为18g11. 三硫化磷(P4S3)可用于制造火柴,分子结构如图所示。下列说法错误的是( )
)是一种重要的医药中间体、材料中间体。下列说法错误的是( ) A、分子式为C9H8O2 B、苯环上的一氯代物有5种 C、含有羧基与碳碳双键两种官能团 D、1mol阿托酸能与含1molBr2的水溶液发生加成反应9. 主族元素镓(Ga)的最高价氧化物β–Ga2O3 , 是高性能半导体材料。下列推测错误的是( )A、Ga的最外层有3个电子 B、β-Ga2O3具有很高的熔沸点 C、Ga单质能与酸反应 D、Ga的非金属性比Si强10. NA为阿伏加德罗常数。工业上利用反应3C+3Cl2+Al2O3 2AlCl3+3CO制备AlCl3 , 当获得1molAlCl3时,下列说法正确的是( )A、转移的电子数为2NA B、断裂Cl-Cl的数目为3NA C、生成CO的体积为33.6L D、消耗焦炭的质量为18g11. 三硫化磷(P4S3)可用于制造火柴,分子结构如图所示。下列说法错误的是( ) A、P4S3中磷元素为+3价 B、P4S3属于共价化合物 C、P4S3含有非极性键 D、1molP4S3分子含有9mol共价键12. 我国明代宋应星在《佳兵●火药料》中,关于黑火药的描述为“以硝石、硫磺为主,草木灰为辅。硝性至阴,硫性至阳,阴阳两神物相遇于无隙无容之中。其出也,人物膺之,魂散惊而魄齑粉。”下列说法错误的是( )A、“硝石"在反应中作还原剂 B、“硫磺”在反应中做氧化剂 C、“草木灰"提供了碳单质 D、“魂散惊而魄齑粉”说明反应放出巨大的能量13. 某实验小组设计了如图实验装置(加热装置未画出)制备乙酸乙酯,已知乙醇、乙酸、乙酸乙酯的沸点分别为78.5℃、117.9℃、77℃。为提高原料利用率和乙酸乙酯的产量,下列实验操作错误的是( )
A、P4S3中磷元素为+3价 B、P4S3属于共价化合物 C、P4S3含有非极性键 D、1molP4S3分子含有9mol共价键12. 我国明代宋应星在《佳兵●火药料》中,关于黑火药的描述为“以硝石、硫磺为主,草木灰为辅。硝性至阴,硫性至阳,阴阳两神物相遇于无隙无容之中。其出也,人物膺之,魂散惊而魄齑粉。”下列说法错误的是( )A、“硝石"在反应中作还原剂 B、“硫磺”在反应中做氧化剂 C、“草木灰"提供了碳单质 D、“魂散惊而魄齑粉”说明反应放出巨大的能量13. 某实验小组设计了如图实验装置(加热装置未画出)制备乙酸乙酯,已知乙醇、乙酸、乙酸乙酯的沸点分别为78.5℃、117.9℃、77℃。为提高原料利用率和乙酸乙酯的产量,下列实验操作错误的是( ) A、实验开始时应先打开K1 , 关闭K2 B、冷却水应分别从A,C口通入 C、关闭K1打开K2时,应控制温度计2的示数为77℃ D、锥形瓶中应先加入饱和碳酸钠溶液14. 我国科学家在CO2电催化还原制乙烯和乙醇方面取得重要突破,其反应机理如下图所示。下列有关说法错误的是( )
A、实验开始时应先打开K1 , 关闭K2 B、冷却水应分别从A,C口通入 C、关闭K1打开K2时,应控制温度计2的示数为77℃ D、锥形瓶中应先加入饱和碳酸钠溶液14. 我国科学家在CO2电催化还原制乙烯和乙醇方面取得重要突破,其反应机理如下图所示。下列有关说法错误的是( ) A、第1步中“CO2→*CO"碳氧双键断开需要吸收能量 B、第2步发生反应的化学方程式为*CO+H→*CHO C、第3步“*CHO→*OCHCHO*”吸附在催化剂表面原子数目及种类不变 D、第4步产物有乙烯、乙醇和水15. 某实验小组研究不同净水剂在不同pH的净水效果,实验结果如下图(浊度去除率越高表明净水效果越好)。下列有关说法错误的是( )
A、第1步中“CO2→*CO"碳氧双键断开需要吸收能量 B、第2步发生反应的化学方程式为*CO+H→*CHO C、第3步“*CHO→*OCHCHO*”吸附在催化剂表面原子数目及种类不变 D、第4步产物有乙烯、乙醇和水15. 某实验小组研究不同净水剂在不同pH的净水效果,实验结果如下图(浊度去除率越高表明净水效果越好)。下列有关说法错误的是( ) A、三种净水剂在pH=7.5左右净水效果最佳 B、三种净水剂中明矾的适用pH范围最窄 C、三种净水剂净水效果下降的原因都是因碱性过强胶体发生沉降 D、相同pH条件下,Fe3+比Al3+生成的胶粒数目多或吸附效果好
A、三种净水剂在pH=7.5左右净水效果最佳 B、三种净水剂中明矾的适用pH范围最窄 C、三种净水剂净水效果下降的原因都是因碱性过强胶体发生沉降 D、相同pH条件下,Fe3+比Al3+生成的胶粒数目多或吸附效果好二、综合题
-
16. 为纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。下图是扇形元素周期表的一部分,针对元素①~⑩按要求作答。
 (1)、⑩的原子结构示意图为。(2)、①和②组成的最简单化合物的电子式为。(3)、④和⑤的简单离子半径较大的是(填序号)。(4)、③的简单氢化物与其最高价氧化物对应水化物反应得到的盐的化学式为。(5)、某元素原子的M层电子数为K层电子数的两倍,则该元素是(填序号)。(6)、把⑥投入烧碱溶液中发生反应的化学方程式为。(7)、写出一个能证明⑧的非金属性小于⑨的离子方程式。17. 如图,通过工业联产可有效解决多晶硅(Si)生产中副产物SiCl4。所带来的环境问题。
(1)、⑩的原子结构示意图为。(2)、①和②组成的最简单化合物的电子式为。(3)、④和⑤的简单离子半径较大的是(填序号)。(4)、③的简单氢化物与其最高价氧化物对应水化物反应得到的盐的化学式为。(5)、某元素原子的M层电子数为K层电子数的两倍,则该元素是(填序号)。(6)、把⑥投入烧碱溶液中发生反应的化学方程式为。(7)、写出一个能证明⑧的非金属性小于⑨的离子方程式。17. 如图,通过工业联产可有效解决多晶硅(Si)生产中副产物SiCl4。所带来的环境问题。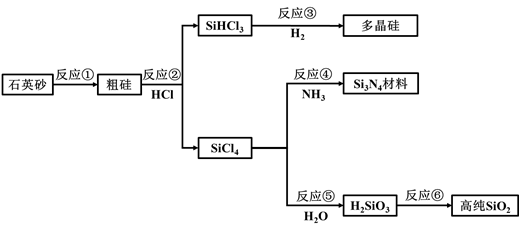 (1)、Si在元素周期表中的位置是。(2)、反应①的化学方程式为。(3)、流程中涉及的化学反应属于氧化还原反应的有(填反应序号)。(4)、高温下,反应④的化学方程式为。(5)、在多晶硅、Si3N4材料和高纯SiO2中,可用于制造光是纤维的是。(6)、Si和Ge属于同主族元素。下列预测合理的是(填选项序号)。
(1)、Si在元素周期表中的位置是。(2)、反应①的化学方程式为。(3)、流程中涉及的化学反应属于氧化还原反应的有(填反应序号)。(4)、高温下,反应④的化学方程式为。(5)、在多晶硅、Si3N4材料和高纯SiO2中,可用于制造光是纤维的是。(6)、Si和Ge属于同主族元素。下列预测合理的是(填选项序号)。a.Ge与H2化合难于Si
b.GeO2既有氧化性又有还原性
c.酸性H2GeO3>H2SiO3
d.Si和Ge都可做半导体材料
18. 工业上利用软锰矿(主要成分MnO2、还含Fe、Al、Mg、Zn、Ca、Si等元素)与纤维素制备Mn3O4 , 工艺如下图所示。 (1)、利用纤维素“酸浸"相较于FeS2酸浸法,除了原料来源丰富、成本低廉、耗能低外还有的优点是(填两点)。(2)、“酸浸”时,由纤维素水解得到的葡萄糖与软锰矿反应。完成葡萄糖与软锰矿反应的离子方程式:C6H12O6+12MnO2+=12Mn2++6CO2↑+口。(3)、“中和”时,相关离子形成氢氧化物沉淀的pH范围如下:
(1)、利用纤维素“酸浸"相较于FeS2酸浸法,除了原料来源丰富、成本低廉、耗能低外还有的优点是(填两点)。(2)、“酸浸”时,由纤维素水解得到的葡萄糖与软锰矿反应。完成葡萄糖与软锰矿反应的离子方程式:C6H12O6+12MnO2+=12Mn2++6CO2↑+口。(3)、“中和”时,相关离子形成氢氧化物沉淀的pH范围如下:金属离子
Fe3+
Al3+
Mg2+
Zn2+
Mn2+
开始沉淀的pH
1.5
3.0
8.9
6.0
8.1
沉淀完全的pH
2.8
4.7
10.9
8.0
10.1
“中和”的目的是使(填离子符号)完全沉淀。
(4)、“净化"时,加入Na2S、NH4F是为了将Zn2+、Mg2+转化为ZnS和MgF2沉淀除去,还能除去(填元素符号)。(5)、“沉锰”时,主要生成Mn(OH)2和Mn2(OH)2SO4沉淀,其中生成Mn(OH)2的离子方程式为。(6)、“氧化”时,氧化时间对产品中的锰含量及溶液pH的影响如下图。最佳的氧化时间为min;下列说法正确的是。
A.前15min,主要发生的反应是6Mn(OH)2+O2=2Mn3O4+6H2O,pH下降较慢
B.15-150min,主要发生的反应是3Mn2(OH)2SO4+O2=2Mn3O4+6H++3 ,pH下降较快
C.150min之后,pH趋于稳定,则Mn2(OH)2SO4已完全氧化
D.250min后,继续通O2 , 可能氧化生成Mn2O3及MnO2 , 使产品中的锰含量下降
19. 丙烯(B)可合成口罩熔喷布的原料聚丙烯( ),也可制得在医疗上有重要用途的乳酸(D)。制备转化关系如下(已知含有相同官能团的有机物具有相似的化学性质):
),也可制得在医疗上有重要用途的乳酸(D)。制备转化关系如下(已知含有相同官能团的有机物具有相似的化学性质):  (1)、B中含有的官能团名称是。(2)、B→A反应的化学方程式为。(3)、B分子在同一个平面的原子最多有个。(4)、1molD可与mol铁发生反应;产物乳酸亚铁可治疗的疾病是。(5)、写出C的一种同分异构体(填结构简式)。(6)、下列说法正确的是。
(1)、B中含有的官能团名称是。(2)、B→A反应的化学方程式为。(3)、B分子在同一个平面的原子最多有个。(4)、1molD可与mol铁发生反应;产物乳酸亚铁可治疗的疾病是。(5)、写出C的一种同分异构体(填结构简式)。(6)、下列说法正确的是。a.B可与HBr反应得到C
b.用新制氢氧化铜悬浊液可鉴别乙醛和D
c.D在浓硫酸作用下发生酯化反应得到的酯只有一种
d.相同物质的量的B和D完全燃烧耗氧量相等
20. 某化学兴趣小组为探究氧化性强弱的影响因素进行如下实验。 (1)、饱和食盐水的作用是。装置F可吸收微量氯气制得氯水,使用倒置漏斗的目的是。(2)、装置A中产生Cl2的化学方程式为 , 可推知氧化性:Cl2 (填“>”或“<”)。(3)、装置D中可观察到溶液变紫红色,则该反应的离子方程式为 , 可推知氧化性Cl2 (填“>”或“<”)。(4)、通过对比(2)和(3)可判断的氧化性强弱的影响因素是。利用本实验充分反应所得溶液设计实验验证你的判断。实验方案为。(5)、有同学认为无需流量控制器,你是否认可?并简要说明理由。
(1)、饱和食盐水的作用是。装置F可吸收微量氯气制得氯水,使用倒置漏斗的目的是。(2)、装置A中产生Cl2的化学方程式为 , 可推知氧化性:Cl2 (填“>”或“<”)。(3)、装置D中可观察到溶液变紫红色,则该反应的离子方程式为 , 可推知氧化性Cl2 (填“>”或“<”)。(4)、通过对比(2)和(3)可判断的氧化性强弱的影响因素是。利用本实验充分反应所得溶液设计实验验证你的判断。实验方案为。(5)、有同学认为无需流量控制器,你是否认可?并简要说明理由。