中考二轮专题复习:酸和碱 (基础巩固)
试卷更新日期:2021-04-28 类型:二轮复习
一、单选题
-
1. 如图所示为银白色金属镓,放在掌心会迅速变为液态,密度略大于铝,在空气中表面易氧化形成氧化膜。其中属于镓的化学性质的是( )
 A、能被氧化 B、银白色 C、熔点低 D、密度较小2. 如图为某同学的部分体液的pH,其中碱性最强的体液是( )
A、能被氧化 B、银白色 C、熔点低 D、密度较小2. 如图为某同学的部分体液的pH,其中碱性最强的体液是( ) A、胃液 B、唾液 C、肠液 D、胰液3. 体液的pH能够反映人体的健康状况,下表是四种体液的正常pH范围。据表可知,体液在正常pH范围都呈碱性的是( )
A、胃液 B、唾液 C、肠液 D、胰液3. 体液的pH能够反映人体的健康状况,下表是四种体液的正常pH范围。据表可知,体液在正常pH范围都呈碱性的是( )体液
唾液
胃液
血液
尿液
正常pH范围
6.6~7.1
0.8~1.5
7.35~7.45
4.6~8.0
A、唾液 B、胃液 C、血液 D、尿液4. 人体内一些液体的pH如下所示,其中酸性最强的是( )A、胃液:0.9~1.5 B、唾液:6.6~7.1 C、血浆:7.35~7.45 D、尿液:4.7~7.95. 下列温州传统民俗活动中,主要涉及化学变化的是( )A、做糖画 B、捣年糕
B、捣年糕  C、酿米酒
C、酿米酒  D、捏米塑
D、捏米塑  6. 农村有句谚语“雷雨发庄稼”,这是由于在放电的条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。可以说,雷雨给庄稼施加了( )A、氮肥 B、钾肥 C、磷肥 D、复合肥料7. 在浓硫酸的运输过程中,能将浓硫酸盛放在铁制的容器中。其原因是( )A、铁的化学性质稳定,不与硫酸反应 B、铁与浓硫酸反应生成致密的氧化物 C、铁与浓硫酸反应生成FeSO4保护层 D、铁与浓硫酸反应生成Fe2(SO4)3保护层8. 下列物质不能使金属生成金属氧化物的是( )A、氧气 B、浓硫酸 C、稀硫酸 D、硝酸9. 快过年了,在仙居下列传统年味中,其中主要发生化学变化的是( )A、捣年糕
6. 农村有句谚语“雷雨发庄稼”,这是由于在放电的条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。可以说,雷雨给庄稼施加了( )A、氮肥 B、钾肥 C、磷肥 D、复合肥料7. 在浓硫酸的运输过程中,能将浓硫酸盛放在铁制的容器中。其原因是( )A、铁的化学性质稳定,不与硫酸反应 B、铁与浓硫酸反应生成致密的氧化物 C、铁与浓硫酸反应生成FeSO4保护层 D、铁与浓硫酸反应生成Fe2(SO4)3保护层8. 下列物质不能使金属生成金属氧化物的是( )A、氧气 B、浓硫酸 C、稀硫酸 D、硝酸9. 快过年了,在仙居下列传统年味中,其中主要发生化学变化的是( )A、捣年糕 B、挂彩灯
B、挂彩灯  C、做糖人
C、做糖人  D、燃放烟花
D、燃放烟花  10. 蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的( )A、食醋 B、肥皂水 C、浓氢氧化钠溶液 D、稀盐酸11. 如图所示活动体现了我国古代劳动人民的勤劳和智慧。其中涉及化学变化的是( )A、织布
10. 蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的( )A、食醋 B、肥皂水 C、浓氢氧化钠溶液 D、稀盐酸11. 如图所示活动体现了我国古代劳动人民的勤劳和智慧。其中涉及化学变化的是( )A、织布 B、耕田
B、耕田  C、生火
C、生火  D、灌溉
D、灌溉  12. 婴儿纸尿裤的“尿显”试剂常用溴甲酚绿(pH试纸上的显色物质之一),其在pH≤3.8时呈黄色,pH≥5.4 时呈蓝绿色,pH=4.5 时开始有颜色的明显变化。已知婴儿尿液的pH范围为5.4-8.4,那么,当婴儿尿湿纸尿裤时,“尿显”试剂显示的颜色最有可能是( )A、无色 B、黄色 C、蓝绿色 D、黄绿色13. 某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,有的叶脉呈淡棕色,你认为应该施加下列哪一种化肥( )A、氯化钾 B、过磷酸钙 C、硫酸钾 D、尿素14. 氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品,可作为化肥,其水溶液呈酸性。下列关于氯化铵的说法,正确的是( )A、氯化铵是一种复合肥料 B、氯化铵能促进作物籽粒饱满 C、氯化铵溶液能使紫色石蕊变蓝 D、氯化铵溶液的pH<715. 蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的( )A、食醋 B、肥皂水 C、浓氢氧化钠 D、稀盐酸16. 如图所示是硫酸和氢氧化钠溶液反应时pH的变化图象,下列说法正( )
12. 婴儿纸尿裤的“尿显”试剂常用溴甲酚绿(pH试纸上的显色物质之一),其在pH≤3.8时呈黄色,pH≥5.4 时呈蓝绿色,pH=4.5 时开始有颜色的明显变化。已知婴儿尿液的pH范围为5.4-8.4,那么,当婴儿尿湿纸尿裤时,“尿显”试剂显示的颜色最有可能是( )A、无色 B、黄色 C、蓝绿色 D、黄绿色13. 某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,有的叶脉呈淡棕色,你认为应该施加下列哪一种化肥( )A、氯化钾 B、过磷酸钙 C、硫酸钾 D、尿素14. 氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品,可作为化肥,其水溶液呈酸性。下列关于氯化铵的说法,正确的是( )A、氯化铵是一种复合肥料 B、氯化铵能促进作物籽粒饱满 C、氯化铵溶液能使紫色石蕊变蓝 D、氯化铵溶液的pH<715. 蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的( )A、食醋 B、肥皂水 C、浓氢氧化钠 D、稀盐酸16. 如图所示是硫酸和氢氧化钠溶液反应时pH的变化图象,下列说法正( ) A、图中a点所示溶液中,含有的溶质是硫酸钠和硫酸 B、图中b点时,硫酸和氢氧化钠恰好完全反应 C、图中c点所示溶液呈碱性 D、该实验是将氢氧化钠溶液滴到硫酸溶液中17. 铁粉露置在空气中时间久了以后会变成铁锈,下列选项能作为此变化是化学变化的最可靠证据的是( )A、“铁粉”的质量增加了 B、“铁粉”的颜色变红了 C、“铁粉”的体积膨胀了 D、“铁粉”不能被磁铁吸引了18. 下列古代生产工艺中主要体现化学变化的是( )A、粮食粮酒 B、纺纱织布 C、在甲骨文上刻字 D、用石块修筑长城19. 技术员测定了某块耕地土壤中的氮磷钾含量,测定结果及土壤肥量标准如表,请你判断此块耕地应施用的化肥是( )
A、图中a点所示溶液中,含有的溶质是硫酸钠和硫酸 B、图中b点时,硫酸和氢氧化钠恰好完全反应 C、图中c点所示溶液呈碱性 D、该实验是将氢氧化钠溶液滴到硫酸溶液中17. 铁粉露置在空气中时间久了以后会变成铁锈,下列选项能作为此变化是化学变化的最可靠证据的是( )A、“铁粉”的质量增加了 B、“铁粉”的颜色变红了 C、“铁粉”的体积膨胀了 D、“铁粉”不能被磁铁吸引了18. 下列古代生产工艺中主要体现化学变化的是( )A、粮食粮酒 B、纺纱织布 C、在甲骨文上刻字 D、用石块修筑长城19. 技术员测定了某块耕地土壤中的氮磷钾含量,测定结果及土壤肥量标准如表,请你判断此块耕地应施用的化肥是( )含氮
含磷
含钾
土壤肥量标准(g/kg)
0.62
0.34
17.8
测定结果(g/kg)
0.40
0.38
13.6
A、KNO3 B、(NH4)2SO4 C、K2CO3 D、Ca3(PO4)220. 下列物质不需要密封保存的是( )A、浓硫酸 B、大理石 C、氢氧化钠 D、澄清石灰水二、填空题
-
21. 有下列几种物质:A.盐酸 B.熟石灰 C.纯碱 D.食盐;请选择合适的标号(A~D)填空。(1)、少量存于胃液中帮助消化的是。(2)、常用来降低土壤酸性的是;22. 测定BaCl2•xH2O中结晶水数目的过程如图所示:
 (1)、写出此过程中生成的沉淀的化学式是。(2)、在灼烧过程中,如果空气不充足和温度过高,会有部分沉淀物转化为BaS,这会使x的测定结果(选填“偏低”、“偏高”或“不变”)。23. 下列3种物质:请从①氢氧化钙、②氢氧化铝、③氯化钠中选择适当物质填空(填序号)(1)、用于治疗胃酸过多症的是;(2)、用作改良酸性土壤的是24. 按要求将下列各组物质的序号填写到横线上。
(1)、写出此过程中生成的沉淀的化学式是。(2)、在灼烧过程中,如果空气不充足和温度过高,会有部分沉淀物转化为BaS,这会使x的测定结果(选填“偏低”、“偏高”或“不变”)。23. 下列3种物质:请从①氢氧化钙、②氢氧化铝、③氯化钠中选择适当物质填空(填序号)(1)、用于治疗胃酸过多症的是;(2)、用作改良酸性土壤的是24. 按要求将下列各组物质的序号填写到横线上。a.氢氧化铝 b.苛性钠 c.熟石灰 d.醋酸
①可用来配制波尔多液的是。 ②可用来治疗胃酸过多的是。③可用来除去热水瓶中水垢的是。
25. 选择下列物质的序号填空:①纯碱 ②熟石灰 ③石灰石 ④稀硫酸 ⑤苛性钠固体(1)、用于改良酸性土壤的是。(2)、通常用于某些气体的干燥剂的是。26. 我们把物质在发生变化后有新的物质产生的变化叫做 , 没有生成其他物质的变化叫。物质只能在中表现出来的性质叫化学性质。27. 如图是某学生设计的一种有洗气、检验、贮气等用途的装置。当除去氧气中混有的水蒸气时,混合气体应从(填“A”或“B”)处导管进入,瓶中盛有的液体可能是 , 这位同学不小心被这种液体滴到,他应该立即。 28. 有下列几种物质:a.盐酸 b.熟石灰 c.纯碱 d.食盐;请选择合适的标号(a∼d)填空。(1)、少量存于胃液中帮助消化的是;(2)、常用降低土壤酸性的是;(3)、在日常生活中用做调味剂的是;(4)、做馒头时用于除去面团发酵生成的酸的是.29. 植物生活需要多种无机盐,如果要使植物的茎杆健壮,应多施一些含的无机盐;如果要使植物的枝叶生长得茂盛,应多施一些含的无机盐。根据植物生活需要的无机盐种类、数量和比例配制成营养液来栽培植物,叫做。30. 铁营养缺乏是目前全球最严重的营养问题之一。“铁强化酱油”就是以强化营养为目的,按照标准在酱油中加入一定量的乙二胺四乙酸铁钠(C10H12FeN2NaO8)制成的营养强化调味品。乙二胺四乙酸铁钠为淡土黄色结晶性粉末,性质稳定——耐高温、不易被氧化;易溶于水;在20℃时,其溶质质量分数为1%的水溶液的pH在3.5~5.5之间。根据以上资料,请回答下列问题:(1)、乙二胺四乙酸铁钠是种元素组成的化合物,其中铁、氧元素的质量比是。(2)、乙二胺四乙酸铁钠的物理性质有。乙二胺四乙酸铁钠的水溶液呈性。
28. 有下列几种物质:a.盐酸 b.熟石灰 c.纯碱 d.食盐;请选择合适的标号(a∼d)填空。(1)、少量存于胃液中帮助消化的是;(2)、常用降低土壤酸性的是;(3)、在日常生活中用做调味剂的是;(4)、做馒头时用于除去面团发酵生成的酸的是.29. 植物生活需要多种无机盐,如果要使植物的茎杆健壮,应多施一些含的无机盐;如果要使植物的枝叶生长得茂盛,应多施一些含的无机盐。根据植物生活需要的无机盐种类、数量和比例配制成营养液来栽培植物,叫做。30. 铁营养缺乏是目前全球最严重的营养问题之一。“铁强化酱油”就是以强化营养为目的,按照标准在酱油中加入一定量的乙二胺四乙酸铁钠(C10H12FeN2NaO8)制成的营养强化调味品。乙二胺四乙酸铁钠为淡土黄色结晶性粉末,性质稳定——耐高温、不易被氧化;易溶于水;在20℃时,其溶质质量分数为1%的水溶液的pH在3.5~5.5之间。根据以上资料,请回答下列问题:(1)、乙二胺四乙酸铁钠是种元素组成的化合物,其中铁、氧元素的质量比是。(2)、乙二胺四乙酸铁钠的物理性质有。乙二胺四乙酸铁钠的水溶液呈性。三、实验探究题
-
31. 2019年屠呦呦被授予“共和国勋章”,以表彰她在有效提取青蒿素方面作出的杰出贡献。青蒿素是从青蒿中提取出来的一种化学物质,也是目前世界上唯一的特效抗虐新药。
 (1)、青蒿是菊科蒿属植物(图一),一年生草本,6-9月开花结果。图二是使用检索表对植物进行分类的示意图,青蒿应被分在(填“甲”、“乙”或“丙”)。(2)、青蒿在生活中应用广泛,可用于煲汤、制青蒿梅冬茶,其汁液可用于治疗疟疾等病症!早在东晋时期,名医葛洪将青蒿加热煮沸治疗疟疾,但药性很不稳定,有效物质容易分解,这属于青蒿素的(填“物理性质”或“化学性质”)。(3)、青蒿素不仅仅是一种抗疟疾的特效药,还对癌症有治疗作用。为探究青蒿素抗癌作用机理,科研人员展开实验,数据记录如图三,其中将④组与组进行对照,可以证明青蒿素对铁浓度较高的癌细胞的抑制效果最好。32. 某课外兴趣小组,确定了“酸碱中和生成的正盐溶液的性质”作为研究课题,在研究中他们发现,正盐虽然不能电离出氢离子或氢氧根离子,但是其溶液却不一定呈中性,有的呈酸性、有的呈碱性。为什么呢?盐溶液的酸碱性与什么有关呢?由“组成、结构决定物质性质”的观点出发。他们又进步从组成特征上去找原因,发现正盐溶液的酸碱性与对应的酸和截的强弱有关。他们将实验结果统计如下:
(1)、青蒿是菊科蒿属植物(图一),一年生草本,6-9月开花结果。图二是使用检索表对植物进行分类的示意图,青蒿应被分在(填“甲”、“乙”或“丙”)。(2)、青蒿在生活中应用广泛,可用于煲汤、制青蒿梅冬茶,其汁液可用于治疗疟疾等病症!早在东晋时期,名医葛洪将青蒿加热煮沸治疗疟疾,但药性很不稳定,有效物质容易分解,这属于青蒿素的(填“物理性质”或“化学性质”)。(3)、青蒿素不仅仅是一种抗疟疾的特效药,还对癌症有治疗作用。为探究青蒿素抗癌作用机理,科研人员展开实验,数据记录如图三,其中将④组与组进行对照,可以证明青蒿素对铁浓度较高的癌细胞的抑制效果最好。32. 某课外兴趣小组,确定了“酸碱中和生成的正盐溶液的性质”作为研究课题,在研究中他们发现,正盐虽然不能电离出氢离子或氢氧根离子,但是其溶液却不一定呈中性,有的呈酸性、有的呈碱性。为什么呢?盐溶液的酸碱性与什么有关呢?由“组成、结构决定物质性质”的观点出发。他们又进步从组成特征上去找原因,发现正盐溶液的酸碱性与对应的酸和截的强弱有关。他们将实验结果统计如下:酸
碱
相应的正盐
溶液的pH
HCl(强酸)
NaOH(强碱)
NaCl
7
H2SO4(强酸)
KOH(强碱)
K2SO4
7
H2CO3(弱酸)
NaOH(强碱)
Na2CO3
>7
H2PO4(弱酸)
KOH(强碱)
K3PO4
>7
HNO3(强酸)
Cu(OH)2(弱碱)
Cu(NO3)2
<7
HCl(强酸)
Fe(OH)2(弱碱)
FeCl3
<7
(1)、请你根据上表归纳出正盐溶液的酸碱性与对应酸、碱的强弱关系:。(2)、根据他们的发现,请你判断硝酸钠、硝酸铁、硫酸铜、氯化钾、磷酸钠、碱酸钾六种溶液的酸碱性,其中溶液呈酸性的是 , 呈碱性的是 , 呈中性的是。33. 央企报道“全国多地相继出现了假干粉灭火器”.干粉灭火器中灭火剂的主要成分是碳酸氢钠,而假干粉灭火器是用面粉做灭火剂.兴趣小组同学想了解学校干粉灭火器的灭火剂是否为报道中的“假干粉”.设计了以下实验进行探究:(1)、探究一:甲、乙同学分别用物理方法和化学方法设计方案,进行如下实验:实验步骤
实验现象
实验结论
甲
取少量灭火剂于试管中,加入一定量的
粉末逐渐溶解
该灭火剂不属于报道中的“假干粉”
乙
取少量灭火剂于试管中,加入一定量的稀盐酸
乙同学设计方案中发生反应的化学方程式为 .
(2)、探究二:小组同学利用灭火器进行实验后,发现可燃物表面有白色粉末残留.为了解白色粉末的主要成分,继续以下探究:【查阅资料】1、碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解.
2、碳酸氢钠溶解吸收热量;碳酸钠溶解放出热量.
【提出猜想】猜想1:残留主要成分是碳酸钠;猜想2:残留主要成分是 .
【设计方案】小组同学设计的下列实验方案中,错误的是 (填序号).
A、加热残留物质将产生的气体通入澄清的石灰水中,若观察到澄清石灰水变浑浊,则猜想2正确
B、将残留物溶于水,若有放热现象,则猜想1正确
C、将残留物溶于水,加过量氯化钙溶液静置,取上层清液加稀盐酸,若产生气泡,则猜想2正确
【反思评价】设计实验方案要思维缜密,考虑周全.用化学知识解释上述错误方案存在的主要问题 .
34.某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
 (1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
(1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:溶液
白醋
盐酸
蔗糖水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
①图1中存放紫薯汁的仪器名称是;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是.
(2)、用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于(填“酸性”、“中性”或“碱性”)溶液,白醋pH(填“>”、“<”或“=”)7(3)、图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是 (填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 .35. 实验室有一瓶无色溶液,老师告诉同学们该溶液可能是Ca(OH)2溶液、NaCl溶液、Na2CO3溶液中的一种,请你和同学们一起来参与探究,并回答问题:(1)、【实验探究】(1)取少量该溶液于试管中,滴加酚酞试液,溶液变红色,则原溶液不可能是 溶液;
(2)另取少量该溶液于试管中,滴加BaCl2溶液,产生(填实验现象),则该溶液为Na2CO3溶液,其反应的化学方程式为 .
(2)、【思维拓展】某白色固体由NH4Cl、Ba(NO3)2、K2SO4、Na2CO3中的三种组成,取样后加入足量的水,充分搅拌后,有白色沉淀生成,则原固体混合物的组成可能有 (填序号).
①NH4Cl、Ba(NO3)2、K2SO4
②HN4Cl、Ba(NO3)2、Na2CO3
③NH4Cl、K2SO4、Na2CO3
④Ba(NO3)2、K2SO4、Na2CO3 .
36. 某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖.对于该溶液是否变质,同学们开始实验探究.【猜想假设】
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为Na2CO3溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
【查阅资料】Na2CO3溶液呈碱性
(1)、【设计方案】请你完善下表几组同学探讨的设计方案
实验操作
可能出现的现象与结论
同学评价
第1组
若溶液变红,则猜想(2)不成立
第2组同学认为:此方案结论不正确,理由是: .
第2组

若产生白色沉淀,反应方程式是: ,则猜想(1)不成立.
第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立.
第3组

若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立.
第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是: .
(2)、【探究实验】综合各小组的方案后,动手实验.
【结论与反思】NaOH溶液易与空气中CO2反应而变质,所以要密封保存.
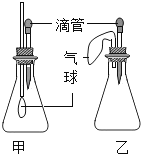
【拓展延伸】同学们设计了如图两套装置进行实验:
用胶头滴管吸取某种液体,锥形瓶中充入一种气体或放入一种固体物质,挤压胶头滴管.一段时间后,两装置中气球明显胀大.
(1)甲装置中可能发生反应的方程式是 .
(2)若乙装置中胶头滴管吸取的是稀盐酸,则锥形瓶中放入的固体可能是 .
 37.
37.某校化学兴趣小组的同学用如图装置进行木炭还原氧化铜的实验并进行相关探究实验.假定实验产生的二氧化碳全部被澄清石灰水吸收.将试管b中的混浊液过滤、洗涤、干燥、称量,理论上得固体物质2.00g.实验完毕后,发现试管a中仍有黑色固体物质.

【提出猜想】
李华同学:黑色固体物质是木炭
刘明同学:黑色固体物质是氧化铜
王军同学:黑色固体物质是木炭和氧化铜的混合物
【查阅资料】
木炭、铜都不溶于水也不能与稀硫酸发生反应;CuO、Fe2O3等能与稀硫酸反应生成盐和水.
【实验设计】
①将反应后试管a中的固体物质全部转入小烧杯c中,加入足量稀硫酸,用玻璃棒充分搅拌后,过滤,得到蓝色滤液e和固体物质f.
②将f全部转入坩埚中充分灼烧,看到燃烧现象.完全反应后,冷却、称量,理论上得固体物质4.80g.
(1)、【实验结论】同学的猜想正确.(2)、【结果应用】①根据实验相关数据,写出试管a中反应的化学方程式 ;②请对上述实验装置提出改进意见 .
(3)、【实验拓展】请你设计一个实验方案,证明滤液e中含H+(酸) .38. 某化学社团的同学发现,不同物质的变化常伴随着相同的实验现象,但从化学的角度去研究,会发现其有本质的区别.(1)、【现象分析】实验一:向盛有一定量氢氧化钠固体的试管里加入一定量的水,迅速用带导管的橡皮塞塞紧试管口,并将导管另一端通入盛有水的试管中,振荡左侧试管(如图).
实验二:用氧化钙代替氢氧化钠重复一次上述实验.
上述两个实验的相同现象之一是 ;
上述两个实验中,其中一个实验发生了化学变化,其化学方程式是 ;
另一个实验没有发生化学变化.
(2)、【本质归纳】
相同的实验现象,既可以由物理变化引起,也可以由化学变化引起.
【探究运用】
在探究白色粉末的组成时,要研究相同实验现象的本质区别.
实验三:有一包白色粉末可能含有硫酸钡、碳酸钾和氢氧化钡中的一种或几种,取一定量该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到烧杯中有白色不溶物.
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为,小明的结论不准确,其理由可用化学方程式表示为 .
针对上述两位同学的观点,小燕同学进一步设计如下实验方案进行探究:

(1)步骤②中发生化学反应的方程式是 .
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是 (填化学式,下同);
步骤③中加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是 ,原白色粉末的可能组成是 ;
(3)小鹏同学认为,只需取少量滤渣B,加入过量的稀硝酸,若看到的现象是 ,就足以说明原白色粉末中只含有碳酸钾和氢氧化钡.

四、解答题
-
39. “春蚕到死丝方尽,蜡炬成灰泪始干”,关于蜡烛的燃烧,甲、乙两位同学各抒己见。甲说:“蜡烛燃烧是化学变化,因为它有新的物质生成。”乙说:“蜡烛燃烧是物理变化,因为蜡烛燃烧时蜡要熔化、升华。”那么你的观点呢?请给出合理解释。
40. 某学校化学课外活动小组的同学开展了下列实验活动,取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如表所示:测定时间
5:05
5:10
5:15
5:20
5:25
5:30
5:35
pH
4.95
4.94
4.88
4.86
4.85
4.84
4.82
(1)、在测定期间,雨水的酸性是增强还是减弱?(2)、这一地区所降雨水为酸雨,写出酸雨造成的一条危害.(3)、为了减少酸雨的产生,请提出一条合理的措施.