高中化学鲁科版(2019)必修第二册 第2章测试卷
试卷更新日期:2021-04-27 类型:单元试卷
一、单选题
-
1. 下列过程中,将电能转化为化学能的是( )A、

风力发电机
B、
天然气烧水
C、
硅太阳能电池
D、
电解熔融氯化钠2. 下列物质既含有离子键,又含有共价键的是( )A、H2S B、Na2S C、H2SO4 D、(NH4)2SO43. 下列关于非金属元素和金属元素特征的叙述不正确的是( )①非金属元素可能有还原性,也可能有氧化性;②非金属元素只能形成共价化合物;③金属阳离子被还原不一定得到金属单质;④金属元素不可能存在于阴离子中;
⑤金属元素与非金属元素形成的化合物一定是离子化合物
A、①③ B、②③ C、③④⑤ D、②④⑤4. 某原电池,将两金属X、Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则下列情况中有可能的是( )A、X是负极,电解质溶液为CuSO4溶液 B、X是负极,电解质溶液为H2SO4溶液 C、X是正极,电解质溶液为CuSO4溶液 D、X是正极,电解质溶液为H2SO4溶液5. 某碱性电池的总反应为 ,工作原理如图所示,下列说法错误的是( ) A、石墨电极为正极,发生氧化反应 B、电池工作时, 移向 电极 C、电池工作一段时间后,电解质溶液的pH减小 D、外电路中电子流动方向: 灯泡 (石墨)6. 甲醇-空气燃料电池(DMFC)是一种高效能轻污染的车载电池其工作原理如图。下列有关叙述正确的是( )
A、石墨电极为正极,发生氧化反应 B、电池工作时, 移向 电极 C、电池工作一段时间后,电解质溶液的pH减小 D、外电路中电子流动方向: 灯泡 (石墨)6. 甲醇-空气燃料电池(DMFC)是一种高效能轻污染的车载电池其工作原理如图。下列有关叙述正确的是( ) A、乙电极为正极,发生氧化反应 B、甲电极的反应为:CH3OH-6e-+8OH-=CO +6H2O C、放电过程中溶液的pH升高 D、电子移动方向为:甲电极→电流计→乙电极→溶液→甲电极7. 关于下图中原电池的盐桥(由饱和KCl溶液和琼脂制成)说法正确的是( )
A、乙电极为正极,发生氧化反应 B、甲电极的反应为:CH3OH-6e-+8OH-=CO +6H2O C、放电过程中溶液的pH升高 D、电子移动方向为:甲电极→电流计→乙电极→溶液→甲电极7. 关于下图中原电池的盐桥(由饱和KCl溶液和琼脂制成)说法正确的是( )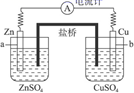 A、有无盐桥不影响该原电池的工作 B、电池工作时,盐桥中K+会向Zn电极一侧移动 C、电池工作时,盐桥中Cl-会向Zn电极一侧移动 D、电池工作时,盐桥中的电子由Cu电极向Zn电极移动8. 向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下:
A、有无盐桥不影响该原电池的工作 B、电池工作时,盐桥中K+会向Zn电极一侧移动 C、电池工作时,盐桥中Cl-会向Zn电极一侧移动 D、电池工作时,盐桥中的电子由Cu电极向Zn电极移动8. 向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下:
0
5
10
20
…
0.0
8.96
15.68
22.40
…
下列判断正确的是( )
A、反应ⅰ是放热反应 B、反应ⅱ是整个反应的决速步骤 C、 是 分解反应的催化剂 D、0~20 的平均反应速率:9. 一定温度下的密闭容器中发生C(s)+H2O(g) CO(g)+H2(g)-Q(Q>0),达到化学平衡后( )A、加入更多的C,平衡正向移动 B、升高温度,平衡逆向移动 C、增大压强,平衡逆向移动 D、加入催化剂,CO的浓度增大10. 已知反应2CO(g)+4H2(g) CH2=CH2(g)+2H2O(g)在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )A、v(H2O)=0.1mol·L-1·s-1 B、v(H2)=4.5mol·L-1·s-1 C、v(CH2=CH2)=0.03mol·L-1·s-1 D、v(CO)=1.5mol·L-1·s-111. 过量的铁粉与100mL0.01mol·L﹣1的稀盐酸反应。为了减慢反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O ②加NaOH固体 ③将盐酸用量减半,浓度不变 ④加CuO固体 ⑤加NaCl溶液 ⑥加入硝酸钾溶液 ⑦降低温度(不考虑盐酸挥发)
A、①⑤⑦ B、①⑤⑥⑦ C、③⑦ D、②④⑥12. 在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,下列说法正确的是( )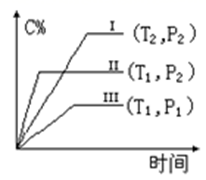 A、温度:T2>T1 B、压强:P1>P2 C、该正反应是吸热反应 D、x的取值是:x=1
A、温度:T2>T1 B、压强:P1>P2 C、该正反应是吸热反应 D、x的取值是:x=1二、综合题
-
13. 在一个密闭容器中发生反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。回答下列问题:(1)、增加Fe的量,反应速率(填“增大”“不变”或“减小”,下同)。(2)、将容器容积缩小一半,反应速率。(3)、保持容器容积不变,充入N2使体系压强增大,反应速率。(4)、保持压强不变,充入N2使容器容积增大,正反应速率 , 逆反应速率。14. 如图为铜锌原电池的装置示意图,其中盐桥内装琼脂-饱和KCl溶液。请回答下列问题:
 (1)、Zn电极为电池的(填“正极”或“负极”)。(2)、写出电极反应式:Zn电极: Cu电极:。(3)、盐桥中向CuSO4溶液中迁移的离子是。(4)、若保持原电池的总反应不变,下列替换不可行的是____________(填字母)。A、用石墨替换Cu电极 B、用NaCl溶液替换ZnSO4溶液 C、用稀H2SO4代替CuSO4溶液(5)、请选择适当的材料和试剂,将反应2Fe3+ + 2I-= 2Fe2+ + I2设计成一个原电池,请填写表格:
(1)、Zn电极为电池的(填“正极”或“负极”)。(2)、写出电极反应式:Zn电极: Cu电极:。(3)、盐桥中向CuSO4溶液中迁移的离子是。(4)、若保持原电池的总反应不变,下列替换不可行的是____________(填字母)。A、用石墨替换Cu电极 B、用NaCl溶液替换ZnSO4溶液 C、用稀H2SO4代替CuSO4溶液(5)、请选择适当的材料和试剂,将反应2Fe3+ + 2I-= 2Fe2+ + I2设计成一个原电池,请填写表格:设计思路
负极
负极材料
负极反应物
正极
正极材料
正极反应物
电子导体
离子导体
在方框内画出简单的装置示意图,并标明使用的材料和试剂。
 15. 如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。
15. 如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。 (1)、若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为 , 当有1.6g负极材料溶解时,转移的电子为mol;(2)、若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为→ (填电极材料,下同),溶液中的NO 向极移动;(3)、氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为。16. 为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
(1)、若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为 , 当有1.6g负极材料溶解时,转移的电子为mol;(2)、若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为→ (填电极材料,下同),溶液中的NO 向极移动;(3)、氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为。16. 为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。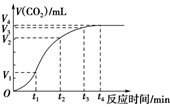 (1)、化学反应速率最快的时间段是 , 原因是
(1)、化学反应速率最快的时间段是 , 原因是A.0~t1 B.t1~t2 C.t2~t3 D.t3~t4
(2)、为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的是________;A、通入HCl B、NaCl固体 C、NaCl溶液 D、蒸馏水(3)、若盐酸溶液的体积是20 mL,图中CO2的体积是标准状况下的体积,则t1~t2 , 时间段平均反应速率v(HCl)= mol·L-1·min-1。17. X、Y、Z、W、R为元素周期表前二十号元素,原子序数依次增大,其中有两种元素同主族。X原子的核外电子数是电子层数的三倍,X、Y 化合形成温室气体 M,X、Z原子最外层电子数之和等于Y的族序数,W 的单质常温下为黄绿色气体。回答下列问题:(1)、写出元素符号:X , Y , R。(2)、W 的原子结构示意图为。(3)、M 的电子式为 , 属于(填“共价”或“离子”)化合物。(4)、Z、W、R简单离子半径由大到小的顺序为(填离子符号)。(5)、Z、R的最高价氧化物对应水化物碱性由强到弱的顺序为(填化学式)。(6)、用电子式表示Y 的最简单氢化物的形成过程:。