高中化学鲁科版(2019)必修第二册 第2章第1节 化学键与物质构成
试卷更新日期:2021-04-27 类型:同步测试
一、单选题
-
1. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法中正确的是( )
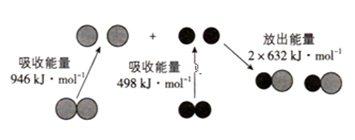 A、1molN2(g)和1molO2(g)反应放出的能量为180kJ B、1molN2(g)和1molO2(g)具有的总能量低于2molNO(g)具有的总能量 C、1molN2(g)和1molO2(g)具有的总键能低于2molNO(g)具有的总键能 D、通常情况下,N2(g)和O2(g)混合能直接生成NO(g)2. 下列物质中含有共价键的盐是( )A、KOH B、KClO C、KCl D、HClO3. 下列各组物质中,化学键类型相同、固体熔化时破坏的作用力也相同的是( )A、Na2O、Na2O2 B、MgCl2、AlCl3 C、CO2、SiO2 D、CO2、H2O4. 下列物质中,属于离子化合物的是( )A、NaOH B、HCl C、O2 D、NH35. 下列关于离子键的说法中,正确的是( )A、阴、阳离子间的相互吸引即离子键 B、非金属元素所组成的化合物中不可能有离子键 C、ⅠA族元素与ⅤA族元素之间形成的化合物一定含离子键 D、某化合物在熔融状态下能导电,该化合物一定含离子键6. 如表为元素周期表的一部分。X、Y、Z、W为短周期元素,其中Y元素的原子最外层电子数是其电子层数的3倍。下列说法正确的是( )
A、1molN2(g)和1molO2(g)反应放出的能量为180kJ B、1molN2(g)和1molO2(g)具有的总能量低于2molNO(g)具有的总能量 C、1molN2(g)和1molO2(g)具有的总键能低于2molNO(g)具有的总键能 D、通常情况下,N2(g)和O2(g)混合能直接生成NO(g)2. 下列物质中含有共价键的盐是( )A、KOH B、KClO C、KCl D、HClO3. 下列各组物质中,化学键类型相同、固体熔化时破坏的作用力也相同的是( )A、Na2O、Na2O2 B、MgCl2、AlCl3 C、CO2、SiO2 D、CO2、H2O4. 下列物质中,属于离子化合物的是( )A、NaOH B、HCl C、O2 D、NH35. 下列关于离子键的说法中,正确的是( )A、阴、阳离子间的相互吸引即离子键 B、非金属元素所组成的化合物中不可能有离子键 C、ⅠA族元素与ⅤA族元素之间形成的化合物一定含离子键 D、某化合物在熔融状态下能导电,该化合物一定含离子键6. 如表为元素周期表的一部分。X、Y、Z、W为短周期元素,其中Y元素的原子最外层电子数是其电子层数的3倍。下列说法正确的是( )X
Y
Z
W
T
A、Y的氢化物的沸点一定比X氢化物的沸点高 B、Z的氧化物对应的水化物酸性比W的弱 C、ZY2、XW4与Na2Z的化学键类型相同 D、根据元素周期律,可以推测存在TZ2和TW47. 下列说法正确的是( )A、H2O分子间存在氢键,所以H2O比H2S稳定 B、He、CO2和CH4分子中都存在共价键 C、PCl5中各原子的最外层均达到8电子稳定结构 D、NaHCO3受热分解生成Na2CO3、CO2和H2O的过程中,既破坏离子键,也破坏共价键8. 短周期元素x、y、d、f的最高正价或最低负价、原子半径的相对大小随原子序数的变化如图所示;短周期元素z、e、g、h的最高价氧化物对应水化物的溶液(浓度均为001mol/L)的pH与原子序数的关系如图所示: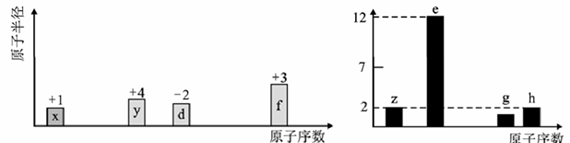
下列有关说法正确的是( )
A、离子半径大小顺序:e>f>g>h B、由x、z、d三种元素形成的化合物中一定不含离子键 C、y、d、g的简单气态氢化物中沸点最高的是g的氢化物 D、装满zd2气体的小试管倒扣水槽中充分反应,试管液面上升约2/39. 下列表示错误的是( )A、1molSiO2分子中含4mol共价键 B、氯化铵的电子式为: C、CH4的比例模型:
C、CH4的比例模型:  D、Cl-的结构示意图:
D、Cl-的结构示意图: 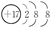 10. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程:
10. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程: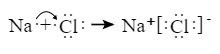 D、钢铁发生电化学腐蚀的正极反应:
D、钢铁发生电化学腐蚀的正极反应:
二、综合题
-
11. 香花石是1958年中国地质学家发现的第一种世界新矿物,其主要成分的化学式为 。回答下列问题:(1)、质子数与中子数相等的 原子的符号为 , 的结构示意图为。(2)、 位于元素周期表第周期族。(3)、香花石的主要成分的组成元素中,原子半径最小的是(填元素符号,下同),最大的是。(4)、 的电子式为。(5)、用电子式表示 (氟化钙)的形成过程:。12. 有下列七种物质:A、干冰 B、氧化镁 C、氯化铵 D、固态碘 E、烧碱 F、冰 G、过氧化钾(1)、熔化时需要破坏共价键和离子键的是(填序号,下同);(2)、既有离子键又有共价键的是;(3)、只含有极性键的是;(4)、含非极性键的是。13. A、B、C、D、E、F、G七种短周期元素,其原子半径和化合价关系如下表所示。已知:Mg的原子半径为0.160nm。
元素
A
B
C
D
E
F
G
原子半径(nm)
0.037
0.074
0.075
0.077
0.099
0.102
0.186
最高正化合价
+1
+5
+4
+7
+6
+l
最低负化合价
-1
-2
-3
-4
-l
-2
(1)、元素G在周期表中的位置为 , D、E、F的氢化物中最稳定的是(填化学式)。(2)、元素A、B形成的1:1型化合物的电子式为 , 根据电子是否得失与电子对是否偏移的角度判定:该物质含有的化学键类型有。(3)、用电子式表示G2F的形成过程。(4)、写出D的单质与ACB3的浓溶液反应的化学方程式(注明条件)。(5)、元素A和元素D可组成含9e-的中性原子团,其名称是。