高中化学人教版(2019)必修第二册 第六章第二节 化学反应的速率与限度
试卷更新日期:2021-04-26 类型:同步测试
一、单选题
-
1. 一定温度下,在两个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) ⇌CH3OCH3(g)+H2O(g)
容器
编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CH3OH(g)
CH3OCH3(g)
H2O(g)
Ⅰ
387
0.20
0.080
0.080
Ⅱ
207
0.20
0.090
0.090
下列说法正确的是( )
A、该反应的正反应为吸热反应 B、向平衡后的容器Ⅰ中充入少量CH3OH,平衡不移动 C、达到平衡时的逆反应速率:vⅠ(H2O)<vⅡ(H2O) D、若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行2. 下列关于合成氨反应N2(g)+3H2(g)⇌2NH3(g) ΔH<0的说法正确的是( )A、使用催化剂可以提高反应的平衡转化率 B、反应物所含键能总和小于生成物所含键能总和 C、平衡时分离出NH3能增大正反应速率,提高N2转化率 D、增大压强能提高分子活化能,加快反应速率3. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生氢气体积(V)的数据,根据数据绘制如图,则曲线a、b、c、d所对应的实验组别可是( )
组别
温度/℃
状态
①
2.0
25
块状
②
2.5
30
块状
③
2.5
50
粉末状
④
2.5
30
粉末状
A、④③②① B、①②③④ C、③④②① D、①②④③4. 反应 ,达平衡时,要使v(正)降低、 增大,应采取的措施是( )A、降温 B、加催化剂 C、升温 D、加压5. 反应A(g)+3B(g) 4C(g)+2D(g),在不同条件下反应,其平均反应速率v(X)如下,其中反应速率最快的是( )A、v(A)=0.4mol/(L·s) B、v(B)=0.8mol/(L·s) C、v(C)=1.2mol/(L·s) D、v(D)=0.7mol/(L·s)6. 反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1 , 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( ) A、A、C两点的反应速率:A>C B、A、C两点气体的颜色:A浅,C深 C、T1>T2 D、B、C两点气体的平均相对分子质量:B<C7. 对于300mL1mol/L盐酸与铁片的反应,采取下列措施:
A、A、C两点的反应速率:A>C B、A、C两点气体的颜色:A浅,C深 C、T1>T2 D、B、C两点气体的平均相对分子质量:B<C7. 对于300mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度 ②改用100mL 3mol/L盐酸
③再加300mL 1mol/L盐酸 ④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸 其中能使反应速率加快的是( )
A、①②④ B、①③④ C、①②③④ D、①②③⑤8. 对于可逆反应:2A(g)+B(g) 2C(g);△H<0,下列各图中正确的是( )A、 B、
B、 C、
C、 D、
D、 9. 对于反应2SO2(g)+O2(g) 2SO3(g)△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是( )
9. 对于反应2SO2(g)+O2(g) 2SO3(g)△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是( )(t1时刻v正=v逆;t1时改变条件,t2时重新建立平衡)
A、加入催化剂 B、增加SO3浓度
B、增加SO3浓度  C、升高温度
C、升高温度  D、增大压强
D、增大压强  10. 在不同条件下,用 氧化一定浓度 溶液的过程中所测得的实验数据如图所示。下列分析或推测不合理的是( )
10. 在不同条件下,用 氧化一定浓度 溶液的过程中所测得的实验数据如图所示。下列分析或推测不合理的是( ) A、 内, 的氧化率随时间延长而逐渐增大 B、由曲线②和③可知,pH越大, 的氧化速率越快 C、由曲线①和③可知,温度越高, 的氧化速率越快 D、氧化过程的离子方程式为11. 向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是 ( )
A、 内, 的氧化率随时间延长而逐渐增大 B、由曲线②和③可知,pH越大, 的氧化速率越快 C、由曲线①和③可知,温度越高, 的氧化速率越快 D、氧化过程的离子方程式为11. 向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是 ( ) A、若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(L・s) B、t4~t5阶段改变的条件为降低反应温度 C、B的起始的物质的量为0.02mol D、t5~t6阶段可能是增大压强12. 在Zn+H2SO4=ZnSO4+H2反应中,2分钟内硫酸浓度由1.5mol·L-1降至1.1mol·L-1 , 则2分钟内用硫酸表示的平均反应速率为( )A、0.1mol·L-1·min-1 B、0.2mo1·L-1·min-1 C、0.3mol·L-1·min-1 D、0.4mo1·L-1·min-1
A、若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(L・s) B、t4~t5阶段改变的条件为降低反应温度 C、B的起始的物质的量为0.02mol D、t5~t6阶段可能是增大压强12. 在Zn+H2SO4=ZnSO4+H2反应中,2分钟内硫酸浓度由1.5mol·L-1降至1.1mol·L-1 , 则2分钟内用硫酸表示的平均反应速率为( )A、0.1mol·L-1·min-1 B、0.2mo1·L-1·min-1 C、0.3mol·L-1·min-1 D、0.4mo1·L-1·min-1二、综合题
-
13. 据统计,约有90%以上的工业过程中需要使用催化剂,因此,对催化剂的研究已成为重要课题。(1)、I.结合实验与计算机模拟结果,研究了N2与H2在固体催化剂表面合成NH3的反应历程。图示为反应历程中的势能面图(部分数据省略),其中吸附在催化剂表面的物种用*标注。
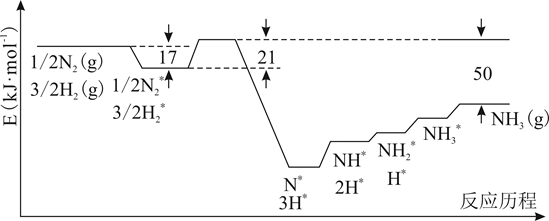
氨气的脱附是(填“吸热”或“放热”)过程,合成氨的热化学方程式为。
(2)、当使用铁催化剂时,合成氨的速率方程式为w = k1•p(N2) -k2 ,其中w为反应的瞬时总速率,等于正反应速率和逆反应速率之差,k1、k2是正、逆反应速率常数,则合成氨反应N2+3H2 2NH3的平衡常数Kp=(用k1、k2表示)。(3)、在使用同一催化剂时,将2.0molN2和6.0molH2 通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化,曲线B表示T1时n(NH3)的变化,T2时反应到a点恰好达到平衡。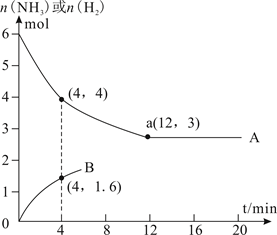
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2 , 试说明理由。
(4)、Ⅱ.用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的过程中,还会生成CH4、C3H6、C4H8等副产物,若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性(选择性指的是转化的CO2中生成C2H4的百分比)。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:助剂
CO2转化率(%)
各产物在所有产物中的占比(%)
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是。
14. I.化学反应速率和化学平衡影响因素较多,经常采用控制变量思想分析问题。某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,进行了如表中的实验:实验
编号
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
0.6mol·L-1H2C2O4溶液
H2O
0.2mol·L-1KMnO4溶液
3mol·L-1稀硫酸
1
3.0
4.0
1.0
2.0
6.4
2
3.0
3.0
2.0
2.0
5.2
3
3.0
2.0
3.0
2.0
4.0
请回答:
(1)、已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理:。(2)、根据表中的实验数据,可以得到的结论是。(3)、利用实验3中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=。(4)、II.研究CO2的综合利用对促进“低碳经济”的发展有重要意义。工业上以CO2、NH3为原料生产尿素[CO(NH2)2],2NH3(g)+CO2(g) H2O(l)+CO(NH2)2(s)ΔH=-178kJ∙mol-1 , T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。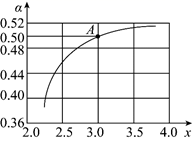
一定能判断该反应达到化学平衡状态的是_______。
A、2v(NH3)正=v(CO2)逆 B、氨气的体积分数不再变化 C、气体的密度不再变化 D、气体的平均摩尔质量不再变化 E、氨气的物质的量浓度不再变化(5)、图中A点NH3的平衡转化率α=%。(6)、当x=1.0时,若起始的压强为p0 kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=(kPa)-3(Kp为以分压表示的平衡常数,分压=总压×体积分数)。15. T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题: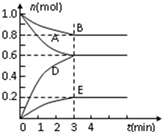 (1)、写出该反应的化学方程式 .(2)、反应开始至3min时,用D表示的平均反应速率为mol/(L•min).(3)、若升高温度,则v(正) , v(逆)(填“加快”或“减慢”)。(4)、若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1 , 乙中v(B)=0.2 mol·L-1·min-1 , 则容器中反应更快。16. 一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行,达平衡后,试回答:(A.变快 B.不变 C变慢,填字母代号)。(1)、增加Fe的物质的量,其正反应速率 , 逆反应速率。(2)、将容器的体积缩小一半,其正反应速率 , 逆反应速率。(3)、若保持体积不变,充入Ar,其逆反应速率 , 逆反应速率。(4)、保持压强不变,充入Ar,其正反应速率 , 逆反应速率。(5)、使用催化剂,其正反应速率 , 逆反应速率。
(1)、写出该反应的化学方程式 .(2)、反应开始至3min时,用D表示的平均反应速率为mol/(L•min).(3)、若升高温度,则v(正) , v(逆)(填“加快”或“减慢”)。(4)、若反应在甲、乙两个相同容器内同时进行,分别测得甲中v(A)=0.3 mol·L-1·min-1 , 乙中v(B)=0.2 mol·L-1·min-1 , 则容器中反应更快。16. 一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行,达平衡后,试回答:(A.变快 B.不变 C变慢,填字母代号)。(1)、增加Fe的物质的量,其正反应速率 , 逆反应速率。(2)、将容器的体积缩小一半,其正反应速率 , 逆反应速率。(3)、若保持体积不变,充入Ar,其逆反应速率 , 逆反应速率。(4)、保持压强不变,充入Ar,其正反应速率 , 逆反应速率。(5)、使用催化剂,其正反应速率 , 逆反应速率。