江苏省徐州市2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2021-04-25 类型:期末考试
一、单选题
-
1. 根据能量变化示意图(如图所示),下列说法错误的是( )
 A、相同质量的 和 ,前者具有的能量较高 B、破坏相同物质的量的 和 中所有的化学键,后者所需的能量高 C、 D、 ,则2. 下列化学用语正确的是( )A、CO2分子的电子式为
A、相同质量的 和 ,前者具有的能量较高 B、破坏相同物质的量的 和 中所有的化学键,后者所需的能量高 C、 D、 ,则2. 下列化学用语正确的是( )A、CO2分子的电子式为 B、基态Cu原子核外电子排布式为1s22s22p63s23p63d94s2
C、Cl-的结构示意图为
B、基态Cu原子核外电子排布式为1s22s22p63s23p63d94s2
C、Cl-的结构示意图为  D、HClO的结构式为H—Cl—O
3. 下列说法正确的是(NA表示阿伏加德罗常数)( )A、反应TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH>0能自发进行,其原因是ΔS>0 B、对反应使用催化剂虽然不能改变转化率,但能够改变反应的焓变 C、除去MgCl2溶液中的少量FeCl3 , 加入足量氢氧化钠,充分反应后,过滤 D、1molCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA4. 下列关于价电子排布式为 的原子的描述正确的是( )A、该原子核外有三种形状不同的电子云 B、该原子核外电子共有16种不同的运动状态 C、该原子形成的单质可与H2反应生成常温下为液态的化合物 D、基态该原子的轨道表示式为
D、HClO的结构式为H—Cl—O
3. 下列说法正确的是(NA表示阿伏加德罗常数)( )A、反应TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH>0能自发进行,其原因是ΔS>0 B、对反应使用催化剂虽然不能改变转化率,但能够改变反应的焓变 C、除去MgCl2溶液中的少量FeCl3 , 加入足量氢氧化钠,充分反应后,过滤 D、1molCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA4. 下列关于价电子排布式为 的原子的描述正确的是( )A、该原子核外有三种形状不同的电子云 B、该原子核外电子共有16种不同的运动状态 C、该原子形成的单质可与H2反应生成常温下为液态的化合物 D、基态该原子的轨道表示式为 5. 下列说法正确的是( )A、在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH‾)相等 B、中和pH和体积均相等的盐酸、CH3COOH溶液,所需NaOH的物质的量相同 C、浓度和体积都相等的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 D、室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO‾)=c(Na+)6. 设 表示阿伏加德罗常数的值。下列说法错误的是( )A、 与 组成的混合物中,含有的电子数目为 B、 (标准状况) 与足量乙烷反应时,断裂的 键数目为 C、 浓度均为 的 、 溶液中, 数目前者比后者多 D、 [电离方程式: ]消耗 数目最多为7. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、 =1012的溶液中:Fe2+、Mg2+、NO 、Cl- B、澄清透明的溶液中:H+、Cu2+、SO 、NO C、0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO D、由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO8. 下列指定反应的离子方程式正确的是( )A、饱和Na2CO3溶液与CaSO4固体反应:CO +CaSO4=CaCO3+SO B、酸化NaIO3和NaI的溶液混合:I-+IO +6H+=I2+3H2O C、KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO +3Cl-+4H++H2O D、电解饱和食盐水:2Cl-+2H+ Cl2↑+H2↑9. 三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
5. 下列说法正确的是( )A、在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH‾)相等 B、中和pH和体积均相等的盐酸、CH3COOH溶液,所需NaOH的物质的量相同 C、浓度和体积都相等的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 D、室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO‾)=c(Na+)6. 设 表示阿伏加德罗常数的值。下列说法错误的是( )A、 与 组成的混合物中,含有的电子数目为 B、 (标准状况) 与足量乙烷反应时,断裂的 键数目为 C、 浓度均为 的 、 溶液中, 数目前者比后者多 D、 [电离方程式: ]消耗 数目最多为7. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、 =1012的溶液中:Fe2+、Mg2+、NO 、Cl- B、澄清透明的溶液中:H+、Cu2+、SO 、NO C、0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO D、由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO8. 下列指定反应的离子方程式正确的是( )A、饱和Na2CO3溶液与CaSO4固体反应:CO +CaSO4=CaCO3+SO B、酸化NaIO3和NaI的溶液混合:I-+IO +6H+=I2+3H2O C、KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO +3Cl-+4H++H2O D、电解饱和食盐水:2Cl-+2H+ Cl2↑+H2↑9. 三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
下列叙述错误的是( )
A、该反应为吸热反应 B、反应速率大小:va >vb C、70 ℃时,平衡常数K =0.112/0.782 D、增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间10. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是( )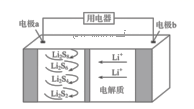 A、电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B、电池充电时间越长,电池中的Li2S2量越多 C、电解质中加入硫酸能增强导电性 D、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g11. 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是 ( )
A、电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B、电池充电时间越长,电池中的Li2S2量越多 C、电解质中加入硫酸能增强导电性 D、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g11. 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是 ( ) A、超氧化钾的化学式为KO2 , 每个晶胞含有4个K+和4个 B、晶体中每个K+周围有8个 ,每个 周围有8个K+ C、晶体中与每个K+距离最近的K+有8个,晶体中与每个 距离最近的 有6个 D、晶体中其中0价氧和-2价氧的物质的量之比为1:112. 常温下,有关物质的溶度积如下,下列有关说法错误的是( )
A、超氧化钾的化学式为KO2 , 每个晶胞含有4个K+和4个 B、晶体中每个K+周围有8个 ,每个 周围有8个K+ C、晶体中与每个K+距离最近的K+有8个,晶体中与每个 距离最近的 有6个 D、晶体中其中0价氧和-2价氧的物质的量之比为1:112. 常温下,有关物质的溶度积如下,下列有关说法错误的是( )物质
CaCO3
MgCO3
Ca(OH)2
Mg(OH)2
Fe(OH)3
Ksp
4.96×10-9
6.82×10-6
4.68×10-6
5.60×10-12
2.80×10-39
A、常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 B、常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 C、向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21 D、将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液二、多选题
-
13. 下列判断正确的是( )
 A、图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线 B、图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线 C、高温下能自发进行的反应CO2(g)+H2(g) CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0 D、图4可表示反应N2(g)+3H2(g) 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线14. 分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所
A、图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线 B、图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线 C、高温下能自发进行的反应CO2(g)+H2(g) CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0 D、图4可表示反应N2(g)+3H2(g) 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线14. 分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所
下列说法错误的是( )
A、25℃时,NH3·H2O NH4++OH-的lgK=-4.7 B、25℃时,0.01mol·L-1HCOOH溶液的pH为3.7 C、HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-) D、HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)15. 初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1 , 测得反应的相关数据如下:容器
容器类型
初始体积
初始压强/Pa
反应物投入量/mol
平衡时Cl2的物质的量/mol
HCl
O2
Cl2
H2O
I
恒温恒容
1L
4
1
0
0
1
II
绝热恒容
1L
p2
0
0
2
2
a
III
恒温恒压
2L
p3
8
2
0
0
b
下列说法正确的是( )
A、反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1 B、a>1, b>2 C、p2=1.6×105Pa,p3=4×105Pa D、若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行三、综合题
-
16. 原子序数依次增大的A、B、C、D、E、F、G七种元素。其中A的原子有5种不同运动状态的电子;B的基态原子有3个不同的能级,各能级中的电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;E为它所在周期中原子半径最大的主族元素;F和D位于同一主族,G的原子序数为29。(1)、基态G原子的价电子排布式为。(2)、元素B、C的简单气态氢化物的沸点较高的是 (用化学式表示)。(3)、A晶体熔点为2300℃,则其为晶体。(4)、GD在加热条件下容易转化为G2D,从原子结构的角度解释原因。(5)、G与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸盐,为将生成的两种气体(气体相对分子质量均小于50)完全转化为最高价含氧酸盐,消耗了1molO2和1L2.2mol/LNaOH溶液。则两种气体的分子式及物质的量分别为 , 生成硫酸铜物质的量为。17. 25℃时,三种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K14.3×10-7
K25.6×10-11
3.0×10-8
回答下列问题:
(1)、一般情况下,当温度升高时,Ka(填“增大”、“减小”或“不变”)。(2)、下列四种离子结合质子能力由大到小的顺序是 (填序号);a.CO b.ClO-c.CH3COO-d.HCO
(3)、下列反应不能发生的是 (填序号)a.CO +CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO +2HClO
(4)、体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
则HX的电离平衡常数 (填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)醋酸溶液中水电离出来的c(H+),理由是。
18. 常温下,用含钴废料(主要成分为CoCO3 , 还含有少量NiCO3与铁屑)制备CoCl2•6H2O的工艺流程如图。
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。

②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子
开始沉淀pH
完全沉淀pH
Fe3+
1.5
4.0
Fe2+
7.5
9.7
Co2+
6.6
9.4
Ni2+
7.7
9.5
回答下列问题:
(1)、酸浸后溶液中的阳离子为:Co2+ , Ni2+和。(2)、除镍时,应调节溶液pH= , 此时Ni2+是否形成Ni(OH)2沉淀?(是或否)。若pH过小,则产品纯度会(升高,降低,或不变)。(3)、酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=。已知Ksp[Co(OH)2]=2.0×10-16 , Ksp[Fe(OH)3]=4.0×10-38。
(4)、除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:。充分反应后再向溶液中加入CoCO3 , 调节溶液pH范围为 , 使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。(5)、已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl2•6H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3 , (杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3 , 该标定操作所用的指示剂为 (填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl2•6H2O的质量分数为。19. 海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。(1)、①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法错误的是(填字母序号)。
a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是。
(2)、海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2 , 该过程的离子方程式是。
(3)、洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2 , 是一种处理的有效方式。①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是。
②上述方式使处理后海水pH升高的原因是。
20. 锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。(1)、锂硒电池具有优异的循环稳定性。①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:。充电时Li+向(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是。
 (2)、Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
(2)、Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=
 ×100%)分析300 ℃后,固体残留率变化的原因是。
×100%)分析300 ℃后,固体残留率变化的原因是。