备考2021年高考化学二轮专题 第9讲 物质的结构与性质
试卷更新日期:2021-04-23 类型:二轮复习
一、单选题
-
1. 下列说法或表达方式中错误的是( )A、电子从激发态到基态产生的光谱是发射光谱 B、第三、第四周期同主族元素的原子序数均相差8 C、 、 、 分子中中心原子孤电子对数最多的是 D、基态氯原子的价电子轨道表示式为
 2. 下列化学用语表示正确的是( )A、Ca2+的结构示意图:
2. 下列化学用语表示正确的是( )A、Ca2+的结构示意图: B、基态碳原子的轨道表示式:
B、基态碳原子的轨道表示式:  C、水的电子式: H+
C、水的电子式: H+  H+
D、基态铬原子(24Cr)的价层电子排布式:3d54s1
3. 短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:
H+
D、基态铬原子(24Cr)的价层电子排布式:3d54s1
3. 短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示:
且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是( )
A、YW3分子中的键角为120° B、W2Z的稳定性大于YW3 C、物质甲分子中存在6个σ键 D、Y元素的氧化物对应的水化物为强酸4. 下列各组物质中,化学键类型相同、固体熔化时破坏的作用力也相同的是( )A、Na2O、Na2O2 B、MgCl2、AlCl3 C、CO2、SiO2 D、CO2、H2O5. 下列关于物质结构与性质的说法,错误的是( )A、I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形 B、C,H,O三种元素的电负性由小到大的顺序为H<C<O C、水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S D、第四周期元素中,Ga的第一电离能低于Zn6. 下列说法正确的是( )A、冰熔化时,分子中化学键发生断裂 B、HF、HCl、HBr、HI的热稳定性依次减弱与氢键无关 C、非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 D、NaCl、HCl两种物质在水溶液中都能电离出两种离子,所以都属于离子化合物7. 下列叙述正确的是( )A、金属晶体的一个晶胞中所含的原子数:钾型=镁型<铜型 B、在卤族元素(F、Cl、Br、I)的氢化物中,HF的沸点最低 C、CaH2、Na2O2晶体的阴、阳离子个数比分别为2∶1、1∶1 D、晶体熔点:金刚石>食盐>干冰>冰8. 利用超分子可分离C60和C70.将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是( )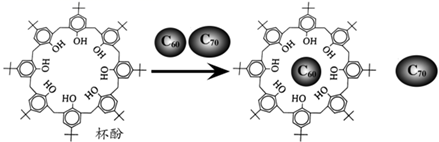 A、第一电离能:C<O B、杯酚分子中存在大π键 C、杯酚与C60形成氢键 D、C60与金刚石晶体类型不同
A、第一电离能:C<O B、杯酚分子中存在大π键 C、杯酚与C60形成氢键 D、C60与金刚石晶体类型不同二、填空题
-
9. 有下列七种物质:A、干冰 B、氧化镁 C、氯化铵 D、固态碘 E、烧碱 F、冰 G、过氧化钾(1)、熔化时需要破坏共价键和离子键的是(填序号,下同);(2)、既有离子键又有共价键的是;(3)、只含有极性键的是;(4)、含非极性键的是。10. 如下图所示,现有甲、乙、丙三种晶体的晶胞:甲中X处于晶胞的中心,乙中A处于晶胞的中心,可推知:甲晶体中X与Y的个数比是 , 乙中A与B的个数比是 , 丙晶胞中有个C离子,有个D离子。
 11.(1)、氯化钠的熔点(804℃)低于氟化钠的熔点(933℃)的主要原因是。(2)、CaCl2O是离子化合物,各原子均满足8电子稳定结构,CaCl2O的电子式是。(3)、热胀冷缩是自然界的普遍现象,但当温度由0℃上升至4℃时,水的密度却增大,主要原因是。
11.(1)、氯化钠的熔点(804℃)低于氟化钠的熔点(933℃)的主要原因是。(2)、CaCl2O是离子化合物,各原子均满足8电子稳定结构,CaCl2O的电子式是。(3)、热胀冷缩是自然界的普遍现象,但当温度由0℃上升至4℃时,水的密度却增大,主要原因是。三、综合题
-
12. 硼氢化钠(NaBH4)是一种储氢密度较高、价格低廉、兼具安全性与稳定性的固态储氢材料。(1)、基态B原子中电子占据最高能级的符号是 , 占据该能级电子的电子云轮廓图为形。基态B原子中,核外存在对自旋相反的电子。(2)、在周期表中,与B元素的化学性质最相似的邻族元素是。(3)、将物质的量之比为3∶1的NaBH4固体和ScF3固体混合研磨,得到的复合储氢体系可以显著降低放氢温度。基态21Sc原子的简化电子排布式为。13. 氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2 2NH3 , 2NH3+CO2 H2NCONH2+H2O
回答下列问题:
(1)、纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为 , Zn位于元素周期表的区。(2)、C、N、O三种元素第一电离能从大到小的顺序是。(3)、上述化学方程式中的NH3和CO2的沸点大小是 ,原因。(4)、尿素分子中,原子杂化轨道类型有 , σ键与π键数目之比为。(5)、氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0, 0, 0),D为( , , 0),则E原子的坐标参数为 。X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体中N与B的原子半径之和为pm。( =1.732)
14. 海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。(1)、写出基态溴原子的价电子排布式 , 氟、氯、溴、氧四种元素中,电负性由大到小的顺序为(填元素符号) 。(2)、Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1 , 二者相差很大的原因是。(3)、X射线衍射测定等发现,I3AsF6 中存在I 离子。I 离子的几何构型为 , 中心原子的杂化类型为。(4)、C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。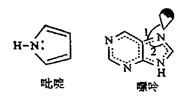
①1mol吡啶分子中含有σ键数目是NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为。
(5)、CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示: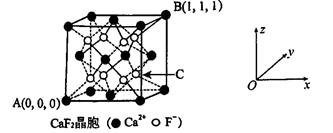
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为( , , )
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA , 则其密度为g•cm-3 (列出计算式即可) 。
15.(1)、用高压釜施加高温高压并加入金属镍等催化剂,可实现如图所示的石墨转化为物质B的过程,据此回答下列问题:石墨烯晶体


① 基态碳原子的价电子电子排布图是 , 其核外电子占据最高能级的电子云轮廓图为形。
② 熔点:石墨物质B(填“<”或“=”或“>”),物质B中碳原子的杂化方式是。
③ 在石墨烯和B的晶体中,都含有最小的六元碳环。其中在B的晶体中,每个C原子连接个六元环;质量相同的石墨烯和晶体B,含有的六元环数目之比为。
(2)、已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如右图所示),其中含有二十个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子。
若将晶体硼结构单元中的每一个顶角都削去,余下的部分和C60晶体的结构相同,则C60是由个正六边形和个正五边形构成。
(3)、石墨烯与金属M可以形成一种插层化合物。其中M层平行于石墨层(晶胞如下图甲所示),其垂直于石墨层方向的投影如下图乙所示,则该插层化合物的化学式为;石墨烯中相邻碳原子紧密接触,若碳原子半径为r pm,则石墨烯同层最邻近的两个M原子之间的距离为pm。(用含r的最简单代数式表示。) (4)、物质B的晶胞如上图丙所示。已知碳原子半径为a nm,则其晶体密度是g· cm-3。
(4)、物质B的晶胞如上图丙所示。已知碳原子半径为a nm,则其晶体密度是g· cm-3。(只要求列含a的表达式,阿伏加德罗常数用NA表示)。