备考2021年高考化学二轮专题 第8讲 电化学原理及应用
试卷更新日期:2021-04-23 类型:二轮复习
一、单选题
-
1. 如图所示,电流计G发生偏转,同时A极逐渐变细,B极逐渐变粗,C为电解质溶液,则A、B、C应是下列各组中的( )
 A、A是Zn、B是Cu、C为稀硫酸 B、A是Cu、B是Zn、C为稀硫酸 C、A是Fe、B是Ag、C为AgNO3溶液 D、A是Ag、B是Fe、C为AgNO3溶液2. 下列各图所示装置能达到实验目的的是( )
A、A是Zn、B是Cu、C为稀硫酸 B、A是Cu、B是Zn、C为稀硫酸 C、A是Fe、B是Ag、C为AgNO3溶液 D、A是Ag、B是Fe、C为AgNO3溶液2. 下列各图所示装置能达到实验目的的是( )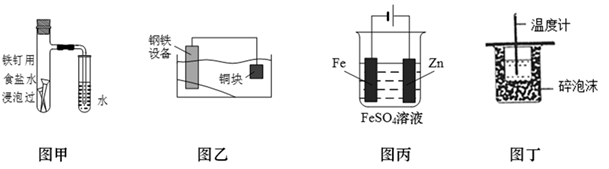 A、图甲,验证铁的吸氧腐蚀 B、图乙,保护水体中的钢铁设备 C、图丙,在铁制品表面镀锌 D、图丁,测定中和热3. 利用下图装置可以模拟铁的电化学防护。下列说法错误的是( )
A、图甲,验证铁的吸氧腐蚀 B、图乙,保护水体中的钢铁设备 C、图丙,在铁制品表面镀锌 D、图丁,测定中和热3. 利用下图装置可以模拟铁的电化学防护。下列说法错误的是( ) A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,铁极发生氧化反应 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,X极发生氧化反应4. 一种微生物电池处理含氮( )废水的装置如下图所示。下列说法正确的是( )
A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀 B、若X为锌棒,开关K置于M处,铁极发生氧化反应 C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀 D、若X为碳棒,开关K置于N处,X极发生氧化反应4. 一种微生物电池处理含氮( )废水的装置如下图所示。下列说法正确的是( ) A、电池放电时将电能转化为化学能 B、放电时,电极B附近溶液的pH降低 C、放电时的负极反应为:C6H12O6-24e-+6H2O=6CO2↑+24H+ D、理论上,电极A每消耗1mol C6H12O6 , 电极B处生成1mol N25. 下列电化学装置能达到目的的是( )
A、电池放电时将电能转化为化学能 B、放电时,电极B附近溶液的pH降低 C、放电时的负极反应为:C6H12O6-24e-+6H2O=6CO2↑+24H+ D、理论上,电极A每消耗1mol C6H12O6 , 电极B处生成1mol N25. 下列电化学装置能达到目的的是( ) A、图甲:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+ B、图乙:制取少量Fe(OH)2 C、图丙:证明铁发生了析氢腐蚀 D、图丁:在铁表面镀锌6. 一种Na-CO2二次电池装置如图所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na 2Na2CO3+C。下列说法正确的是( )
A、图甲:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+ B、图乙:制取少量Fe(OH)2 C、图丙:证明铁发生了析氢腐蚀 D、图丁:在铁表面镀锌6. 一种Na-CO2二次电池装置如图所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na 2Na2CO3+C。下列说法正确的是( ) A、放电时Na电极为正极 B、充电时电解液中的Na+移向阳极 C、放电时每反应1mol CO2 , 电路中转移4 mol电子 D、充电时的阳极反应为2CO +C-4e−=3CO27. 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法错误的是( )
A、放电时Na电极为正极 B、充电时电解液中的Na+移向阳极 C、放电时每反应1mol CO2 , 电路中转移4 mol电子 D、充电时的阳极反应为2CO +C-4e−=3CO27. 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法错误的是( ) A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 B、若水膜中溶解了SO2 , 则铁铆钉腐蚀的速率变小 C、铜极上的反应是2H++2e− =H2↑、O2+4e−+4H+=2H2O D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀8. 海水中锂资源非常丰富,但是海水中的锂浓度低,很难被提取出来。我国科学家设计了一种太阳能驱动下,利用选择性固体陶瓷膜电解海水提取金属锂的装置(示意图如下),该装置工作时,下列说法错误的是( )
A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 B、若水膜中溶解了SO2 , 则铁铆钉腐蚀的速率变小 C、铜极上的反应是2H++2e− =H2↑、O2+4e−+4H+=2H2O D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀8. 海水中锂资源非常丰富,但是海水中的锂浓度低,很难被提取出来。我国科学家设计了一种太阳能驱动下,利用选择性固体陶瓷膜电解海水提取金属锂的装置(示意图如下),该装置工作时,下列说法错误的是( )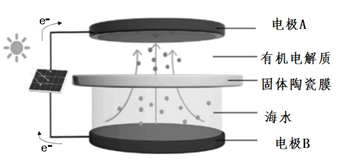 A、该装置主要涉及的能量变化:太阳能→电能→化学能 B、电极B上的电极反应式:4OH−-4e−=O2↑+2H2O C、选择性固体陶瓷膜不允许H2O通过 D、工作时,电极A为阴极9. 某锂铜二次电池工作质理如图所示。在该电池中,水系电解液和非水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列有关说法错误的是( )
A、该装置主要涉及的能量变化:太阳能→电能→化学能 B、电极B上的电极反应式:4OH−-4e−=O2↑+2H2O C、选择性固体陶瓷膜不允许H2O通过 D、工作时,电极A为阴极9. 某锂铜二次电池工作质理如图所示。在该电池中,水系电解液和非水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列有关说法错误的是( )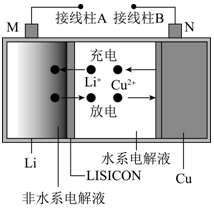 A、放电时,N极电极反应式为Cu2++2e -=Cu B、Li+可以通过陶瓷片,水分子不能 C、充电时,接线柱B应与电源的负极相连 D、充电时,M电极发生还原反应10. 常温下用石墨作电极,电解100 mL 0.1 mol·L-1的Cu(NO3)2和0.1 mol·L-1的AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L 时,假设溶液体积不变,下列说法正确的是( )A、阴极增重1.4 g B、所得溶液pH<1 C、阴极增重0.64 g D、所得溶液pH>111. 如下图所示,某同学设计了一个燃料电池并探究铜的精炼原理和电镀原理。下列说法正确的是( )
A、放电时,N极电极反应式为Cu2++2e -=Cu B、Li+可以通过陶瓷片,水分子不能 C、充电时,接线柱B应与电源的负极相连 D、充电时,M电极发生还原反应10. 常温下用石墨作电极,电解100 mL 0.1 mol·L-1的Cu(NO3)2和0.1 mol·L-1的AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L 时,假设溶液体积不变,下列说法正确的是( )A、阴极增重1.4 g B、所得溶液pH<1 C、阴极增重0.64 g D、所得溶液pH>111. 如下图所示,某同学设计了一个燃料电池并探究铜的精炼原理和电镀原理。下列说法正确的是( )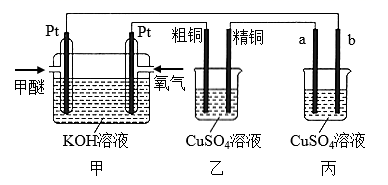 A、一段时间后,甲装置中溶液 pH升高 B、电解一段时间后,乙、丙装置中 CuSO4溶液的浓度均不变 C、通入氧气的一极为正极,发生的电极反应为 D、丙装置中实现铁片上镀铜,b 应为铁片12. 为探究海水对钢铁的腐蚀,某兴趣小组设计了如下五种装置,铁片在这五种装置中的腐蚀速率由慢到快的顺序为( )
A、一段时间后,甲装置中溶液 pH升高 B、电解一段时间后,乙、丙装置中 CuSO4溶液的浓度均不变 C、通入氧气的一极为正极,发生的电极反应为 D、丙装置中实现铁片上镀铜,b 应为铁片12. 为探究海水对钢铁的腐蚀,某兴趣小组设计了如下五种装置,铁片在这五种装置中的腐蚀速率由慢到快的顺序为( ) A、①⑤④③② B、③①②④⑤ C、④③①⑤② D、④⑤②①③
A、①⑤④③② B、③①②④⑤ C、④③①⑤② D、④⑤②①③二、综合题
-
13. 短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:(所有答案都用相应的元素符号作答)(1)、化学组成为AFD的结构式为 , A、C、F三种元素形成的化合物CA4F为化合物(填“离子”或“共价”)。(2)、化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为。(3)、由D、E形成的简单离子的离子半径由大到小的顺序是。(4)、元素B和C的非金属性强弱,B的非金属性于C(填“强”或“弱”),并用化学方程式证明上述结论。(5)、以CA3代替氢气研发燃料电池是当前科研的一个热点。CA3燃料电池使用的电解质溶液是2 mol•L-1的KOH溶液,电池反应为:4CA3+3O2=2C2+6H2O。该电池负极的电极反应式为;每消耗3.4gCA3转移的电子数目为。14. 装置甲、乙、丙的烧杯中都盛有稀硫酸。(1)、装置丙中 电极上的电极反应式为。(2)、装置乙中被腐蚀的金属是(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是。
 (3)、图丁是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
(3)、图丁是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化学腐蚀的类型为腐蚀。
②图中A、B、C三处附近的区域内,腐蚀最严重的是(填序号)。
15. 金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题: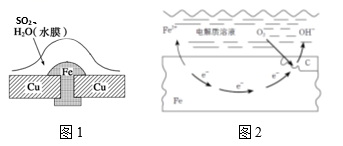 (1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。
(1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)、图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理。(3)、图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 , 负极反应为 , 总反应为。(4)、下列防止铁制品生锈的措施合理的是__________。A、在铁闸门表面涂油漆 B、在地下铁管道上安装若干镁合金 C、将铁罐与浓硫酸等强氧化剂接触,使之发生钝化16. 工业上用锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如图: 已知:生成氢氧化物沉淀的pH如表所示:
已知:生成氢氧化物沉淀的pH如表所示:Mn(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
开始沉淀时
8.3
6.3
2.7
4.7
完全沉淀时
9.8
8.3
3.7
6.7
注:金属离子的起始浓度为0.1mol/L,回答下列问题:
(1)、含杂质的菱锰矿使用前需将其粉碎,主要目的是 , 盐酸溶解MnCO3的化学方程式是。(2)、向溶液1中加入双氧水时,反应的离子方程式是。(3)、滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+ , 反应的离子方程式是。(4)、将MnCl2转化为MnO2的另一种方法是电解法。①阳极生成MnO2的电极反应式是。
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2 , 检验Cl2的操作是。
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是。
17.(1)、某甲醇 空气燃料电池的工作原理如图1所示 ( 箭头丧示物质的进入或排出 ) :
①甲电极为该燃料电池的 选填“正极”或“负极” ,该电极的电极反应方程式为 。
②用该电池作供电电源,用情性电极电解足量的 溶液,若阴极增重 ,则理论上消耗甲醇 g。
(2)、尿素树脂生产过程中所排放的废水中往在含有甲醇,这种含甲醇的废水会对环境造成污染。向该废水中加入一定量的酸性 溶液,然后采用图2所示装贸进行电解即可除去甲醇,除甲醇的原理:电解产物 将废水中的甲醇氧化为 。①阳极反应式为 。
②请用离子方程式表示该法除甲醇的原理为 。
③排放该电解后的废水的铁质管道易被腐蚀,除与 发生置换反应外,还发生电化学腐蚀,发生还原反应的电极反应式为 。