备考2021年高考化学二轮专题 第7讲 电解质溶液
试卷更新日期:2021-04-23 类型:二轮复习
一、单选题
-
1. 用0.1000 mol·L-1 NaOH标准溶液滴定25.00mL未知浓度的盐酸,下列说法正确的是( )
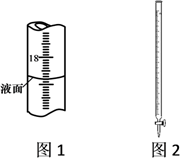 A、NaOH标准溶液应装在如图2所示的滴定管中 B、滴定时NaOH的滴速应保持匀速,并不停摇动锥形瓶 C、图1所示液体的体积读数为18.20mL D、若滴定前滴定管尖嘴有气泡,滴定终了气泡消失,则所测盐酸的浓度偏大2. 向水中加入下列溶质,能促进水电离的是( )A、H2SO4 B、NaOH C、NaCl D、NH4Cl3. 时,用 二元弱酸 溶液滴定 溶液所得滴定曲线如图。下列说法错误的是
A、NaOH标准溶液应装在如图2所示的滴定管中 B、滴定时NaOH的滴速应保持匀速,并不停摇动锥形瓶 C、图1所示液体的体积读数为18.20mL D、若滴定前滴定管尖嘴有气泡,滴定终了气泡消失,则所测盐酸的浓度偏大2. 向水中加入下列溶质,能促进水电离的是( )A、H2SO4 B、NaOH C、NaCl D、NH4Cl3. 时,用 二元弱酸 溶液滴定 溶液所得滴定曲线如图。下列说法错误的是 A、点 所示溶液中: B、点 所示溶液中: C、点 所示溶液中: D、滴定过程中可能出现:4. 一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( )
A、点 所示溶液中: B、点 所示溶液中: C、点 所示溶液中: D、滴定过程中可能出现:4. 一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( ) A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10-13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化5. 下列说法正确的是( )A、CO(g)+3H2(g)=CH4(g)+H2O(g)在一定条件下能自发进行,则该反应的ΔH>0 B、向Na2CO3溶液中加入少量CaCl2固体,溶液的pH增大 C、常温下,向0.1mol·L-1的CH3COONa溶液中加入少量水, 增大 D、常温下pH=5的NH4Cl中,由水电离出的c(H+)=10-9 mol·L-16. 常温下,部分弱酸的电离平衡常数如下表所示。下列说法正确的是( )
A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10-13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化5. 下列说法正确的是( )A、CO(g)+3H2(g)=CH4(g)+H2O(g)在一定条件下能自发进行,则该反应的ΔH>0 B、向Na2CO3溶液中加入少量CaCl2固体,溶液的pH增大 C、常温下,向0.1mol·L-1的CH3COONa溶液中加入少量水, 增大 D、常温下pH=5的NH4Cl中,由水电离出的c(H+)=10-9 mol·L-16. 常温下,部分弱酸的电离平衡常数如下表所示。下列说法正确的是( )弱酸
HCOOH
HCN
电离平衡常数
Ka=1.77×10-4
Ka=5×10-10
A、0.1 mol·L-1的NaCN溶液:c(Na+)>c(HCN)>c(CN-)>c(H+) B、pH=8的HCOONa溶液:c(Na+)-c(HCOO-)=9.9×10-7 mol·L-1 C、0.1 mol·L-1 HCOONa溶液甲和0.1 mol·L-1 NaCN溶液乙:c(H+)甲<c(H+)乙 D、0.1 mol·L-1 NaCN溶液和0.1 mol·L-1的HCOONa溶液等体积混合:2c(Na+)=c(CN-)+c(HCOO-)7. 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是( ) A、B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) B、A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L C、C点水电离的c(OH-)大于A点水电离的c(OH-) D、A,B,C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-148. 在一定温度下将适量AgBr固体加入水中,存在平衡: 。则下列说法正确的是( )A、向此体系中滴加足量浓NaCl溶液,发现淡黄色固体转化为白色,说明Ksp(AgCl)<Ksp(AgBr) B、向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)均增大 C、此体系中一定存在 D、某溶液中 ,说明此时
A、B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) B、A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L C、C点水电离的c(OH-)大于A点水电离的c(OH-) D、A,B,C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-148. 在一定温度下将适量AgBr固体加入水中,存在平衡: 。则下列说法正确的是( )A、向此体系中滴加足量浓NaCl溶液,发现淡黄色固体转化为白色,说明Ksp(AgCl)<Ksp(AgBr) B、向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)均增大 C、此体系中一定存在 D、某溶液中 ,说明此时二、填空题
-
9. 设水的电离平衡线如图所示。
 (1)、若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到;(2)、将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为。10. 已知在氨水中存在下列平衡:NH3+H2O NH3•H2O NH +OH-。(1)、向氨水中加入MgCl2固体时,平衡向移动,OH-离子的浓度 , NH 离子的浓度;(2)、向氨水中加入浓盐酸,平衡向移动,此时溶液中浓度减小的微粒有、、;(3)、向浓氨水中加入少量的NaOH固体,平衡向移动,此时发生的现象是。11. 常温下,用0.100 0 mol·L−1的 NaOH溶液滴定20.00 mL 0.1000 mol·L−1 的某酸HA溶液所得滴定曲线如图所示。
(1)、若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到;(2)、将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为。10. 已知在氨水中存在下列平衡:NH3+H2O NH3•H2O NH +OH-。(1)、向氨水中加入MgCl2固体时,平衡向移动,OH-离子的浓度 , NH 离子的浓度;(2)、向氨水中加入浓盐酸,平衡向移动,此时溶液中浓度减小的微粒有、、;(3)、向浓氨水中加入少量的NaOH固体,平衡向移动,此时发生的现象是。11. 常温下,用0.100 0 mol·L−1的 NaOH溶液滴定20.00 mL 0.1000 mol·L−1 的某酸HA溶液所得滴定曲线如图所示。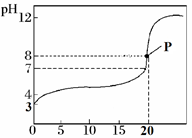

回答下列问题:
(1)、该酸为酸(填“强”或者“弱”),你的判断理由是。(2)、点P时溶液中的 c(HA)=mol·L−1。(3)、①该中和滴定应选择做指示剂,滴定终点时的现象是。指示剂变色范围(pH)
甲基橙(3.1~4.4)
石蕊(5~8)
酚酞(8.2~10.0)
颜色
<3.1
3.1~4.4
>4.4
<5
5~8
>8
<8.2
8.2~10.0
>10.0
红
橙
黄
红
紫
蓝
无色
粉红
红
②滴定起始和终点的液面位置如图2所示,则消耗NaOH溶液的体积为mL。
③下列操作使滴定结果偏高的是。
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视
三、综合题
-
12. 25℃时,电离平衡常数:
化学式
HClO
电离平衡常数
回答下列问题:
(1)、在一条件下, 溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+ ∆H>0,下列方法中,可以使 溶液中 电离程度增大的是 _______ 。A、加入少量 的稀盐酸 B、加热 C、加水稀释至 D、加入少量冰醋酸(2)、等pH的 、NaClO、 、 ,溶质物质的量浓度由大到小的顺序是 。(3)、常温下 的 溶液加水稀释过程,下列表达式的数据一定变小的是: _______ 。A、 B、 C、 D、(4)、体积为10mL、 的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。则HX的电离平衡常数 填“大于”、“等于”或“小于”,下同 醋酸的平衡常数;稀释后,HX溶液中水电离出来的 醋酸溶液水电离出来 。 (5)、25℃时, 与 的混合溶液,若测得混合液 ,则溶液中 。 填准确数值(6)、已知: ,且 的NaHA溶液的 ,则 的 溶液中 填“ ”“ ”或“ ” ,理由是 。13. 某同学为探究Kw的影响因素,做了如下探究。(1)、查阅资料,不同温度下水的离子积常数。
(5)、25℃时, 与 的混合溶液,若测得混合液 ,则溶液中 。 填准确数值(6)、已知: ,且 的NaHA溶液的 ,则 的 溶液中 填“ ”“ ”或“ ” ,理由是 。13. 某同学为探究Kw的影响因素,做了如下探究。(1)、查阅资料,不同温度下水的离子积常数。t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.134
0.292
0.681
1.01
2.92
5.47
38.0
55.0
由此推出:随着温度的升高,Kw的值;水的电离程度;水的电离平衡向移动,水的电离过程是过程。
(2)、取三只烧杯A、B、C,分别加入适量水,再向B、C烧杯中分别加入适量盐酸和NaOH,分析并填写下表:纯水
加少量盐酸
加少量NaOH
c(H+)
1.0×10-7 mol·L-1
增大
c(OH-)
1.0×10-7 mol·L-1
增大
c(H+)和c(OH-)大小比较
c(H+)=c(OH-)
c(H+)c(OH-)
c(H+) c(OH-)
水的电离平衡移动方向
Kw值
1.0×10-14
综上所述,可得出如下结论:
①温度、均能影响水的电离平衡。
②Kw只受的影响,而与其他因素无关。
14. 氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如图:
已知:①菱锰矿石主要成分是 MnCO3 , 还含有少量 Fe、Al、Ca、Mg 等元素;
②相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的 pH 如表:
金属离子
Al3+
Fe3+
Fe2+
Ca2+
Mn2+
Mg2+
开始沉淀的 pH
3.8
1.5
6.3
10.6
8.8
9.6
沉淀完全的 pH
5.2
2.8
8.3
12.6
10.8
11.6
回答下列问题:
(1)、“焙烧”时主要反应的化学方程式为。(2)、分析下列图1、图 2、图 3,氯化铵焙烧菱镁矿的最佳条件是:。 (3)、浸出 液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为 Fe3+ , 反应的离子方程式为;然后调节溶液 pH使 Fe3+、Al3+沉淀完全。(4)、碳化结晶时,发生反应的离子方程式为 Mn2++2HCO MnCO3+CO2↑+H2O,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是。(5)、流程中能循环利用的固态物质是。15. 钼酸钠晶体(Na2MoO4·2H2O) 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是MoS2 , 含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:
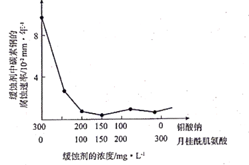
(3)、浸出 液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为 Fe3+ , 反应的离子方程式为;然后调节溶液 pH使 Fe3+、Al3+沉淀完全。(4)、碳化结晶时,发生反应的离子方程式为 Mn2++2HCO MnCO3+CO2↑+H2O,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是。(5)、流程中能循环利用的固态物质是。15. 钼酸钠晶体(Na2MoO4·2H2O) 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是MoS2 , 含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题: (1)、为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。(2)、“浸取"时产生的气体A是。(3)、若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。(4)、“结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。(5)、重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。(6)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。
(1)、为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。(2)、“浸取"时产生的气体A是。(3)、若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。(4)、“结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。(5)、重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。(6)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。