湖北省武汉市江夏2020年中考化学二模试卷
试卷更新日期:2021-04-20 类型:中考模拟
一、单选题
-
1. 下列物质属于纯净物的是( )A、生理盐水 B、白醋 C、医用酒精 D、冰水混合物2. 下列图示的实验操作中正确的是()A、
 点燃酒精灯
B、
点燃酒精灯
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 测溶液的pH
D、
测溶液的pH
D、 制取氧气
3. 化学与人类健康密切相关,下列做法合理的是 ( )A、霉变大米煮熟后食用 B、食用加铁酱油可预防缺铁性贫血 C、用亚硝酸钠腌制咸菜 D、甲醛溶液浸泡海产品保鲜4. 丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如下。下列说法正确的是()
制取氧气
3. 化学与人类健康密切相关,下列做法合理的是 ( )A、霉变大米煮熟后食用 B、食用加铁酱油可预防缺铁性贫血 C、用亚硝酸钠腌制咸菜 D、甲醛溶液浸泡海产品保鲜4. 丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如下。下列说法正确的是() A、甲中碳、氢元素质量比为3:8 B、乙和丙的元素组成相同 C、44g甲完全燃烧至少需160g乙 D、生成的丙与丁的分子个数比为1:15. 如图为一氧化碳还原氧化铁实验。下列说法中正确的是()
A、甲中碳、氢元素质量比为3:8 B、乙和丙的元素组成相同 C、44g甲完全燃烧至少需160g乙 D、生成的丙与丁的分子个数比为1:15. 如图为一氧化碳还原氧化铁实验。下列说法中正确的是()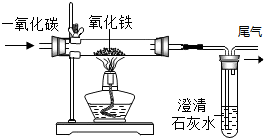 A、开始时应先预热玻璃管,后通入一氧化碳 B、实验中玻璃管里粉末由黑色逐渐变成红粽色 C、参加反应的氧化铁和一氧化碳质量比为40:7 D、将尾气点燃或收集,可防止一氧化碳污染空气6. 向一定质量的CuSO4溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势,如图所示,下列有关说法错误的是( )
A、开始时应先预热玻璃管,后通入一氧化碳 B、实验中玻璃管里粉末由黑色逐渐变成红粽色 C、参加反应的氧化铁和一氧化碳质量比为40:7 D、将尾气点燃或收集,可防止一氧化碳污染空气6. 向一定质量的CuSO4溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势,如图所示,下列有关说法错误的是( ) A、b点时所加试剂一定是稀盐酸 B、加入试剂总体极为V1时,溶液中不存在NaOH C、c点时溶液中的溶质都是盐 D、a点时溶液中一定不存在Cu2+7. 甲、乙、丙、丁四种物质的相互反应关系如图所示(“—”表示相连的物质间能发生反应) 下列符合对应反应关系的选项是( )
A、b点时所加试剂一定是稀盐酸 B、加入试剂总体极为V1时,溶液中不存在NaOH C、c点时溶液中的溶质都是盐 D、a点时溶液中一定不存在Cu2+7. 甲、乙、丙、丁四种物质的相互反应关系如图所示(“—”表示相连的物质间能发生反应) 下列符合对应反应关系的选项是( )
选项
A
B
C
D
物质
甲
Fe
CO2
H2
Ca(OH)2
乙
HCl
NaOH
O2
Na2CO3
丙
CuSO4
MgCl2
CuO
H2SO4
丁
NaOH
AgNO3
HCl
BaCl2
A、A B、B C、C D、D8. 某固体样品含有木炭、氧化铜、氧化铁、碳酸钙中的一种或几种,为了探究其成分,化学兴趣小组进行如图所示的实验,部分生成物省略,每一步都恰好完全反应,且已知气体 B 具有可燃性。
关于该实验的下列说法:( )
①原固体样品中肯定含有木炭和氧化铁
②原固体样品中肯定含有木炭和氧化铁、碳酸钙
③步骤Ⅳ中操作 X 是过滤
④溶液C中的溶质最多有3种
A、①②③ B、②③④ C、①②④ D、①③④二、填空题
-
9. 亮亮做家务时接触到下列用品。
用品
脱氧剂
洁厕灵
炉灶清洁剂
有效成分
还原铁粉
盐酸
氢氧化钠
(1)、他清理垃圾时发现一袋脱氧剂, 拆开后看到还原铁粉已生锈,铁生锈的原因是。(2)、他选用洁厕灵清除铁锈( 铁锈主要成分是氧化铁), 用化学方程式表示其原理。(3)、他清洗炉灶时戴上橡胶手套, 以防清洁剂与皮肤直接接触, 其原因是。(4)、做完家务,他用 Vc 泡腾片冲了一杯饮料。下列 Vc泡腾片的主要成分中,属于有机物的是(填字母序号)。A 维生素 C( C6 H8 O6 )
B 柠檬酸( C6 H8 O7 )
C 碳酸氢钠( NaHCO3 )
10. 甲、乙、丙三种固体(均不含结晶水)在不同温度时的溶解度曲线如图所示, 取甲、乙、丙中的某一种固体进行如图所示的实验,回答下列问题:
 (1)、取用的固体不可能是(2)、以上溶液 a-e 中可能属于饱和溶液的是(3)、0℃时丙溶液中含少量甲,现要得到较多较纯丙固体,可采取的操作方法是(4)、下列有关说法错误的是
(1)、取用的固体不可能是(2)、以上溶液 a-e 中可能属于饱和溶液的是(3)、0℃时丙溶液中含少量甲,现要得到较多较纯丙固体,可采取的操作方法是(4)、下列有关说法错误的是a 0℃时,相同质量的甲、乙、丙配制成饱和溶液乙需要的水最多
b 0℃时,甲、乙、丙的饱和溶液升温到 50℃所得的溶液质量分数甲>乙>丙
c 甲、乙、丙饱和溶液从 40℃降温到 20℃,析出晶体最多的是甲
d 溶液 d 和溶液 e 的溶质质量分数可能相同
三、流程题
-
11. 现有两包固体样品,取少量分别溶于水得甲、乙两溶液,它们中的溶质是由KNO3、FeCl3、Fe2(SO4)3、NaNO3、NaOH、Na2SO4中的一种或几种组成,为确定其组成,有人进行了下图所示实验(假设每步均恰好完全反应),试推测:
 (1)、A 是 , 溶液甲中一定不含的物质是 .(2)、若测定溶液甲中溶质只有 FeCl3 , 则从原两包样品中各取少量混合,乙中一定含有的物质有 . (写化学式,下同)(3)、加入溶液丁后发生的化学方程式是 .(4)、甲溶液最多含有种溶质,其组成是 .
(1)、A 是 , 溶液甲中一定不含的物质是 .(2)、若测定溶液甲中溶质只有 FeCl3 , 则从原两包样品中各取少量混合,乙中一定含有的物质有 . (写化学式,下同)(3)、加入溶液丁后发生的化学方程式是 .(4)、甲溶液最多含有种溶质,其组成是 .四、实验题
-
12. 某纯碱样品中可能含有NaHCO3和 NaCl 中的一种或两种杂质,为确定其成分, 进行以下实验探究,实验装置和主要实验步骤如下:

①称量 D、E 装置总质量为 200.0g,将10.6g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2 , 关闭K3 , 缓缓鼓入一段时间空气;
②进行实验操作甲,然后加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1 , 从导管a 处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E 的总质量为 204.84g. 回答下列问题:
(1)、步骤②中进行实验操作甲是;(2)、装置 B 中一定发生的化学方程式是;(3)、反应结束后打开止水夹K1 , 缓缓鼓入空气的目的是;(4)、若装置 B 中生成CO2的质量为 4.84g.通过计算说明纯碱中()含NaHCO3。A 一定
B 一定不
C 可能
D 无法确定
(5)、另取 10.6 样品,加入 ag14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为 W,当W 的值满足条件时,样品中含有 NaCl。五、计算题
-
13. 将8.0g Cu–Zn 合金粉末放到盛有20g 稀硫酸的烧杯中,恰好完全反应, 过滤、称量滤液的质量。相关实验数据如下:
反应前物质的质量 / g
反应后物质的质量 / g
Cu–Zn 合金
稀硫酸
滤液
8.0
20
22.52
若不考虑该合金中除 Cu、Zn 以外的其它成分, 请计算原 Cu–Zn 合金中Zn的质量分数, 写出必要的计算过程。
-
-