福建省三明市永安市2020年中考化学二模试卷
试卷更新日期:2021-04-20 类型:中考模拟
一、单选题
-
1. 下列是中国古代四大发明的某一工艺流程或应用,其中属于化学变化的是( )A、破布捣烂(造纸) B、活字排版(印刷) C、烟花燃放(火药) D、航海导向(指南针)2. 从分子或原子的角度分析并解释下列现象,其中正确的是( )A、氧气液化——分子变小 B、温度计中的水银热胀冷缩——原子体积改变 C、铜在空气中加热变黑——原子种类发生改变 D、搜救犬通过闻气味找到搜寻的目标——分子在不断运动3. “山青水绿、天蓝地净”要靠我们大家共同创造和维护。下列做法与此相违背的是( )A、参与植树造林,扩大植被面积 B、改进污水处理技术,减少水体污染 C、节日燃放烟花爆竹,增加喜庆气氛 D、使用新型可降解塑料、减少白色污染4. 下列实验操作能达到实验目的是( )A、
 收集氧气
B、
收集氧气
B、 测定盐酸pH
C、
测定盐酸pH
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 蒸干滤液
5. 金、铜、银按一定比例制成合金,具有柔和的粉红玫瑰色彩,被称为“玫瑰金”,广泛用于首饰设计和加工。下列叙述正确的是( )A、玫瑰金是一种新型金属单质 B、玫瑰金属于合成材料 C、玫瑰金的化学性质比较活泼 D、玫瑰金具有较好的可塑性6. 如图是某反应的微观示意图。下列说法错误的是( )
蒸干滤液
5. 金、铜、银按一定比例制成合金,具有柔和的粉红玫瑰色彩,被称为“玫瑰金”,广泛用于首饰设计和加工。下列叙述正确的是( )A、玫瑰金是一种新型金属单质 B、玫瑰金属于合成材料 C、玫瑰金的化学性质比较活泼 D、玫瑰金具有较好的可塑性6. 如图是某反应的微观示意图。下列说法错误的是( )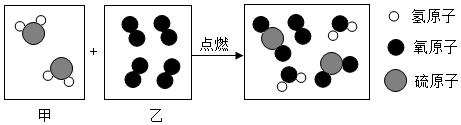 A、反应后分子总数减少 B、生成物均为氧化物 C、该反应是化合反应 D、参加反应的甲、乙分子个数比为2:37. 2019年诺贝尔化学奖得主为锂电池研究者,碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法正确的是( )A、碳酸乙烯酯是由三个碳原子,四个氢原子和三个氧原子构成的 B、其中C,H,O三种元素的质量比为3: 4: 3 C、其中碳元素的质量分数最大 D、碳酸乙烯酯的相对分子质量为888. 分类、归纳等是化学学习的常用方法。下列分类、归纳中正确的是()A、氧化物:SO2、C6H12O6 B、复合肥料:KNO3、CO(NH2)2 C、人体必需微量元素:Ca、Se D、有机物:C2H5OH、CH3COOH9. 下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
A、反应后分子总数减少 B、生成物均为氧化物 C、该反应是化合反应 D、参加反应的甲、乙分子个数比为2:37. 2019年诺贝尔化学奖得主为锂电池研究者,碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法正确的是( )A、碳酸乙烯酯是由三个碳原子,四个氢原子和三个氧原子构成的 B、其中C,H,O三种元素的质量比为3: 4: 3 C、其中碳元素的质量分数最大 D、碳酸乙烯酯的相对分子质量为888. 分类、归纳等是化学学习的常用方法。下列分类、归纳中正确的是()A、氧化物:SO2、C6H12O6 B、复合肥料:KNO3、CO(NH2)2 C、人体必需微量元素:Ca、Se D、有机物:C2H5OH、CH3COOH9. 下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )选项
物质
除杂试剂(足量)
操作方法
A
CO2(HCl)
氢氧化钠溶液
气体通过盛有烧碱溶液的洗气瓶
B
NaCl(Na2CO3)
盐酸
加入足量盐酸、蒸发、结晶
C
NaCl(MnO2)
水
加足量水溶解、过滤、洗涤、干燥
D
Cu(CuO)
氧气
通入足量氧气并加热
A、A B、B C、C D、D10. 取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是( )A、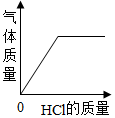
B、
B、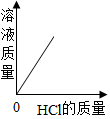
C、
C、
D、
D、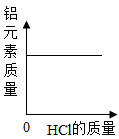
二、填空题
-
11. 化学与生活密切相关,请按要求回答下列问题:(1)、为了全民的健康,我国强制实施食盐加碘,这里的“碘”指的是(填“单质”、“元素”或“原子”),其中主要是添加以碘酸钾(KIO3)为主,碘酸钾是化合物中的。(2)、能够为人体提供能量的营养素是(填序号)
A 糖类 B 蛋白质 C 油脂 D 维生素 E 水 F 无机盐
(3)、许多家庭做饭用的燃料是天然气。①天然气属于能源(填“可再生”或“不可再生”),其燃烧的化学反应方程式。
②若厨房失火时,移走“煤气罐”,这是利用了原理灭火(填字母序号)
A 清除可燃物 B 使可燃物与氧气隔绝
C 降低可燃物的着火点 D 降低温度
12. 化学与生产、生活息息相关。(1)、I.水是生命之道自来水是我国目前主要的生活饮用水.下表是我国生活饮用水的部分标准:
项目
标准
感官指标
无异味、异臭
化学指标
pH6.5﹣8.5,游离氯≥0.3mg/L﹣1 , 铁<0.3mg/L…
①感官指标表现的是自来水的性质(填“物理”或“化学”)。
②化学指标中的pH=6.7时,表明自来水呈性。
③生活可用来区别硬水和软水,常用将硬水软化。
(2)、Ⅱ.硝酸钾的溶解度曲线如图所示。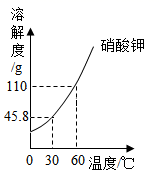
30℃时,硝酸钾的溶解度是。
60℃时,在200g水中加入120g硝酸钾固体,充分搅拌。
①所得溶液是(填“饱和”或“不饱和”)溶液。
②将上述溶液降温至30℃,可析出硝酸钾晶体g,此时溶液的溶质质量分数(填“>”、“=”或“<”)45.8%。
13. 在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。 (1)、在干冰、金刚石、氯化钠三种物质中,由离子构成的是。(2)、图1描述了稀盐酸与硝酸银溶液反应的微观实质,C处应填入的符号为。(3)、在稀盐酸中加入适量镁条的实验中:
(1)、在干冰、金刚石、氯化钠三种物质中,由离子构成的是。(2)、图1描述了稀盐酸与硝酸银溶液反应的微观实质,C处应填入的符号为。(3)、在稀盐酸中加入适量镁条的实验中:①宏观表征:可以观察到的主要现象为 , 固体逐渐溶解;
②微观表征:如图2表示反应前后溶液中的主要离子,写出
 所表示的微粒符号;
所表示的微粒符号;③符号表征:写出化学方程式。
(4)、以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图。如图3为铁的价类图,请分析该图后填写:某化合物化学式为(NH4)2Fe(SO4)2 , 它代表的点是(填“A,B,C,D,E”)。14. 多角度认识物质能帮助我们更全面地了解物质世界。以金属为例回答下列问题:(1)、认识金属元素的存在①地壳中含量最多的金属元素是。在自然界中,大多数金属以化合物的形态存在,而金、铂却能以单质形态存在,这是因为。
②常见铁矿石有:赤铁矿(主要成分Fe2O3)、磁铁矿(主要成分Fe3O4)等。这两种矿石的主要成分含铁元素质量分数较大的是。
③日常生活中防止铁锅生锈的方法有(写一种)。
(2)、认识金属的性质探究金属化学性质的实验如图所示。
①图中只有乙实验没有明显现象,由此得出铜、铁、镍(Ni)在金属活动性顺序中的位置关系,活动性由强到弱的顺序是(填元素符号)。
②写出图中丙实验反应的化学方程式。
(3)、认识金属的用途使用下列金属制品时,主要利用了金属导热性的是(填标号)。A 烤制食物时用的铝箔 B 铜导线 C 黄金首饰 D 打成薄金属片
三、推断题
-
15. 图中A、B、C、D、E是初中化学常见的五种不同类别的物质。A是导致温室效应的一种气体,D的水溶液呈蓝色,B分别能与C和D反应,其生产物之一是Na2SO4 , (图中“—”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系,部分反应物、生成物及反应条件省略)。
 (1)、写出物质A的一种用途。(2)、写出图中属于中和反应的化学方程式。(3)、物质B与D反应的现象。(4)、把物质C转化成D,可加入的试剂是(写一种)。(5)、金属E可选择在金属活动顺序表中介于钠的后面而且在前面的金属。
(1)、写出物质A的一种用途。(2)、写出图中属于中和反应的化学方程式。(3)、物质B与D反应的现象。(4)、把物质C转化成D,可加入的试剂是(写一种)。(5)、金属E可选择在金属活动顺序表中介于钠的后面而且在前面的金属。四、实验题
-
16. 根据所学的知识并结合下列仪器,回答有关问题:
 (1)、写出上述标号仪器的名称:a。(2)、小丽选择上述装置中的A作为制取实验室氧气的发生装置,发生的化学反应方程式为。(3)、小王同学设计了C装置来制取较纯净的氢气,其中锌粒放在细铜网上,则该装置的显著优点是。可用F装置收集氢气的依据是。(4)、选择上述装置中的B作为制取实验室二氧化碳的发生装置,发生的化学反应方程式为 , G装置是化学实验中常用的多功能瓶,若用它来干燥二氧化碳,此时瓶中应该盛放的液体试剂是(填试剂名称),二氧化碳应该从端通入(填“b”或“c”)。(5)、某化学兴趣小组的同学在做酸碱中和反应时,将稀盐酸滴加到盛有氢氧化钠溶液的试管中,没有观察到明显现象(氢氧化钠未变质),小组同学对氢氧化钠溶液与稀盐酸是否发生了化学反应产生了兴趣,他们做了如下实验。
(1)、写出上述标号仪器的名称:a。(2)、小丽选择上述装置中的A作为制取实验室氧气的发生装置,发生的化学反应方程式为。(3)、小王同学设计了C装置来制取较纯净的氢气,其中锌粒放在细铜网上,则该装置的显著优点是。可用F装置收集氢气的依据是。(4)、选择上述装置中的B作为制取实验室二氧化碳的发生装置,发生的化学反应方程式为 , G装置是化学实验中常用的多功能瓶,若用它来干燥二氧化碳,此时瓶中应该盛放的液体试剂是(填试剂名称),二氧化碳应该从端通入(填“b”或“c”)。(5)、某化学兴趣小组的同学在做酸碱中和反应时,将稀盐酸滴加到盛有氢氧化钠溶液的试管中,没有观察到明显现象(氢氧化钠未变质),小组同学对氢氧化钠溶液与稀盐酸是否发生了化学反应产生了兴趣,他们做了如下实验。实验一:小组同学利用温度传感器测定了盐酸与氢氧化钠反应的时间-温度曲线如图1所示。


①由曲线变化情况分析可知,稀盐酸与氢氧化钠溶液发生反应并热量。
②400秒后,曲线开始呈下降趋势的原因是。
实验二:有同学提出还可利用pH的变化判断酸碱是否发生了反应,图 2所示是小组同学利用 pH传感器探究氢氧化钠溶液与稀盐酸反应的pH变化曲线。
③该反应是(填序号),M 点溶液中溶质为(填化学式)。
A 向氢氧化钠溶液中加入稀盐酸 B 向稀盐酸中加入氢氧化钠溶液
五、科学探究题
-
17. 化学兴趣小组用如图装置做电解水实验时,为了使实验现象明显,增强水的导电能力,在水中加入一些氯化钠固体。
 (1)、(实验记录)实验中观察到电极两端有气泡产生,用燃烧木条检验负极产生的气体,气体能够燃烧且产生淡蓝色火焰,说明负极产生的气体是 , 检验正极产生的气体时,闻到刺激性气味。(2)、化学兴趣小组对这异常现象产生兴趣,继续进行探究:
(1)、(实验记录)实验中观察到电极两端有气泡产生,用燃烧木条检验负极产生的气体,气体能够燃烧且产生淡蓝色火焰,说明负极产生的气体是 , 检验正极产生的气体时,闻到刺激性气味。(2)、化学兴趣小组对这异常现象产生兴趣,继续进行探究:(提出问题)正极产生的刺激性气味的气体是什么?
(猜想与假设)猜想1:NH3;猜想2:HCl;猜想3:Cl2;猜想4:HCl和Cl2。
(讨论与交流)大家讨论后认为猜想1不合理,理论依据是。
(3)、(查阅资料)①带有刺激性气味的气体有:HCl、Cl2、NH3等;
②Cl2与水反应生成氯化氢和次氯酸(HClO),氯气能与碘化钾反应生成氯化钾和碘,Cl2有毒且能溶于四氯化碳;
③碘能使淀粉溶液变蓝色;
④HCl不溶于四氯化碳,氯化银难溶于水。
(实验探究)如下图所示,将正极产生的气体依次通过湿润的碘化钾淀粉试纸、四氯化碳、硝酸银溶液、浓氢氧化钠溶液。

(实验现象)观察到装置B中 , 装置D中。
(实验结论)猜想3正确
(4)、(反思评价)装置C中四氯化碳的作用是 , 装置E的目的是处理尾气(5)、(拓展应用)实验结束,向装置A中的液体中滴入无色酚酞溶液,观察到溶液变红色,证明装置A中的液体显(填“酸性”碱性”或“中性”),由此实验可知氯化钠参加反应,电解氯化钠溶液的化学方程式为。
六、计算题
-
18. 2020年5月5日晚18时,长征五号B运载火箭于中国文昌航天发射场完成首次飞行任务,首飞取得圆满成功,成为我国运载能力最大的火箭,“长征五号B”运载火箭也称“冰箭”,因为火箭肚子里装了满满的深低温液氢液氧燃料。请回答:(1)、氢能源开发和利用应攻克的难题是。(2)、计算每1kg液态氢充分燃烧需要的助燃剂液氧的质量是多少?
( )
-
-
-