广东省云浮市2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2021-04-15 类型:期末考试
一、单选题
-
1. 下列物质中,属于高分子化合物的是( )A、植物油 B、结晶牛胰岛素 C、苯丙氨酸 D、麦芽糖2. 下列有关化学用语的表述错误的是( )A、醛基:-COH B、丙烷的球棍模型:
 C、乙烯的电子式:
C、乙烯的电子式:  D、乙醇的比例模型:
D、乙醇的比例模型:  3. 下列烷烃的系统命名正确的是( )A、1-甲基丁烷 B、2,3-甲基丁烷 C、3-甲基丁烷 D、3-乙基戊烷4. 下列物质中一定互为同系物的是( )A、HCHO与CH3(CH2)4CHO B、
3. 下列烷烃的系统命名正确的是( )A、1-甲基丁烷 B、2,3-甲基丁烷 C、3-甲基丁烷 D、3-乙基戊烷4. 下列物质中一定互为同系物的是( )A、HCHO与CH3(CH2)4CHO B、 与
与  C、CH4与C3H6
D、CH3CH2OH与CH3CH2OCH3
5. 下列说法错误的是( )A、石油是由各种烷烃、环烷烃和芳香烃组成的混合物 B、重油裂化的目的主要是提高轻质油的产量 C、煤和石油均可通过分馏和裂解进行分离和提纯 D、煤、石油、天然气仍然是重要的能源6. 科学研究表明,医用酒精可以有效杀灭新型冠状病毒,下列说法错误的是( )A、医用酒精中乙醇的体积分数为75% B、乙醇可以使人体产生新型冠状病毒抗体 C、乙醇与水能以任意比例互溶 D、乙醇可以使酸性高锰酸钾溶液褪色7. 下列说法错误的是( )A、能量较高、有可能发生有效碰撞的分子称为活化分子 B、活化分子的平均能量与反应物分子的平均能量的差值即为活化能 C、催化剂能参与反应,可降低原反应所需的活化能 D、非活化分子也有可能发生有效碰撞8. 某羧酸酯的分子式为 , 该酯完全水解可得到 羧酸和 丙醇,该羧酸的结构有( )A、4种 B、5种 C、6种 D、7种9. 某化学研究小组探究外界条件(压强、温度)对化学反应 平衡的影响图像如图所示,下列判断正确的是( )
C、CH4与C3H6
D、CH3CH2OH与CH3CH2OCH3
5. 下列说法错误的是( )A、石油是由各种烷烃、环烷烃和芳香烃组成的混合物 B、重油裂化的目的主要是提高轻质油的产量 C、煤和石油均可通过分馏和裂解进行分离和提纯 D、煤、石油、天然气仍然是重要的能源6. 科学研究表明,医用酒精可以有效杀灭新型冠状病毒,下列说法错误的是( )A、医用酒精中乙醇的体积分数为75% B、乙醇可以使人体产生新型冠状病毒抗体 C、乙醇与水能以任意比例互溶 D、乙醇可以使酸性高锰酸钾溶液褪色7. 下列说法错误的是( )A、能量较高、有可能发生有效碰撞的分子称为活化分子 B、活化分子的平均能量与反应物分子的平均能量的差值即为活化能 C、催化剂能参与反应,可降低原反应所需的活化能 D、非活化分子也有可能发生有效碰撞8. 某羧酸酯的分子式为 , 该酯完全水解可得到 羧酸和 丙醇,该羧酸的结构有( )A、4种 B、5种 C、6种 D、7种9. 某化学研究小组探究外界条件(压强、温度)对化学反应 平衡的影响图像如图所示,下列判断正确的是( ) A、由图可知,该反应的正反应为吸热反应 B、由图可知,若 ,则该反应中 C、图中,点 和点 的反应速率大小为 D、当反应达到平衡时,只加入催化剂, 的百分含量将发生变化10. 环己烷可经过以下四步反应合成1,2-环已二醇,其中属于加成反应的是( )
A、由图可知,该反应的正反应为吸热反应 B、由图可知,若 ,则该反应中 C、图中,点 和点 的反应速率大小为 D、当反应达到平衡时,只加入催化剂, 的百分含量将发生变化10. 环己烷可经过以下四步反应合成1,2-环已二醇,其中属于加成反应的是( ) A、① B、② C、③ D、④11. 下列反应方程式书写正确的是( )A、用对苯二甲酸与乙二醇合成涤纶:n
A、① B、② C、③ D、④11. 下列反应方程式书写正确的是( )A、用对苯二甲酸与乙二醇合成涤纶:n +n
+n 
 +2nH2O
B、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3) +2OH- CH3COO-+NH +3NH3+2Ag↓+H2O
C、实验室用液溴和苯在催化剂作用下制溴苯:2
+2nH2O
B、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3) +2OH- CH3COO-+NH +3NH3+2Ag↓+H2O
C、实验室用液溴和苯在催化剂作用下制溴苯:2  十Br2 2
十Br2 2  D、由丙烯合成聚丙烯:nCH2=CHCH3
D、由丙烯合成聚丙烯:nCH2=CHCH3 
 12. 某有机物的结构简式如图所示,下列关于该有机物的性质说法正确的是( )
12. 某有机物的结构简式如图所示,下列关于该有机物的性质说法正确的是( ) A、可与银氨溶液反应,不与FeCl3溶液发生显色反应 B、可与H2反应,1mol该物质最多消耗6molH2 C、1mol该物质与NaHCO3溶液反应,最多消耗1molNaHCO3 D、1mol该物质与NaOH溶液反应,最多消耗3molNaOH13. 下列说法正确的是( )A、常温下,将 的 溶液加水稀释到10倍后,溶液的 B、下列离子在由水电离出的 的溶液中能大量共存: 、 、 、 C、相同浓度的 溶液与 溶液相对比,前者的 较小 D、已知 溶液显酸性,则在该溶液中微粒浓度由大到小的顺序是14. 电化学在日常生活中用途广泛,甲是原电池装置,电池总反应为 ,乙是电解池装置,用于含 的工业废水的处理。下列说法错误的是( )
A、可与银氨溶液反应,不与FeCl3溶液发生显色反应 B、可与H2反应,1mol该物质最多消耗6molH2 C、1mol该物质与NaHCO3溶液反应,最多消耗1molNaHCO3 D、1mol该物质与NaOH溶液反应,最多消耗3molNaOH13. 下列说法正确的是( )A、常温下,将 的 溶液加水稀释到10倍后,溶液的 B、下列离子在由水电离出的 的溶液中能大量共存: 、 、 、 C、相同浓度的 溶液与 溶液相对比,前者的 较小 D、已知 溶液显酸性,则在该溶液中微粒浓度由大到小的顺序是14. 电化学在日常生活中用途广泛,甲是原电池装置,电池总反应为 ,乙是电解池装置,用于含 的工业废水的处理。下列说法错误的是( ) A、甲中负极发生的电极反应为 B、乙中 向惰性电极移动 C、乙中惰性电极作阴极 D、当消耗 镁时,理论上也消耗 铁15. 实验室经常利用KMnO4来检验产物或验证性质,图示为部分装置图,下列说法错误的是( )
A、甲中负极发生的电极反应为 B、乙中 向惰性电极移动 C、乙中惰性电极作阴极 D、当消耗 镁时,理论上也消耗 铁15. 实验室经常利用KMnO4来检验产物或验证性质,图示为部分装置图,下列说法错误的是( )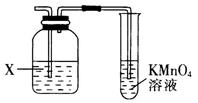 A、若X为NaOH溶液时,则KMnO4可用于溴乙烷发生消去反应的产物检验 B、若X为NaOH溶液时,则KMnO4可用于乙醇发生消去反应的产物检验 C、若X为CuSO4溶液时,则KMnO4可用于实验室制取乙炔时验证其性质 D、若X为溴水,则KMnO4可用于乙醛发生还原反应的产物检验
A、若X为NaOH溶液时,则KMnO4可用于溴乙烷发生消去反应的产物检验 B、若X为NaOH溶液时,则KMnO4可用于乙醇发生消去反应的产物检验 C、若X为CuSO4溶液时,则KMnO4可用于实验室制取乙炔时验证其性质 D、若X为溴水,则KMnO4可用于乙醛发生还原反应的产物检验二、综合题
-
16. 某含 、 、 三种元素的未知物 ,现对 进行分析探究。(1)、经燃烧分析实验测定,该未知物中碳的质量分数为41.38%,氢的质量分数为3.45%,则 的实验式为。(2)、利用质谱法测定得 的相对分子质量为116,则 的分子式为。(3)、 的红外光谱图如下,分析该图得出 中含2种官能团,官能团的名称是、。
 (4)、 的核磁共振氢谱图如下,综合分析 的结构简式为。
(4)、 的核磁共振氢谱图如下,综合分析 的结构简式为。 17. 咖啡酸 有止血功效,存在于多种中药中其结构简式如图所示。
17. 咖啡酸 有止血功效,存在于多种中药中其结构简式如图所示。 (1)、写出咖啡酸中含氧官能团的名称:。(2)、足量的金属钠和足量的小苏打分别与等量的咖啡酸完全反应,产生的气体在相同状况下的体积比为。(3)、根据咖啡酸的结构简式,列举2种咖啡酸可以发生反应的反应类型:。(4)、①蜂胶的分子式为 ,在一定条件下可水解生成咖啡酸和一种醇 ,则醇 的分子式为。
(1)、写出咖啡酸中含氧官能团的名称:。(2)、足量的金属钠和足量的小苏打分别与等量的咖啡酸完全反应,产生的气体在相同状况下的体积比为。(3)、根据咖啡酸的结构简式,列举2种咖啡酸可以发生反应的反应类型:。(4)、①蜂胶的分子式为 ,在一定条件下可水解生成咖啡酸和一种醇 ,则醇 的分子式为。②已知醇 含有苯环,且分子结构中无甲基,写出醇 在一定条件下与乙酸反应的化学方程式:
18. 2020 年东京奥运会火炬传递的火炬样式将采用樱花形状。奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热△H1=-2220 kJ/mol;正丁烷的燃烧热△H2= -2878 kJ/mol,异丁烷的燃烧热△H3=-2869.6 kJ/mol。
(1)、写出丙烷燃烧的热化学方程式。(2)、下列有关说法错误的是_____(填序号)。A、奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能 B、异丁烷分子中的碳氢键比正丁烷的多 C、正丁烷比异丁烷稳定(3)、已知A气体的燃烧热为300 kJ/mo1,B气体的燃烧热为500 kJ/mol。现有6 mol 由A和B组成的混合气体,完全燃烧放出的热量是 2000 kJ,则该混合气体中气体 A和气体 B的物质的量之比是。(4)、1 molH2完全燃烧生成液态水放出286 kJ热量。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则氢气的热值是kJ/g。19. 苯乙酮( )广泛用于皂用香精和烟草香精中,实验室可用苯和乙酸酐(
)广泛用于皂用香精和烟草香精中,实验室可用苯和乙酸酐(  ,遇水生成乙酸)在无水AlCl3作用下制取,操作如下:
,遇水生成乙酸)在无水AlCl3作用下制取,操作如下: 步骤一:在A中加入30mL干燥的苯和30g无水AlCl3粉末,在剧烈搅拌下,缓慢滴入7mL乙酸酐,控制反应温度为30℃,反应过程中释放出HCl气体,HCl释放停止后,再加热至90~95℃,回流反应1h,形成黑黄色液体。装置如图1所示。

步骤二:将冷却后的反应瓶置于冰水浴中(如图2所示),加入15mL苯,慢慢加入混合的盐酸冰水,静置分层,分液,无机相用乙醚萃取,与有机相合并,有机相用10%NaOH液洗涤,分液,弃去无机层,有机层用9mL水洗,分液,弃去无机层,有机层用MgSO4干燥。
步骤三:分离提纯苯乙酮。
回答下列问题:
(1)、仪器A的名称是。写出苯与乙酸酐生成苯乙酮的化学方程式:。(2)、仪器B中盛装无水CaCl2 , 其作用是。(3)、步骤二中多次使用到的操作是。(4)、已知常压下:熔点/℃
沸点/℃
苯
5.5
80.1
乙醚
-116.3
34.6
苯乙酮
19.6
202
则步骤三分离提纯苯乙酮使用的操作是;为了收集纯净的苯乙酮馏分,分离苯乙酮应使用下面的图装置。
 20. 甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加入上述耐压容器中,加热并搅拌,达到60℃恒温时,通入CO至一定压强,开始反应后记录容器内压强随时间的变化,直到压强不再变化后,冷却,泄压,取出反应物,抽滤烘干并称量。其反应如下:
20. 甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加入上述耐压容器中,加热并搅拌,达到60℃恒温时,通入CO至一定压强,开始反应后记录容器内压强随时间的变化,直到压强不再变化后,冷却,泄压,取出反应物,抽滤烘干并称量。其反应如下:I:CO(g)+H2O(l) HCOOH(aq) K1 △H1
II:HCOOH(aq)+NaOH(aq) HCOONa(s)+H2O(l) K2 △H2
III:CO(g)+NaOH(aq) HCOONa(s) K3 △H3
回答下列问题:
(1)、K3=(用含K1、K2的代数式表示),△H3=(用含△H1、△H2的代数式表示)。(2)、若需加快反应I的速率,下列措施可行的是 (填标号)。A、增大CO的初始压强 B、适当升高温度 C、减少乙醇浓度 D、降低搅拌转速(3)、利用反应CO(g)+NaOH(aq) HCOONa(s)在一定条件下可制取HCOONa,在恒温60℃以投料比均为n(NaOH):n(CO)=0.7投料,CO的初始压强分别为0.5MPa、1.5MPa、2.0MPa时,测得CO的转化率X(CO)与时间t的关系如图所示,则:
①图中表示2.0MPa的曲线为 (填字母)。
②写出HCOONa水解的离子方程式:。
③写出提高HCOONa产率的一条措施:。
21. 芳香族化合物( )是一种重要的有机化工原料,可发生如下一系列变化。
)是一种重要的有机化工原料,可发生如下一系列变化。 
已知: 的相对分子质量为60,其核磁共振氢谱有4组峰; 中的官能团两两不相邻。
请回答下列问题:
(1)、 的分子式为。(2)、反应⑤的化学方程式为。(3)、 为 的芳香族同分异构体,写出满足下列条件的 的结构简式:。a.能发生银镜反应b.不能发生水解反应c.核磁共振氢谱中吸收峰面积比为
(4)、设计以 为原料合成高分子化合物
为原料合成高分子化合物  的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)