吉林省长春市农安县2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2021-04-15 类型:期末考试
一、单选题
-
1. 能源是现代社会发展的主要支柱,下列属于二次能源的是( )A、太阳能 B、水力 C、潮汐能 D、电力2. 下列对于元素周期表结构的叙述中,正确的是( )A、7个横行代表7个周期,18个纵行代表18个族 B、副族元素中没有非金属元素 C、除第一周期外,其他周期均有18种元素 D、碱金属元素是指ⅠA族的所有元素3. 下列各组性质比较错误的是( )A、氢化物的热稳定性:H2S>HCl B、酸性:HClO4>H2SO4 C、碱性: Mg(OH)2>Al(OH)3 D、原子半径Cl>F4. 下列粒子中,半径最小的是( )A、Na+ B、Na C、Mg2+ D、Cl-5. 13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是( )A、13C与15N有相同的中子数 B、13C与C60互为同位素 C、15N与14N互为同位素 D、15N的核外电子数与中子数相同6. 下列含有离子键的物质是( )。A、Fe B、 C、HCl D、NaCl7. 下列说法错误的是( )A、CO燃烧是放热反应 B、H2SO4与NaOH反应是放热反应 C、CaCO3受热分解是吸热反应 D、CaO与H2O反应是吸热反应8. 下列分子式不止表示一种物质的是( )A、C3H8 B、C4H10 C、CHCl3 D、CH2Cl29. 下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )A、10℃ 20mL 3mol/L的盐酸溶液 B、20℃ 10mL 4mol/L的盐酸溶液 C、20℃ 20mL 2mol/L的盐酸溶液 D、20℃ 30mL 2mol/L的盐酸溶液10. 下列装置中能够形成原电池的是( )A、
 B、
B、 C、
C、 D、
D、 11. 某主族元素R的最高正化合价和最低负化合价的代数和等于4,由此可以判断( )A、R一定是第四主族元素 B、R一定是第四周期元素 C、R的气态氢化物的稳定性一定比同族元素的氢化物稳定 D、R的气态氢化物的化学式可以表示为H2R12. 下列有关电池的说法错误的是( )A、手机上用的锂离子电池属于二次电池 B、锌锰干电池中,锌电极是负极 C、氢氧燃料电池可把化学能转化为电能 D、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极13. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热).下列示意图中,能正确表示总反应过程中能量变化的是( )A、
11. 某主族元素R的最高正化合价和最低负化合价的代数和等于4,由此可以判断( )A、R一定是第四主族元素 B、R一定是第四周期元素 C、R的气态氢化物的稳定性一定比同族元素的氢化物稳定 D、R的气态氢化物的化学式可以表示为H2R12. 下列有关电池的说法错误的是( )A、手机上用的锂离子电池属于二次电池 B、锌锰干电池中,锌电极是负极 C、氢氧燃料电池可把化学能转化为电能 D、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极13. 反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热).下列示意图中,能正确表示总反应过程中能量变化的是( )A、 B、
B、 C、
C、 D、
D、 14. 下列各组元素性质或原子结构的递变的叙述中错误的是( )A、Na、Mg、Al原子最外层电子数依次增多 B、P、S、Cl元素最高正化合价依次增大 C、N、O、F得电子能力依次减弱 D、Li、Na、K失电子能力依次增强15. 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2-+2e-→C,B-2e-→B2+则A、B、C、D金属性由强到弱的顺序为( )A、A>B>C>D B、A>B>D>C C、D>C>A>B D、D>A>B>C16. 一定温度下的恒容密闭容器中,发生可逆反应2NO2(g) 2NO(g)+O2(g)下面选项中不能作为达到化学平衡状态标志的是( )A、单位时间内生成nmolO2的同时生成2nmolNO2 B、混合气体的总压强不再变化 C、NO2、NO、O2的浓度之比为2∶2∶1 D、混合气体的颜色不再改变17. 不溶于水且比水轻的一组液体是( )A、甲苯、四氯化碳 B、苯、汽油 C、硝基苯、一氯丙烷 D、酒精、溴18. 下列说法中错误的是( )A、乙烯与Br2的加成,乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 B、用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 C、相同物质的量的乙烯和甲烷完全燃烧消耗的氧气的量相同 D、利用燃烧的方法可以鉴别乙烯和甲烷19. 乙醇分子结构式如图所示,下列反应及断键部位错误的是( )
14. 下列各组元素性质或原子结构的递变的叙述中错误的是( )A、Na、Mg、Al原子最外层电子数依次增多 B、P、S、Cl元素最高正化合价依次增大 C、N、O、F得电子能力依次减弱 D、Li、Na、K失电子能力依次增强15. 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2-+2e-→C,B-2e-→B2+则A、B、C、D金属性由强到弱的顺序为( )A、A>B>C>D B、A>B>D>C C、D>C>A>B D、D>A>B>C16. 一定温度下的恒容密闭容器中,发生可逆反应2NO2(g) 2NO(g)+O2(g)下面选项中不能作为达到化学平衡状态标志的是( )A、单位时间内生成nmolO2的同时生成2nmolNO2 B、混合气体的总压强不再变化 C、NO2、NO、O2的浓度之比为2∶2∶1 D、混合气体的颜色不再改变17. 不溶于水且比水轻的一组液体是( )A、甲苯、四氯化碳 B、苯、汽油 C、硝基苯、一氯丙烷 D、酒精、溴18. 下列说法中错误的是( )A、乙烯与Br2的加成,乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 B、用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 C、相同物质的量的乙烯和甲烷完全燃烧消耗的氧气的量相同 D、利用燃烧的方法可以鉴别乙烯和甲烷19. 乙醇分子结构式如图所示,下列反应及断键部位错误的是( ) A、乙醇与钠的反应是①键断裂 B、乙醇的催化氧化反应是②③键断裂 C、乙醇的完全燃烧是①②③④⑤键断裂 D、乙醇与乙酸发生酯化反应是①键断裂20. 有机化合物
A、乙醇与钠的反应是①键断裂 B、乙醇的催化氧化反应是②③键断裂 C、乙醇的完全燃烧是①②③④⑤键断裂 D、乙醇与乙酸发生酯化反应是①键断裂20. 有机化合物 可能发生的化学反应有( )
可能发生的化学反应有( ) ①加成反应②氧化反应③取代反应④加聚反应
A、①③ B、①②③④ C、②③④ D、①③④二、综合题
-
21. 某同学设计了如下实验流程:在一个小烧杯里,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如图所示,回答下列问题:
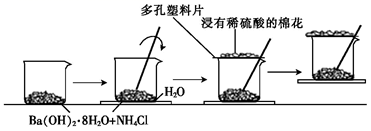 (1)、实验中玻璃棒的作用是。(2)、浸有稀硫酸的棉花的作用是。(3)、请写出该反应的化学反应方程式:。(4)、通过现象,说明该反应为(填“吸热”或“放热”)反应,这是因为反应物的总能量(填“>”“<”或“=”)生成物的总能量。22.(1)、反应3A(g)+B(g)=2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是。(用序号表示)(2)、某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)、实验中玻璃棒的作用是。(2)、浸有稀硫酸的棉花的作用是。(3)、请写出该反应的化学反应方程式:。(4)、通过现象,说明该反应为(填“吸热”或“放热”)反应,这是因为反应物的总能量(填“>”“<”或“=”)生成物的总能量。22.(1)、反应3A(g)+B(g)=2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是。(用序号表示)(2)、某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
①该反应的化学方程式为。
②反应开始至2min,以气体Z表示的平均反应速率为。
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填“大”,“小”或“相等”,下同),混合气体密度比起始时。
④上述反应,在第2min时,X的转化率为。
23.(1)、由铜、铁和硫酸铜溶液组成的原电池中,作正极的是(填化学式),正极的电极反应式为;电子由(填“正”或“负”,下同)极经导线移向极,总反应的离子方程式为。(2)、若以反应 来设计原电池,则电池的负极材料是(填化学式,下同),电解质溶液为溶液。 24. 乙醇和乙酸是生活中常见的有机物。(1)、如图所示为(填“乙醇”或“乙酸”)的球棍模型。
24. 乙醇和乙酸是生活中常见的有机物。(1)、如图所示为(填“乙醇”或“乙酸”)的球棍模型。 (2)、乙醇中所含有的官能团的名称为 , 乙酸中所含有的官能团的名称为。(3)、写出实验室由乙醇制取乙醛的化学反应方程式。(4)、写出如图所示装置中乙醇和乙酸反应的化学方程式:。该反应的类型为反应,右侧小试管中应装有溶液。
(2)、乙醇中所含有的官能团的名称为 , 乙酸中所含有的官能团的名称为。(3)、写出实验室由乙醇制取乙醛的化学反应方程式。(4)、写出如图所示装置中乙醇和乙酸反应的化学方程式:。该反应的类型为反应,右侧小试管中应装有溶液。