陕西省咸阳市乾县第二中学2019-2020学年高一下学期化学期中考试试卷
试卷更新日期:2021-04-12 类型:期中考试
一、单选题
-
1. 下列说法错误的是( )A、太阳能电池可用硅材料制作,其应用有利于环保、节能 B、SiO2可用于制造光导纤维 C、Na2SiO3水溶液俗称水玻璃,可用作木材防火剂及黏胶剂 D、建设三峡大坝使用了大量水泥,水泥是有机材料2. 简单原子的原子结构可用下图来形象表示:
①
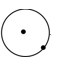 ②
②  ③
③ 
其中·表示质子或电子,°表示中子,则下列有关的叙述中,正确的是( )
A、①②③为同素异形体 B、①②③互为同位素 C、①②③是三种化学性质不同的粒子 D、①②③具有相同的质量数3. 关于原子结构的叙述正确的是( )A、所有的原子核都是由质子和中子组成的 B、原子的最外层电子数不超过8个 C、稀有气体原子的最外层电子数均为8 D、原子的次外层电子数都是24. 下列化合物中,既有离子键,又有共价键的是( )A、KOH B、CaCl2 C、H2O D、NH35. 随着核电荷数的递增,氧化性逐渐减弱的一组是( )A、I2、Br2、Cl2、F2 B、F2、Cl2、Br2、I2 C、F-、Cl-、Br-、I- D、Li、Na、K、Rb6. 下列元素中,原子半径最大的是( )A、Li B、Na C、F D、Cl7. 下列有关化学用语表达错误的是( )A、氮气的电子式:∶N∶∶∶N∶ B、CO2分子的结构式:O=C=O C、Na的原子结构示意图: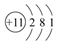 D、钙离子的电子式:Ca2+
8. 下列递变规律正确的是( )A、O,S,Na、K的原子半径依次增大 B、Na、Mg、Al、Si的金属性逐渐增强 C、HF,HCl、H2S,PH3的稳定性依次增强 D、KOH,Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强9. 下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是( )A、元素X:它的原子中M层比L层少2个电子 B、元素Y:它的二价阳离子核外电子总数与氩原子相同 C、元素Z:位于元素周期表中的第三周期ⅢA 族 D、元素W:它的焰色反应颜色呈黄色10. 下列装置能构成原电池的是( )A、
D、钙离子的电子式:Ca2+
8. 下列递变规律正确的是( )A、O,S,Na、K的原子半径依次增大 B、Na、Mg、Al、Si的金属性逐渐增强 C、HF,HCl、H2S,PH3的稳定性依次增强 D、KOH,Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强9. 下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是( )A、元素X:它的原子中M层比L层少2个电子 B、元素Y:它的二价阳离子核外电子总数与氩原子相同 C、元素Z:位于元素周期表中的第三周期ⅢA 族 D、元素W:它的焰色反应颜色呈黄色10. 下列装置能构成原电池的是( )A、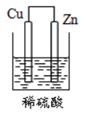 B、
B、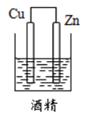 C、
C、 D、
D、 11. 在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol/L,在此时间内用NH3表示的反应速率为0.30 mol/(L·s)。则此一段时间是( )A、1秒 B、2秒 C、0.44秒 D、1.33秒12. A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )A、A>B>C B、A>C>B C、C>B>A D、B>C>A13. 已知可逆反应2SO2+O2 2SO3是放热反应,下列说法正确的是( )A、2 molSO2与1molO2能完全反应生成2 mol SO3 , 升高温度可以加快此反应的化学反应速率 B、2molSO2与1molO2不能完全反应生成2molSO3 , 升高温度可以加快此反应的化学反应速率 C、2mol SO2与1 molO2能完全反应生成2molSO3 , 升高温度减慢此反应的化学反应速率 D、2molSO2与1molO2不能完全反应生成2molSO3 , 升高温度减慢此反应的化学反应速率14. 据报道,氢燃料电池公交汽车已经驶上北京街头,下列说法中,正确的是( )A、电解水制取氢气是理想而经济的制氢方法 B、发展氢燃料电池汽车不需要安全高效的储氢技术 C、氢燃料电池汽车的使用可以有效减少城市空气污染 D、氢燃料电池把氢气和氧气燃烧放出的热能转化为电能15. 下列说法中,正确的是( )A、在周期表中,族序数都等于该族元素的最外层电子数 B、非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 C、卤素单质随原子序数的增大,其熔沸点逐渐降低 D、碱金属随原子序数的增大,其熔沸点逐渐降低16. 根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )A、固体氯化钠溶于水 B、氯化铵受热分解生成氯化氢和氨气 C、冰经加热变成水蒸气 D、氯化氢溶于水17. 关于金属钾的叙述中,错误的是( )。A、与水反应时,比钠还剧烈 B、它的原子半径比钠的原子半径小 C、密度比钠小 D、它可以作还原剂18. 人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等。如果从能量变化的角度来认识,下面说法中,正确的是( )A、化学变化都是放热的 B、化学变化都是吸热的 C、反应物所含能量等于生成物所含能量 D、化学反应前后反应物和生成物所含能量会发生变化19. 对于可逆反应M+N Q达到平衡时,下列说法中,正确的是( )A、M、N、Q三种物质的浓度一定相等 B、M、N全部变成了Q C、反应已经停止 D、反应混合物各成分的百分组成不再变化20. 电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是( )A、CO和CO2 B、NO和NO2 C、CH4和NH3 D、CO2和SO221. 下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )A、盐酸与氢氧化钠溶液反应 B、氯化氢溶于水 C、氯化氢与氨气反应生成氯化铵固体 D、锌与稀硫酸反应22. 在离子RO 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )A、A–x+n+48 B、A–x+n+24 C、A–x-n–24 D、A+x-n–24
11. 在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol/L,在此时间内用NH3表示的反应速率为0.30 mol/(L·s)。则此一段时间是( )A、1秒 B、2秒 C、0.44秒 D、1.33秒12. A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )A、A>B>C B、A>C>B C、C>B>A D、B>C>A13. 已知可逆反应2SO2+O2 2SO3是放热反应,下列说法正确的是( )A、2 molSO2与1molO2能完全反应生成2 mol SO3 , 升高温度可以加快此反应的化学反应速率 B、2molSO2与1molO2不能完全反应生成2molSO3 , 升高温度可以加快此反应的化学反应速率 C、2mol SO2与1 molO2能完全反应生成2molSO3 , 升高温度减慢此反应的化学反应速率 D、2molSO2与1molO2不能完全反应生成2molSO3 , 升高温度减慢此反应的化学反应速率14. 据报道,氢燃料电池公交汽车已经驶上北京街头,下列说法中,正确的是( )A、电解水制取氢气是理想而经济的制氢方法 B、发展氢燃料电池汽车不需要安全高效的储氢技术 C、氢燃料电池汽车的使用可以有效减少城市空气污染 D、氢燃料电池把氢气和氧气燃烧放出的热能转化为电能15. 下列说法中,正确的是( )A、在周期表中,族序数都等于该族元素的最外层电子数 B、非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 C、卤素单质随原子序数的增大,其熔沸点逐渐降低 D、碱金属随原子序数的增大,其熔沸点逐渐降低16. 根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )A、固体氯化钠溶于水 B、氯化铵受热分解生成氯化氢和氨气 C、冰经加热变成水蒸气 D、氯化氢溶于水17. 关于金属钾的叙述中,错误的是( )。A、与水反应时,比钠还剧烈 B、它的原子半径比钠的原子半径小 C、密度比钠小 D、它可以作还原剂18. 人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等。如果从能量变化的角度来认识,下面说法中,正确的是( )A、化学变化都是放热的 B、化学变化都是吸热的 C、反应物所含能量等于生成物所含能量 D、化学反应前后反应物和生成物所含能量会发生变化19. 对于可逆反应M+N Q达到平衡时,下列说法中,正确的是( )A、M、N、Q三种物质的浓度一定相等 B、M、N全部变成了Q C、反应已经停止 D、反应混合物各成分的百分组成不再变化20. 电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是( )A、CO和CO2 B、NO和NO2 C、CH4和NH3 D、CO2和SO221. 下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )A、盐酸与氢氧化钠溶液反应 B、氯化氢溶于水 C、氯化氢与氨气反应生成氯化铵固体 D、锌与稀硫酸反应22. 在离子RO 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )A、A–x+n+48 B、A–x+n+24 C、A–x-n–24 D、A+x-n–24二、多选题
-
23. X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是 ( )A、R 一定是共价化合物 B、R一定是离子化合物 C、R可能是共价化合物,也可能是离子化合物 D、R可能是气态物质,也可能是固态物质
三、综合题
-
24.(1)、在 H、 H、 H、 Mg、 Mg和 Cu中共有种元素,种原子,中子数最多的是。(2)、α射线是由α粒子组成的,α粒子是一种没有核外电子的粒子,它带有2个单位正电荷,它的质量数等于4,由此推断α粒子带有个质子,个中子。
四、填空题
-
25. 原电池是一种装置。电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:
Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
电池的负极是 , 正极发生的是反应(填反应类型),总反应式为。
26. 下表列出了①~⑨九种元素在周期表中的位置:ⅠA
ⅧA
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
⑧
3
⑤
⑥
⑦
⑨
请按要求回答下列问题。
(1)、元素④的名称是 , 元素④在周期表中所处位置 , 从元素原子得失电子的角度看,元素④具有(填“氧化性”或“还原性”)。(2)、按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性: (写氢化物的化学式)。(3)、元素⑦的原子结构示意图是。(4)、写出元素⑤形成的单质在氧气中燃烧的化学方程式 , 这一反应是 (填“吸热”或“放热”)反应。(5)、用电子式表示①与⑨反应得到的化合物的形成过程。27. 有A,B,C,D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:(1)、元素名称:ABCD .(2)、写出AB2的电子式为 .(3)、用电子式表示化合物C2D的形成过程 .28. 同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,11.6 g B的氢氧化物恰好能与200 mL 2 mol/L盐酸完全反应,B原子核中质子数与中子数相等。回答以下问题:(1)、B的相对原子质量是多少?原子序数是多少?(2)、A和C各是什么元素?(3)、A、B、C的单质各1 mol分别与足量的稀硫酸反应,产生H2最多的是哪一种单质?该单质产生H2的体积在标准状况下是多少?29. 为测定Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)。实验步骤如下图,填写图中的空白。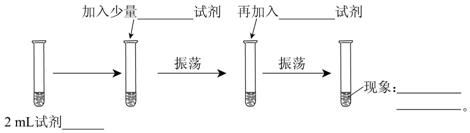 (1)、2 mL试剂;(2)、加入少量试剂;(3)、再加入试剂;(4)、现象。(5)、可以证明Cl2的氧化性(填强于、弱于)Br2的氧化性。(6)、发生反应的离子反应方程式为。
(1)、2 mL试剂;(2)、加入少量试剂;(3)、再加入试剂;(4)、现象。(5)、可以证明Cl2的氧化性(填强于、弱于)Br2的氧化性。(6)、发生反应的离子反应方程式为。
-
-